Contoh soal konfigurasi elektron golongan dan periode – Konfigurasi elektron, sebuah peta jalan untuk memahami perilaku atom, menjadi kunci untuk mengungkap misteri sifat kimia suatu unsur. Bayangkan sebuah atom sebagai sebuah rumah dengan berbagai ruangan, masing-masing mewakili tingkat energi yang berbeda. Konfigurasi elektron menggambarkan bagaimana elektron-elektron menempati ruangan-ruangan ini, memberikan kita gambaran tentang sifat kimia unsur tersebut.
Dalam dunia kimia, tabel periodik menjadi peta yang memandu kita dalam memahami sifat dan perilaku unsur. Golongan dan periode dalam tabel periodik, yang dibentuk berdasarkan konfigurasi elektron, memberikan informasi berharga tentang sifat kimia unsur. Mari kita selami lebih dalam dengan mempelajari contoh soal konfigurasi elektron atom yang berkaitan dengan golongan dan periode dalam tabel periodik.
Konfigurasi Elektron Atom
Konfigurasi elektron atom merupakan susunan elektron-elektron dalam atom yang menggambarkan bagaimana elektron-elektron tersebut menempati tingkat energi dan sub-tingkat energi. Konfigurasi elektron atom sangat penting dalam memahami sifat kimia suatu unsur, seperti reaktivitas, jenis ikatan yang dapat dibentuk, dan sifat fisika seperti titik leleh dan titik didih.
Konfigurasi elektron atom terkait erat dengan golongan dan periode dalam tabel periodik. Golongan dalam tabel periodik menunjukkan jumlah elektron valensi (elektron di kulit terluar) yang sama, sementara periode menunjukkan jumlah kulit elektron yang sama.
Konfigurasi Elektron Atom dan Golongan
Golongan dalam tabel periodik didefinisikan oleh jumlah elektron valensi yang sama. Elektron valensi adalah elektron yang berada di kulit terluar atom dan bertanggung jawab atas sifat kimia suatu unsur. Konfigurasi elektron atom untuk unsur-unsur dalam golongan yang sama memiliki kesamaan pada konfigurasi elektron valensinya.
- Misalnya, golongan IA (alkali) memiliki konfigurasi elektron valensi ns1, seperti Li (2,1), Na (2,8,1), dan K (2,8,8,1).
- Golongan VIIA (halogen) memiliki konfigurasi elektron valensi ns2np5, seperti F (2,7), Cl (2,8,7), dan Br (2,8,18,7).
Konfigurasi Elektron Atom dan Periode
Periode dalam tabel periodik menunjukkan jumlah kulit elektron yang sama. Setiap periode memiliki jumlah kulit elektron yang berbeda, dan konfigurasi elektron atom untuk unsur-unsur dalam periode yang sama menunjukkan perbedaan jumlah kulit elektronnya.
- Misalnya, periode 1 hanya memiliki satu kulit elektron, seperti H (1) dan He (2).
- Periode 2 memiliki dua kulit elektron, seperti Li (2,1) dan Be (2,2).
- Periode 3 memiliki tiga kulit elektron, seperti Na (2,8,1) dan Mg (2,8,2).
Tabel Konfigurasi Elektron Atom Periode 1-3
Berikut adalah tabel konfigurasi elektron atom untuk unsur-unsur pada periode 1 hingga 3:
| Unsur | Nomor Atom | Konfigurasi Elektron |
|---|---|---|
| Hidrogen (H) | 1 | 1s1 |
| Helium (He) | 2 | 1s2 |
| Litium (Li) | 3 | 1s22s1 |
| Berilium (Be) | 4 | 1s22s2 |
| Boron (B) | 5 | 1s22s22p1 |
| Karbon (C) | 6 | 1s22s22p2 |
| Nitrogen (N) | 7 | 1s22s22p3 |
| Oksigen (O) | 8 | 1s22s22p4 |
| Fluor (F) | 9 | 1s22s22p5 |
| Neon (Ne) | 10 | 1s22s22p6 |
| Natrium (Na) | 11 | 1s22s22p63s1 |
| Magnesium (Mg) | 12 | 1s22s22p63s2 |
| Aluminium (Al) | 13 | 1s22s22p63s23p1 |
| Silikon (Si) | 14 | 1s22s22p63s23p2 |
| Fosfor (P) | 15 | 1s22s22p63s23p3 |
| Sulfur (S) | 16 | 1s22s22p63s23p4 |
| Klorin (Cl) | 17 | 1s22s22p63s23p5 |
| Argon (Ar) | 18 | 1s22s22p63s23p6 |
Golongan dan Periode dalam Tabel Periodik: Contoh Soal Konfigurasi Elektron Golongan Dan Periode
Tabel periodik merupakan sistem pengelompokan unsur-unsur kimia berdasarkan sifat-sifatnya yang mirip. Dalam tabel periodik, unsur-unsur disusun dalam baris dan kolom yang memiliki aturan tertentu. Baris horizontal dalam tabel periodik disebut periode, sedangkan kolom vertikal disebut golongan.
Perbedaan Golongan dan Periode
Golongan dan periode dalam tabel periodik memiliki perbedaan yang signifikan.
- Golongan adalah kolom vertikal dalam tabel periodik yang berisi unsur-unsur dengan jumlah elektron valensi yang sama. Elektron valensi adalah elektron yang berada di kulit terluar atom, dan berperan penting dalam menentukan sifat kimia suatu unsur. Misalnya, semua unsur dalam golongan 1 (alkali) memiliki satu elektron valensi, sementara semua unsur dalam golongan 17 (halogen) memiliki tujuh elektron valensi.
- Periode adalah baris horizontal dalam tabel periodik yang berisi unsur-unsur dengan jumlah kulit elektron yang sama. Jumlah kulit elektron menentukan tingkat energi elektron dalam atom. Misalnya, semua unsur dalam periode 2 memiliki dua kulit elektron, sementara semua unsur dalam periode 3 memiliki tiga kulit elektron.
Pengaruh Konfigurasi Elektron terhadap Sifat Kimia Unsur
Konfigurasi elektron atom sangat memengaruhi sifat kimia unsur. Konfigurasi elektron adalah susunan elektron dalam berbagai tingkat energi di sekitar inti atom.
- Unsur-unsur dalam golongan yang sama memiliki konfigurasi elektron valensi yang sama, sehingga memiliki sifat kimia yang mirip. Misalnya, semua unsur alkali memiliki konfigurasi elektron valensi ns1, yang menyebabkan mereka sangat reaktif dan mudah melepaskan satu elektron untuk membentuk ion positif.
- Unsur-unsur dalam periode yang sama memiliki jumlah kulit elektron yang sama, sehingga memiliki sifat kimia yang berbeda. Seiring pertambahan nomor atom dalam satu periode, jari-jari atom cenderung berkurang, dan energi ionisasi cenderung meningkat. Hal ini menyebabkan perubahan sifat kimia unsur-unsur dalam periode yang sama.
Contoh Sifat Kimia Unsur dalam Golongan Alkali dan Halogen
- Golongan alkali (golongan 1) terdiri dari unsur-unsur Li, Na, K, Rb, Cs, dan Fr. Semua unsur alkali memiliki satu elektron valensi dan sangat reaktif. Mereka mudah bereaksi dengan air untuk membentuk basa kuat dan melepaskan hidrogen. Misalnya, natrium (Na) bereaksi dengan air menghasilkan natrium hidroksida (NaOH) dan gas hidrogen (H2).
- Golongan halogen (golongan 17) terdiri dari unsur-unsur F, Cl, Br, I, dan At. Semua unsur halogen memiliki tujuh elektron valensi dan sangat reaktif. Mereka mudah bereaksi dengan logam untuk membentuk garam. Misalnya, klorin (Cl) bereaksi dengan natrium (Na) membentuk garam natrium klorida (NaCl).
Aturan Aufbau dan Prinsip Hund
Konfigurasi elektron atom menggambarkan bagaimana elektron-elektron tersusun dalam berbagai tingkat energi dan sub-tingkat energi dalam atom. Aturan Aufbau dan prinsip Hund adalah dua aturan penting yang membantu kita memahami dan menentukan konfigurasi elektron atom secara sistematis.
Aturan Aufbau
Aturan Aufbau, yang berasal dari bahasa Jerman yang berarti “bangunan”, menyatakan bahwa elektron-elektron dalam atom mengisi orbital dengan tingkat energi terendah terlebih dahulu. Dengan kata lain, elektron-elektron akan mengisi orbital dengan nilai n + l terendah, di mana n adalah bilangan kuantum utama dan l adalah bilangan kuantum azimut.
- n + l yang lebih rendah berarti tingkat energi orbital lebih rendah.
- Jika dua orbital memiliki nilai n + l yang sama, maka orbital dengan nilai n yang lebih rendah memiliki tingkat energi yang lebih rendah.
Sebagai contoh, orbital 2s (n = 2, l = 0, n + l = 2) memiliki tingkat energi yang lebih rendah daripada orbital 2p (n = 2, l = 1, n + l = 3). Oleh karena itu, elektron-elektron akan mengisi orbital 2s terlebih dahulu sebelum mengisi orbital 2p.
Prinsip Hund
Prinsip Hund, yang dikenal juga sebagai aturan Hund, menyatakan bahwa elektron-elektron akan menempati orbital dalam sub-tingkat energi yang sama secara terpisah, dengan spin sejajar, sebelum berpasangan dalam satu orbital.
Hal ini karena elektron-elektron yang memiliki spin sejajar akan memiliki gaya tolak menolak yang lebih rendah dibandingkan dengan elektron-elektron yang memiliki spin berlawanan. Dengan kata lain, elektron-elektron akan lebih stabil jika mereka menempati orbital secara terpisah dengan spin sejajar.
Penerapan Aturan Aufbau dan Prinsip Hund
Mari kita perhatikan contoh atom nitrogen (N) dengan nomor atom 7. Untuk menentukan konfigurasi elektronnya, kita dapat mengikuti aturan Aufbau dan prinsip Hund:
- Jumlah elektron nitrogen adalah 7.
- Berdasarkan aturan Aufbau, elektron-elektron akan mengisi orbital dengan tingkat energi terendah terlebih dahulu, yaitu 1s, 2s, dan 2p.
- Orbital 1s memiliki kapasitas maksimum 2 elektron, jadi konfigurasi elektronnya adalah 1s2.
- Orbital 2s juga memiliki kapasitas maksimum 2 elektron, jadi konfigurasi elektronnya adalah 2s2.
- Orbital 2p memiliki kapasitas maksimum 6 elektron, dan terbagi menjadi tiga orbital 2px, 2py, dan 2pz. Berdasarkan prinsip Hund, elektron-elektron akan menempati ketiga orbital 2p secara terpisah dengan spin sejajar, sebelum berpasangan dalam satu orbital.
- Jadi, konfigurasi elektron nitrogen adalah 1s2 2s2 2p3, dengan tiga elektron pada orbital 2p yang menempati tiga orbital secara terpisah dengan spin sejajar.
Konfigurasi elektron atom yang ditentukan dengan menggunakan aturan Aufbau dan prinsip Hund membantu kita memahami sifat kimia unsur. Misalnya, konfigurasi elektron nitrogen menunjukkan bahwa nitrogen memiliki tiga elektron valensi pada orbital 2p. Hal ini menjelaskan mengapa nitrogen dapat membentuk tiga ikatan kovalen, seperti dalam molekul amonia (NH3).
Contoh soal konfigurasi elektron golongan dan periode bisa jadi rumit, tapi konsepnya sebenarnya sederhana. Misalnya, soal tentang bagaimana cara menentukan golongan dan periode suatu unsur berdasarkan konfigurasi elektronnya. Nah, kalau mau latihan membuat kalimat saran, bisa cek contoh soal kalimat saran kelas 3 SD di situs ini.
Nggak jauh beda, kan? Contoh soal konfigurasi elektron juga bisa diubah ke bentuk kalimat saran, seperti “Saran terbaik untuk menentukan golongan suatu unsur adalah dengan melihat jumlah elektron valensinya.”
Soal Konfigurasi Elektron
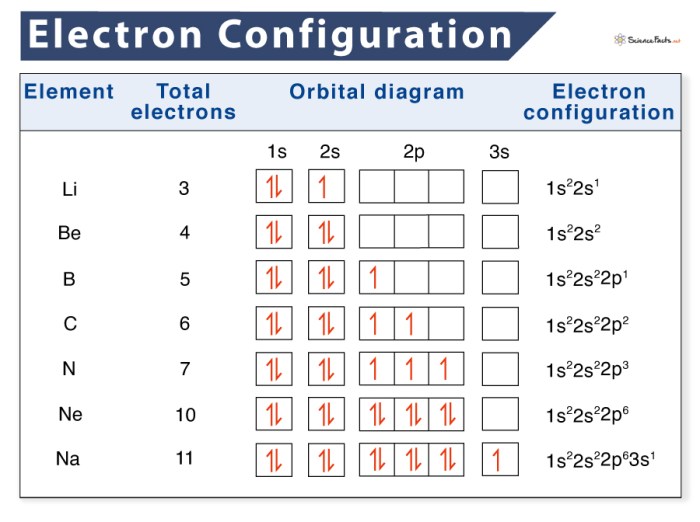
Konfigurasi elektron adalah susunan elektron dalam berbagai tingkat energi atau kulit elektron di sekitar inti atom. Pengetahuan tentang konfigurasi elektron penting untuk memahami sifat kimia suatu atom dan bagaimana atom tersebut berikatan dengan atom lain. Untuk menguji pemahamanmu tentang konfigurasi elektron, berikut beberapa soal latihan yang bisa kamu coba kerjakan.
Soal Konfigurasi Elektron
Berikut ini 5 soal konfigurasi elektron atom yang mencakup berbagai level kesulitan. Soal-soal ini akan membantu kamu memahami konsep dasar konfigurasi elektron dan mengasah kemampuanmu dalam menentukan konfigurasi elektron suatu atom.
- Tentukan konfigurasi elektron atom kalsium (Ca) yang memiliki nomor atom 20.
- Tentukan konfigurasi elektron atom nitrogen (N) yang memiliki nomor atom 7.
- Tentukan konfigurasi elektron atom klorin (Cl) yang memiliki nomor atom 17.
- Tentukan konfigurasi elektron atom besi (Fe) yang memiliki nomor atom 26.
- Tentukan konfigurasi elektron atom sulfur (S) yang memiliki nomor atom 16.
Kunci Jawaban Soal Konfigurasi Elektron
Berikut adalah kunci jawaban untuk soal konfigurasi elektron yang telah kamu kerjakan sebelumnya. Kunci jawaban ini akan membantumu untuk memeriksa hasil pekerjaanmu dan memahami cara menentukan konfigurasi elektron suatu atom.
- Konfigurasi elektron atom kalsium (Ca) adalah 1s2 2s2 2p6 3s2 3p6 4s2.
- Konfigurasi elektron atom nitrogen (N) adalah 1s2 2s2 2p3.
- Konfigurasi elektron atom klorin (Cl) adalah 1s2 2s2 2p6 3s2 3p5.
- Konfigurasi elektron atom besi (Fe) adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d6.
- Konfigurasi elektron atom sulfur (S) adalah 1s2 2s2 2p6 3s2 3p4.
Penjelasan Langkah Demi Langkah Soal Konfigurasi Elektron
Untuk membantu kamu memahami cara menentukan konfigurasi elektron suatu atom, berikut adalah penjelasan langkah demi langkah untuk menyelesaikan soal nomor 1, yaitu menentukan konfigurasi elektron atom kalsium (Ca) yang memiliki nomor atom 20.
- Tentukan jumlah elektron dalam atom. Nomor atom kalsium adalah 20, yang berarti atom kalsium memiliki 20 elektron.
- Isi orbital elektron sesuai aturan Aufbau. Aturan Aufbau menyatakan bahwa elektron mengisi orbital dengan tingkat energi terendah terlebih dahulu. Urutan pengisian orbital adalah 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Tentukan jumlah maksimum elektron yang dapat di tampung setiap orbital. Orbital s dapat menampung maksimal 2 elektron, orbital p dapat menampung maksimal 6 elektron, orbital d dapat menampung maksimal 10 elektron, dan orbital f dapat menampung maksimal 14 elektron.
- Isi orbital dengan elektron sesuai aturan Hund. Aturan Hund menyatakan bahwa elektron akan mengisi orbital dengan spin yang sama terlebih dahulu sebelum mengisi orbital dengan spin yang berlawanan.
Dengan mengikuti langkah-langkah di atas, kita dapat menentukan konfigurasi elektron atom kalsium (Ca) adalah 1s2 2s2 2p6 3s2 3p6 4s2.
Hubungan Konfigurasi Elektron dengan Sifat Kimia
Konfigurasi elektron atom merupakan susunan elektron dalam berbagai tingkat energi dan sub tingkat energi di dalam atom. Susunan ini ternyata memiliki pengaruh besar terhadap sifat kimia suatu unsur. Bagaimana caranya? Mari kita bahas lebih lanjut.
Keelektronegatifan
Keelektronegatifan adalah kemampuan suatu atom untuk menarik elektron dalam ikatan kimia. Konfigurasi elektron memengaruhi keelektronegatifan karena elektron valensi, yaitu elektron pada kulit terluar atom, berperan dalam pembentukan ikatan. Semakin banyak elektron valensi yang dimiliki suatu atom, semakin kuat tarikan inti terhadap elektron valensi, sehingga atom tersebut cenderung menarik elektron dari atom lain dan memiliki keelektronegatifan yang tinggi. Sebagai contoh, unsur-unsur golongan VIIA (halogen) memiliki konfigurasi elektron yang mendekati konfigurasi elektron gas mulia, yaitu hanya kekurangan satu elektron untuk mencapai kestabilan. Hal ini menyebabkan halogen memiliki keelektronegatifan yang tinggi karena mereka cenderung menarik satu elektron untuk mencapai konfigurasi elektron gas mulia.
Energi Ionisasi
Energi ionisasi adalah energi minimum yang diperlukan untuk melepaskan satu elektron dari atom netral dalam keadaan gas. Konfigurasi elektron atom memengaruhi energi ionisasi karena elektron valensi yang terlepas akan menentukan energi ionisasi. Semakin mudah elektron valensi terlepas, semakin rendah energi ionisasi. Unsur-unsur dengan konfigurasi elektron yang stabil, seperti gas mulia, memiliki energi ionisasi yang tinggi karena mereka cenderung mempertahankan konfigurasi elektronnya. Sebaliknya, unsur-unsur dengan konfigurasi elektron yang tidak stabil, seperti logam alkali, memiliki energi ionisasi yang rendah karena mereka mudah melepaskan elektron untuk mencapai konfigurasi elektron gas mulia.
Afinitas Elektron
Afinitas elektron adalah perubahan energi yang terjadi ketika suatu atom netral dalam keadaan gas menerima satu elektron untuk membentuk ion negatif. Konfigurasi elektron atom memengaruhi afinitas elektron karena elektron yang ditambahkan akan mengisi orbital yang kosong atau setengah penuh. Unsur-unsur dengan konfigurasi elektron yang stabil, seperti gas mulia, memiliki afinitas elektron yang rendah karena mereka tidak cenderung menerima elektron tambahan. Sebaliknya, unsur-unsur dengan konfigurasi elektron yang tidak stabil, seperti halogen, memiliki afinitas elektron yang tinggi karena mereka cenderung menerima elektron untuk mencapai konfigurasi elektron gas mulia.
Contoh Penerapan Konfigurasi Elektron
Sebagai contoh, mari kita perhatikan unsur natrium (Na) dan klorin (Cl). Natrium memiliki konfigurasi elektron 1s22s22p63s1, sedangkan klorin memiliki konfigurasi elektron 1s22s22p63s23p5. Natrium hanya memiliki satu elektron valensi, sehingga mudah melepaskan elektron tersebut untuk mencapai konfigurasi elektron gas mulia (Ne), yang stabil. Hal ini menyebabkan natrium memiliki energi ionisasi yang rendah dan cenderung membentuk ion positif (Na+). Sebaliknya, klorin hanya membutuhkan satu elektron lagi untuk mencapai konfigurasi elektron gas mulia (Ar), yang stabil. Hal ini menyebabkan klorin memiliki afinitas elektron yang tinggi dan cenderung membentuk ion negatif (Cl–). Ketika natrium dan klorin bereaksi, natrium akan melepaskan elektron valensinya kepada klorin, membentuk ikatan ionik dan menghasilkan senyawa NaCl (garam dapur).
Prediksi Reaksi Kimia
Konfigurasi elektron atom dapat digunakan untuk memprediksi reaksi kimia dengan memahami kecenderungan unsur untuk membentuk ion. Unsur-unsur dengan konfigurasi elektron yang mudah melepaskan elektron cenderung bereaksi dengan unsur-unsur yang mudah menerima elektron. Sebagai contoh, logam alkali (golongan IA) cenderung melepaskan satu elektron untuk membentuk ion positif, sedangkan halogen (golongan VIIA) cenderung menerima satu elektron untuk membentuk ion negatif. Reaksi antara logam alkali dan halogen akan menghasilkan senyawa ionik, seperti NaCl (garam dapur) yang terbentuk dari reaksi natrium (Na) dan klorin (Cl).
Contoh Soal Konfigurasi Elektron dan Penyelesaiannya
Konfigurasi elektron adalah susunan elektron dalam suatu atom berdasarkan tingkat energi dan orbitalnya. Pengetahuan tentang konfigurasi elektron sangat penting dalam kimia karena dapat membantu kita memahami sifat kimia suatu unsur, seperti reaktivitas, pembentukan ikatan, dan sifat fisik lainnya. Untuk memahami konfigurasi elektron, kita perlu mengetahui golongan dan periode suatu unsur. Golongan dan periode menunjukkan letak unsur dalam tabel periodik dan memberikan informasi tentang jumlah elektron valensi dan kulit elektron terluar.
Dalam artikel ini, kita akan membahas beberapa contoh soal konfigurasi elektron atom yang terkait dengan golongan dan periode, serta menunjukkan langkah-langkah penyelesaiannya.
Contoh Soal Konfigurasi Elektron
Berikut adalah contoh soal konfigurasi elektron atom dan penyelesaiannya.
- Soal: Tentukan konfigurasi elektron atom kalsium (Ca) yang memiliki nomor atom 20.
Penyelesaian:
- Tentukan jumlah elektron dalam atom kalsium. Jumlah elektron dalam atom sama dengan nomor atomnya, yaitu 20 elektron.
- Susun elektron dalam orbital berdasarkan urutan tingkat energi yang meningkat, mengikuti aturan Aufbau dan prinsip Hund.
- Tulis konfigurasi elektron atom kalsium sebagai berikut:
1s2 2s2 2p6 3s2 3p6 4s2
- Perhatikan bahwa konfigurasi elektron ini menunjukkan bahwa atom kalsium memiliki 2 elektron valensi pada kulit terluarnya (kulit ke-4).
Contoh Soal Konfigurasi Elektron dan Golongan
Berikut adalah contoh soal konfigurasi elektron atom yang terkait dengan golongan.
- Soal: Tentukan golongan dari unsur X yang memiliki konfigurasi elektron 1s2 2s2 2p6 3s2 3p5.
Penyelesaian:
- Identifikasi elektron valensi. Elektron valensi adalah elektron yang terletak pada kulit terluar atom. Dalam kasus ini, elektron valensi terletak pada kulit ke-3, yaitu 3s2 3p5.
- Jumlahkan elektron valensi. Jumlah elektron valensi adalah 2 + 5 = 7.
- Tentukan golongan. Karena jumlah elektron valensi adalah 7, maka unsur X berada pada golongan VIIA atau golongan 17.
Contoh Soal Konfigurasi Elektron dan Periode
Berikut adalah contoh soal konfigurasi elektron atom yang terkait dengan periode.
- Soal: Tentukan periode dari unsur Y yang memiliki konfigurasi elektron 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3.
Penyelesaian:
- Identifikasi kulit elektron terluar. Kulit elektron terluar adalah kulit yang memiliki tingkat energi tertinggi. Dalam kasus ini, kulit elektron terluar adalah kulit ke-4.
- Tentukan periode. Nomor periode sama dengan nomor kulit elektron terluar. Karena kulit elektron terluar adalah kulit ke-4, maka unsur Y berada pada periode 4.
Aplikasi Konfigurasi Elektron dalam Kimia
Konfigurasi elektron atom adalah alat yang sangat penting dalam kimia karena memungkinkan kita untuk memahami perilaku atom dan bagaimana mereka berinteraksi satu sama lain. Dengan memahami konfigurasi elektron, kita dapat menjelaskan berbagai konsep penting dalam kimia, seperti ikatan kimia, reaksi kimia, dan sifat fisik zat.
Ikatan Kimia
Konfigurasi elektron atom dapat digunakan untuk menjelaskan bagaimana atom membentuk ikatan kimia. Ada dua jenis ikatan kimia utama: ikatan ion dan ikatan kovalen.
- Ikatan Ion: Ikatan ion terjadi ketika satu atom kehilangan elektron dan menjadi ion positif (kation), sedangkan atom lainnya menerima elektron dan menjadi ion negatif (anion). Kedua ion ini kemudian tertarik satu sama lain karena muatan yang berlawanan. Misalnya, natrium (Na) memiliki konfigurasi elektron 2, 8, 1, sedangkan klorin (Cl) memiliki konfigurasi elektron 2, 8, 7. Natrium akan kehilangan satu elektron untuk mencapai konfigurasi elektron yang stabil seperti gas mulia (neon), sedangkan klorin akan menerima satu elektron untuk mencapai konfigurasi elektron yang stabil seperti gas mulia (argon). Hal ini menghasilkan ion Na+ dan Cl– yang kemudian membentuk ikatan ion untuk membentuk garam NaCl (natrium klorida).
- Ikatan Kovalen: Ikatan kovalen terjadi ketika dua atom berbagi elektron untuk mencapai konfigurasi elektron yang stabil. Misalnya, atom hidrogen (H) memiliki konfigurasi elektron 1. Untuk mencapai konfigurasi elektron yang stabil seperti gas mulia (helium), dua atom hidrogen akan berbagi satu elektron untuk membentuk molekul H2.
Reaksi Kimia
Konfigurasi elektron atom juga dapat digunakan untuk memahami reaksi kimia. Reaksi kimia melibatkan penataan ulang elektron dalam atom dan molekul. Dengan memahami konfigurasi elektron, kita dapat memprediksi bagaimana atom akan bereaksi satu sama lain dan produk apa yang akan dihasilkan.
Sifat Fisik
Konfigurasi elektron atom dapat digunakan untuk memprediksi sifat fisik suatu zat, seperti titik leleh dan titik didih. Misalnya, logam memiliki titik leleh dan titik didih yang tinggi karena elektron valensi mereka mudah bergerak dan membentuk ikatan logam. Sebaliknya, non-logam memiliki titik leleh dan titik didih yang rendah karena elektron valensi mereka terikat erat pada inti atom.
Soal Latihan Konfigurasi Elektron
Konfigurasi elektron menggambarkan bagaimana elektron-elektron dalam suatu atom terdistribusi dalam berbagai tingkat energi dan subkulit. Untuk memahami konfigurasi elektron, kamu perlu memahami aturan Aufbau, prinsip Hund, dan golongan serta periode dalam tabel periodik. Soal-soal latihan berikut ini akan membantumu untuk mengasah pemahamanmu tentang konsep-konsep tersebut.
Soal Latihan Konfigurasi Elektron
Berikut adalah 10 soal latihan konfigurasi elektron yang mencakup berbagai topik, seperti aturan Aufbau, prinsip Hund, dan golongan serta periode dalam tabel periodik.
- Tentukan konfigurasi elektron atom nitrogen (N) dengan nomor atom 7.
- Tentukan konfigurasi elektron atom kalsium (Ca) dengan nomor atom 20.
- Tentukan konfigurasi elektron atom klorin (Cl) dengan nomor atom 17.
- Tentukan konfigurasi elektron atom besi (Fe) dengan nomor atom 26.
- Tentukan konfigurasi elektron atom sulfur (S) dengan nomor atom 16.
- Tentukan konfigurasi elektron atom tembaga (Cu) dengan nomor atom 29.
- Tentukan konfigurasi elektron atom kromium (Cr) dengan nomor atom 24.
- Tentukan konfigurasi elektron atom oksigen (O) dengan nomor atom 8.
- Tentukan konfigurasi elektron atom karbon (C) dengan nomor atom 6.
- Tentukan konfigurasi elektron atom natrium (Na) dengan nomor atom 11.
Kunci Jawaban Soal Latihan Konfigurasi Elektron, Contoh soal konfigurasi elektron golongan dan periode
- N: 1s2 2s2 2p3
- Ca: 1s2 2s2 2p6 3s2 3p6 4s2
- Cl: 1s2 2s2 2p6 3s2 3p5
- Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
- S: 1s2 2s2 2p6 3s2 3p4
- Cu: 1s2 2s2 2p6 3s2 3p6 4s1 3d10
- Cr: 1s2 2s2 2p6 3s2 3p6 4s1 3d5
- O: 1s2 2s2 2p4
- C: 1s2 2s2 2p2
- Na: 1s2 2s2 2p6 3s1
Petunjuk untuk Menyelesaikan Soal Latihan Konfigurasi Elektron
Untuk menyelesaikan soal-soal latihan di atas, kamu perlu memahami beberapa konsep penting dalam kimia, yaitu:
- Aturan Aufbau: Aturan ini menyatakan bahwa elektron-elektron dalam suatu atom akan mengisi orbital-orbital dengan tingkat energi terendah terlebih dahulu. Orbital-orbital dengan tingkat energi yang sama akan diisi satu per satu sebelum diisi ganda.
- Prinsip Hund: Prinsip ini menyatakan bahwa elektron-elektron akan mengisi orbital-orbital dalam suatu subkulit secara terpisah, dengan spin paralel, sebelum mengisi orbital yang sama dengan spin berlawanan.
- Golongan dan Periode dalam Tabel Periodik: Golongan dalam tabel periodik menunjukkan jumlah elektron valensi suatu atom, yaitu elektron yang terlibat dalam ikatan kimia. Periode menunjukkan tingkat energi tertinggi yang ditempati oleh elektron dalam atom tersebut.
Dengan memahami konsep-konsep di atas, kamu dapat dengan mudah menentukan konfigurasi elektron atom yang diminta. Sebagai contoh, untuk menentukan konfigurasi elektron atom nitrogen (N), kamu dapat mengikuti langkah-langkah berikut:
- Tentukan nomor atom nitrogen (N), yaitu 7.
- Gunakan aturan Aufbau untuk mengisi orbital-orbital dengan elektron, dimulai dari tingkat energi terendah.
- Isi orbital 1s dengan 2 elektron (1s2).
- Isi orbital 2s dengan 2 elektron (2s2).
- Isi orbital 2p dengan 3 elektron (2p3).
Maka, konfigurasi elektron atom nitrogen (N) adalah 1s2 2s2 2p3.
Akhir Kata
Dengan memahami konfigurasi elektron, kita dapat memprediksi sifat kimia suatu unsur, seperti keelektronegatifan, energi ionisasi, dan afinitas elektron. Pengetahuan ini membuka pintu bagi kita untuk memahami bagaimana unsur-unsur berinteraksi dan membentuk ikatan kimia, membuka jalan menuju pemahaman yang lebih mendalam tentang reaksi kimia dan sifat fisik materi.





