Contoh soal elektrolisis – Elektrolisis, proses penguraian senyawa menggunakan arus listrik, merupakan konsep menarik dalam kimia. Bayangkan, dengan aliran listrik, kita bisa memisahkan air menjadi hidrogen dan oksigen, atau bahkan menghasilkan logam murni dari bijihnya! Elektrolisis punya peran penting dalam berbagai industri, dari produksi aluminium hingga pemurnian logam.
Dalam artikel ini, kita akan menjelajahi dunia elektrolisis dengan contoh soal yang menantang. Siap-siap untuk menguji pemahamanmu tentang reaksi redoks, menghitung massa zat yang dihasilkan, dan menganalisis hasil elektrolisis. Mari kita mulai!
Pengertian Elektrolisis
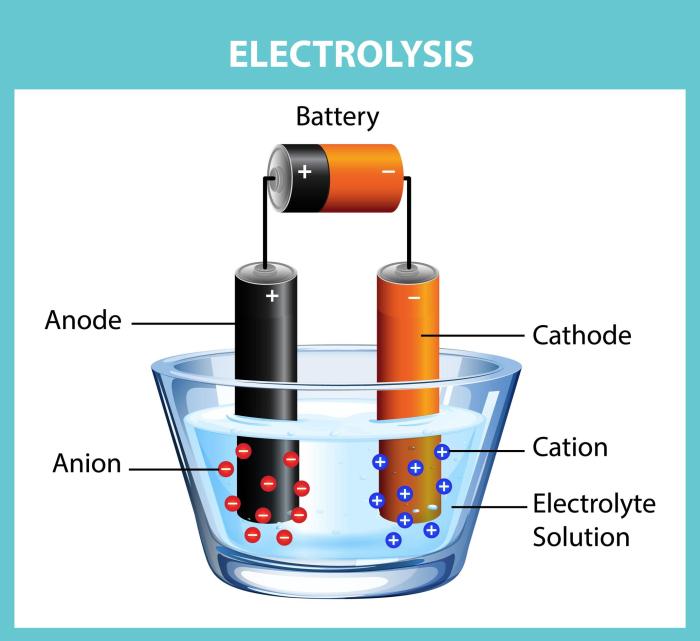
Elektrolisis merupakan proses kimia yang melibatkan penggunaan arus listrik untuk menguraikan senyawa ionik (elektrolit) menjadi unsur-unsur penyusunnya. Proses ini terjadi dalam suatu sel elektrolisis, yang terdiri dari dua elektroda (anoda dan katoda) yang dicelupkan ke dalam larutan elektrolit dan dihubungkan ke sumber arus searah (DC).
Proses Elektrolisis
Proses elektrolisis melibatkan beberapa tahapan penting:
- Arus listrik dialirkan melalui elektroda ke dalam larutan elektrolit.
- Ion-ion dalam larutan elektrolit bergerak menuju elektroda yang bermuatan berlawanan.
- Ion positif (kation) bergerak menuju katoda (elektroda negatif), sedangkan ion negatif (anion) bergerak menuju anoda (elektroda positif).
- Pada permukaan elektroda, ion-ion mengalami reaksi redoks (reduksi dan oksidasi).
- Reaksi reduksi terjadi pada katoda, di mana ion-ion positif menerima elektron dan berubah menjadi atom netral atau ion bermuatan lebih rendah.
- Reaksi oksidasi terjadi pada anoda, di mana ion-ion negatif melepaskan elektron dan berubah menjadi atom netral atau ion bermuatan lebih tinggi.
- Hasil akhir dari proses elektrolisis adalah pembentukan unsur-unsur baru pada permukaan elektroda atau pelepasan gas.
Komponen Sel Elektrolisis
Sel elektrolisis terdiri dari beberapa komponen utama:
- Elektroda: Anoda dan katoda yang terbuat dari bahan konduktif seperti logam atau karbon. Anoda merupakan elektroda tempat oksidasi terjadi, sedangkan katoda merupakan elektroda tempat reduksi terjadi.
- Elektrolit: Senyawa ionik yang terlarut dalam air atau pelarut lain. Elektrolit menyediakan ion-ion yang akan bereaksi pada elektroda.
- Sumber Arus Searah (DC): Menyediakan arus listrik yang diperlukan untuk mendorong reaksi redoks pada elektroda.
Contoh Reaksi Elektrolisis
Berikut adalah beberapa contoh reaksi elektrolisis yang umum terjadi:
- Elektrolisis air (H2O): Air dapat diuraikan menjadi hidrogen (H2) dan oksigen (O2) dengan elektrolisis. Reaksi yang terjadi pada elektroda adalah:
- Katoda: 2H+ + 2e– → H2 (gas hidrogen dilepaskan)
- Anoda: 4OH– → 2H2O + O2 + 4e– (gas oksigen dilepaskan)
- Elektrolisis larutan NaCl: Larutan garam dapur (NaCl) dapat diuraikan menjadi natrium (Na) dan klorin (Cl2) dengan elektrolisis. Reaksi yang terjadi pada elektroda adalah:
- Katoda: 2Na+ + 2e– → 2Na (natrium logam diendapkan)
- Anoda: 2Cl– → Cl2 + 2e– (gas klorin dilepaskan)
Elektrolisis Larutan NaCl
| Jenis Elektroda | Reaksi Elektroda | Produk yang Dihasilkan |
|---|---|---|
| Katoda (Negatif) | 2H+ + 2e– → H2 | Gas hidrogen (H2) |
| Anoda (Positif) | 2Cl– → Cl2 + 2e– | Gas klorin (Cl2) |
Faktor-Faktor yang Mempengaruhi Elektrolisis
Elektrolisis merupakan proses kimia yang melibatkan penggunaan arus listrik untuk menguraikan senyawa ionik menjadi unsur-unsur penyusunnya. Proses ini terjadi pada larutan elektrolit atau lelehan garam. Beberapa faktor dapat memengaruhi kecepatan dan hasil elektrolisis, seperti jenis elektroda, konsentrasi larutan elektrolit, dan arus listrik yang dialirkan.
Jenis Elektroda
Jenis elektroda yang digunakan dalam elektrolisis memiliki pengaruh signifikan terhadap hasil reaksi. Elektroda merupakan konduktor listrik yang berperan sebagai tempat terjadinya reaksi redoks. Elektroda yang umum digunakan dalam elektrolisis adalah elektroda inert dan elektroda aktif.
- Elektroda inert adalah elektroda yang tidak bereaksi dengan larutan elektrolit. Contohnya adalah platina (Pt), emas (Au), karbon (C), dan grafit. Elektroda inert hanya berfungsi sebagai tempat terjadinya reaksi redoks tanpa ikut bereaksi.
- Elektroda aktif adalah elektroda yang ikut bereaksi dengan larutan elektrolit. Contohnya adalah tembaga (Cu), seng (Zn), dan perak (Ag). Elektroda aktif berperan sebagai tempat terjadinya reaksi redoks dan juga ikut bereaksi membentuk senyawa baru.
Sebagai contoh, dalam elektrolisis larutan tembaga(II) sulfat (CuSO4) dengan elektroda inert, tembaga akan terendapkan pada katoda dan gas oksigen akan dilepaskan pada anoda. Namun, jika elektroda aktif yang digunakan, seperti tembaga, maka tembaga akan terendapkan pada katoda, sementara anoda akan larut membentuk ion tembaga(II) yang kemudian bereaksi dengan ion sulfat membentuk tembaga(II) sulfat.
Konsentrasi Larutan Elektrolit, Contoh soal elektrolisis
Konsentrasi larutan elektrolit memengaruhi kecepatan elektrolisis. Semakin tinggi konsentrasi larutan elektrolit, semakin banyak ion yang tersedia untuk bereaksi. Hal ini mengakibatkan peningkatan kecepatan elektrolisis.
Contohnya, dalam elektrolisis larutan tembaga(II) sulfat, semakin tinggi konsentrasi ion tembaga(II), semakin cepat tembaga akan terendapkan pada katoda. Ini karena semakin banyak ion tembaga(II) yang tersedia untuk direduksi menjadi atom tembaga.
Arus Listrik
Arus listrik yang dialirkan juga memengaruhi hasil elektrolisis. Semakin besar arus listrik yang dialirkan, semakin cepat reaksi elektrolisis berlangsung. Arus listrik yang besar akan menghasilkan lebih banyak elektron yang mengalir melalui larutan elektrolit, sehingga lebih banyak ion yang dapat bereaksi.
Sebagai contoh, dalam elektrolisis air, semakin besar arus listrik yang dialirkan, semakin cepat air akan terurai menjadi gas hidrogen dan gas oksigen. Hal ini karena semakin banyak elektron yang mengalir melalui larutan air, sehingga lebih banyak molekul air yang dapat terurai menjadi ion hidrogen dan ion hidroksida.
Aplikasi Elektrolisis dalam Kehidupan Sehari-hari
Elektrolisis merupakan proses kimia yang melibatkan penggunaan arus listrik untuk menguraikan senyawa kimia menjadi komponen-komponennya. Proses ini memiliki aplikasi yang luas dan penting dalam berbagai bidang kehidupan, mulai dari industri hingga rumah tangga.
Contoh soal elektrolisis bisa jadi rumit, tapi jangan khawatir! Ada banyak sumber belajar yang bisa membantu, termasuk website seperti contoh soal wacc yang bisa membantu memahami konsep dasar. Sama seperti contoh soal WACC, soal elektrolisis pun membutuhkan pemahaman yang kuat tentang rumus dan konsep.
Dengan latihan yang cukup, kamu bisa menguasai topik ini dengan mudah!
Produksi dan Pemurnian Logam
Elektrolisis memainkan peran penting dalam produksi dan pemurnian logam. Proses ini digunakan untuk mengekstraksi logam dari bijihnya, seperti dalam produksi aluminium, tembaga, dan sodium. Contohnya, dalam produksi aluminium, bijih bauksit dilebur dan kemudian dialiri arus listrik. Arus listrik ini menyebabkan ion aluminium dalam lelehan bauksit bereaksi dan membentuk logam aluminium murni. Pemurnian logam, seperti tembaga, juga dilakukan dengan elektrolisis. Tembaga yang tidak murni diletakkan sebagai anoda dalam larutan tembaga sulfat, dan tembaga murni diendapkan di katoda. Proses ini menghasilkan tembaga dengan tingkat kemurnian yang tinggi.
Pelapisan Logam
Elektrolisis juga digunakan untuk melapisi logam dengan logam lain, yang dikenal sebagai elektroplating. Proses ini melibatkan pencelupan objek logam yang akan dilapisi ke dalam larutan garam logam yang akan digunakan sebagai pelapis. Arus listrik kemudian dialirkan melalui larutan, menyebabkan ion logam dalam larutan diendapkan pada objek logam yang dilapisi. Elektroplating memiliki berbagai aplikasi, seperti dalam melapisi perhiasan dengan emas atau perak, melapisi perkakas dengan krom untuk meningkatkan ketahanan terhadap korosi, dan melapisi komponen elektronik dengan nikel untuk meningkatkan daya tahannya.
Industri Elektrokimia: Produksi Aluminium
Industri elektrokimia mengandalkan proses elektrolisis untuk menghasilkan berbagai produk kimia, salah satunya adalah aluminium. Aluminium merupakan logam ringan dan kuat yang banyak digunakan dalam berbagai aplikasi, seperti dalam pembuatan pesawat terbang, mobil, dan kaleng minuman. Produksi aluminium melalui elektrolisis melibatkan pencairan bijih bauksit dan kemudian dialiri arus listrik. Arus listrik ini menyebabkan ion aluminium dalam lelehan bauksit bereaksi dan membentuk logam aluminium murni. Proses ini memerlukan energi listrik yang besar, sehingga biaya produksi aluminium cukup tinggi.
Aplikasi Lain Elektrolisis
- Pengolahan Air Minum: Elektrolisis digunakan dalam proses pengolahan air minum untuk menghilangkan kontaminan seperti logam berat, klorin, dan bakteri. Proses ini melibatkan penggunaan elektroda untuk menghasilkan klorin dan hidrogen peroksida, yang kemudian digunakan untuk membunuh bakteri dan mengoksidasi kontaminan.
- Produksi Baterai: Elektrolisis digunakan dalam proses produksi baterai, seperti baterai lithium-ion. Proses ini melibatkan pelapisan elektroda baterai dengan bahan aktif, seperti lithium kobalt oksida, menggunakan arus listrik. Baterai lithium-ion banyak digunakan dalam perangkat elektronik, seperti ponsel pintar, laptop, dan mobil listrik.
Soal Latihan Elektrolisis
Elektrolisis merupakan proses kimia yang melibatkan penggunaan arus listrik untuk menghasilkan perubahan kimia pada suatu larutan atau lelehan elektrolit. Proses ini melibatkan transfer elektron pada elektroda, sehingga terjadi reaksi redoks pada elektroda. Untuk memahami konsep elektrolisis dengan lebih baik, mari kita bahas beberapa soal latihan yang mencakup berbagai aspek penting.
Soal Latihan Elektrolisis
Berikut adalah beberapa soal latihan elektrolisis yang dapat membantu kamu dalam memahami konsep dan aplikasi elektrolisis:
| Soal | Jawaban | Pembahasan |
|---|---|---|
| 1. Hitunglah massa tembaga yang dihasilkan dari elektrolisis larutan CuSO4 dengan arus 2 A selama 30 menit. Diketahui Ar Cu = 63,5 g/mol dan 1 F = 96.500 C/mol. | Massa tembaga yang dihasilkan adalah 0,394 g. |
Elektrolisis larutan CuSO4 menghasilkan reaksi redoks pada elektroda. Pada katoda terjadi reduksi ion Cu2+ menjadi Cu, sedangkan pada anoda terjadi oksidasi ion SO42- menjadi gas O2. Massa tembaga yang dihasilkan dapat dihitung dengan menggunakan hukum Faraday:
dengan:
Sehingga, massa tembaga yang dihasilkan adalah:
|
| 2. Tentukan jenis elektroda yang digunakan dalam elektrolisis larutan NaCl dengan menggunakan elektroda karbon. | Elektroda karbon yang digunakan sebagai anoda akan mengalami oksidasi dan menghasilkan gas Cl2, sedangkan elektroda karbon yang digunakan sebagai katoda akan mengalami reduksi dan menghasilkan gas H2. |
Elektrolisis larutan NaCl dengan menggunakan elektroda karbon menghasilkan reaksi redoks pada elektroda. Pada anoda terjadi oksidasi ion Cl– menjadi gas Cl2, sedangkan pada katoda terjadi reduksi ion H+ dari air menjadi gas H2. Karena elektroda karbon tidak bereaksi dengan larutan NaCl, maka elektroda karbon hanya berfungsi sebagai tempat terjadinya reaksi redoks. Elektroda karbon yang digunakan sebagai anoda akan mengalami oksidasi dan menghasilkan gas Cl2, sedangkan elektroda karbon yang digunakan sebagai katoda akan mengalami reduksi dan menghasilkan gas H2. |
| 3. Jelaskan hasil elektrolisis larutan CuSO4 dengan menggunakan elektroda tembaga. | Elektrolisis larutan CuSO4 dengan menggunakan elektroda tembaga akan menghasilkan endapan tembaga pada katoda dan pelarutan tembaga pada anoda. |
Elektrolisis larutan CuSO4 dengan menggunakan elektroda tembaga menghasilkan reaksi redoks pada elektroda. Pada katoda terjadi reduksi ion Cu2+ menjadi Cu, sehingga terjadi endapan tembaga pada katoda. Pada anoda terjadi oksidasi atom tembaga menjadi ion Cu2+, sehingga terjadi pelarutan tembaga pada anoda. Proses ini menyebabkan perpindahan ion Cu2+ dari anoda ke katoda, sehingga terjadi perpindahan massa tembaga dari anoda ke katoda. |
| 4. Apa yang terjadi jika elektrolisis larutan NaCl dengan menggunakan elektroda inert dilakukan pada suhu tinggi? | Pada suhu tinggi, ion Na+ akan tereduksi pada katoda dan menghasilkan logam natrium. |
Pada suhu tinggi, energi aktivasi untuk reaksi reduksi ion Na+ menjadi logam natrium lebih rendah dibandingkan dengan energi aktivasi untuk reaksi reduksi ion H+ menjadi gas H2. Sehingga, pada suhu tinggi, ion Na+ akan tereduksi pada katoda dan menghasilkan logam natrium. Reaksi yang terjadi pada katoda adalah:
|
| 5. Hitunglah volume gas hidrogen yang dihasilkan dari elektrolisis larutan H2SO4 dengan arus 1 A selama 1 jam. Diketahui 1 mol gas ideal pada STP bervolume 22,4 L. | Volume gas hidrogen yang dihasilkan adalah 1,232 L. |
Elektrolisis larutan H2SO4 menghasilkan reaksi redoks pada elektroda. Pada katoda terjadi reduksi ion H+ menjadi gas H2, sedangkan pada anoda terjadi oksidasi molekul air menjadi gas O2. Volume gas hidrogen yang dihasilkan dapat dihitung dengan menggunakan hukum Faraday dan persamaan gas ideal:
dengan:
Sehingga, jumlah mol gas hidrogen yang dihasilkan adalah:
Volume gas hidrogen yang dihasilkan adalah:
|
Contoh Soal Menantang
Berikut adalah contoh soal elektrolisis yang menantang dan memerlukan pemahaman mendalam tentang konsep elektrolisis:
Sebuah sel elektrolisis berisi larutan CuSO4 dengan elektroda tembaga. Arus yang dialirkan pada sel adalah 2 A selama 30 menit. Jika diketahui massa atom relatif Cu = 63,5 g/mol dan 1 F = 96.500 C/mol, tentukan:
- Massa tembaga yang dihasilkan pada katoda.
- Massa tembaga yang larut pada anoda.
- Perubahan massa total tembaga dalam sel elektrolisis.
Soal ini menantang karena melibatkan beberapa konsep, yaitu:
- Hukum Faraday untuk menghitung massa zat yang dihasilkan.
- Stoikiometri reaksi redoks pada elektroda.
- Konsep perpindahan massa tembaga dalam sel elektrolisis.
Untuk menyelesaikan soal ini, kamu perlu memahami konsep elektrolisis secara menyeluruh dan mampu menerapkannya dalam berbagai situasi.
Ilustrasi Proses Elektrolisis
Elektrolisis adalah proses penguraian senyawa ionik menjadi unsur-unsur penyusunnya dengan menggunakan arus listrik. Proses ini terjadi karena adanya perpindahan ion-ion dalam larutan atau lelehan senyawa ionik menuju elektroda yang bermuatan berlawanan. Pada elektroda, ion-ion akan mengalami reaksi redoks, yaitu reaksi pelepasan atau penangkapan elektron.
Elektrolisis Larutan CuSO4
Proses elektrolisis larutan CuSO4 dengan menggunakan elektroda karbon dan tembaga dapat diilustrasikan sebagai berikut:
- Larutan CuSO4 mengandung ion Cu2+ dan SO42-.
- Ketika arus listrik dialirkan, ion Cu2+ akan tertarik ke katoda (elektroda negatif) dan mengalami reduksi, membentuk logam tembaga (Cu).
- Pada anoda (elektroda positif), ion SO42- akan tertarik dan mengalami oksidasi. Namun, ion SO42- tidak mudah teroksidasi. Sebagai gantinya, molekul air (H2O) akan teroksidasi menjadi ion hidrogen (H+) dan gas oksigen (O2).
Berikut adalah diagram sederhana yang menunjukkan alur arus listrik, reaksi elektroda, dan produk yang dihasilkan pada proses elektrolisis larutan CuSO4:
[Gambar ilustrasi proses elektrolisis larutan CuSO4 dengan elektroda karbon dan tembaga, dengan penanda arah arus listrik, reaksi elektroda, dan produk yang dihasilkan.]
Perubahan yang Terjadi pada Elektroda dan Larutan
Selama proses elektrolisis berlangsung, beberapa perubahan terjadi pada elektroda dan larutan, yaitu:
- Katoda: Terjadi pelapisan logam tembaga pada permukaan katoda. Hal ini karena ion Cu2+ direduksi menjadi logam tembaga (Cu) dan menempel pada permukaan katoda.
- Anoda: Terjadi pelepasan gas oksigen (O2) di sekitar anoda. Hal ini karena molekul air (H2O) teroksidasi menjadi ion hidrogen (H+) dan gas oksigen (O2) yang dilepaskan ke udara.
- Larutan: Konsentrasi ion Cu2+ dalam larutan akan berkurang karena ion Cu2+ direduksi menjadi logam tembaga (Cu) di katoda. Konsentrasi ion H+ dalam larutan akan meningkat karena molekul air (H2O) teroksidasi menjadi ion hidrogen (H+) di anoda.
Perbedaan Elektrolisis dan Sel Volta
Elektrolisis dan sel volta merupakan dua proses elektrokimia yang melibatkan perpindahan elektron dan ion. Kedua proses ini memiliki peran penting dalam berbagai bidang, seperti produksi logam, penyimpanan energi, dan pengembangan teknologi baru. Meskipun keduanya melibatkan reaksi redoks, terdapat perbedaan mendasar antara elektrolisis dan sel volta yang perlu dipahami.
Perbedaan Elektrolisis dan Sel Volta
Berikut tabel yang membandingkan dan membedakan proses elektrolisis dan sel volta:
| Karakteristik | Elektrolisis | Sel Volta |
|---|---|---|
| Sumber Energi | Energi listrik dari sumber eksternal | Reaksi kimia spontan |
| Arah Aliran Arus | Dari sumber eksternal ke sel elektrokimia | Dari sel elektrokimia ke sirkuit eksternal |
| Reaksi Redoks | Reaksi redoks non-spontan | Reaksi redoks spontan |
| Contoh Aplikasi | Produksi aluminium, elektroplating, produksi klorin | Baterai, aki mobil, sel bahan bakar |
Penjelasan Perbedaan Utama
Perbedaan utama antara elektrolisis dan sel volta terletak pada sumber energi, arah aliran arus, dan reaksi yang terjadi:
- Sumber Energi: Elektrolisis menggunakan energi listrik dari sumber eksternal untuk mendorong reaksi redoks non-spontan. Sel volta, di sisi lain, memanfaatkan energi kimia dari reaksi redoks spontan untuk menghasilkan energi listrik.
- Arah Aliran Arus: Pada elektrolisis, arus listrik mengalir dari sumber eksternal ke sel elektrokimia, menyebabkan reaksi redoks yang tidak spontan terjadi. Dalam sel volta, arus listrik mengalir dari sel elektrokimia ke sirkuit eksternal, memanfaatkan energi kimia dari reaksi spontan untuk menghasilkan arus listrik.
- Reaksi Redoks: Elektrolisis melibatkan reaksi redoks non-spontan yang memerlukan energi listrik eksternal untuk terjadi. Sel volta, sebaliknya, memanfaatkan reaksi redoks spontan yang melepaskan energi kimia untuk menghasilkan arus listrik.
Contoh Aplikasi Elektrolisis dan Sel Volta
Elektrolisis dan sel volta memiliki berbagai aplikasi penting dalam kehidupan sehari-hari:
- Elektrolisis:
- Produksi Aluminium: Aluminium dihasilkan melalui elektrolisis lelehan alumina (Al2O3) dengan menggunakan elektroda karbon.
- Elektroplating: Proses melapisi logam dengan lapisan tipis logam lain untuk meningkatkan ketahanan korosi atau penampilan estetika.
- Produksi Klorin: Klorin dihasilkan melalui elektrolisis larutan garam (NaCl) yang menghasilkan gas klorin (Cl2) dan natrium hidroksida (NaOH).
- Sel Volta:
- Baterai: Baterai, seperti baterai AA dan AAA, merupakan contoh sel volta yang menghasilkan energi listrik dari reaksi kimia.
- Aki Mobil: Aki mobil merupakan sel volta yang menghasilkan energi listrik dari reaksi kimia antara timbal (Pb) dan timbal oksida (PbO2).
- Sel Bahan Bakar: Sel bahan bakar merupakan sel volta yang menghasilkan energi listrik dari reaksi kimia antara bahan bakar, seperti hidrogen, dengan oksigen.
Penerapan Elektrolisis dalam Industri: Contoh Soal Elektrolisis
Elektrolisis merupakan proses kimia yang memanfaatkan arus listrik untuk memisahkan senyawa menjadi unsur-unsur penyusunnya. Proses ini memiliki peran penting dalam berbagai industri, khususnya dalam metalurgi, kimia, dan bahkan dalam produksi bahan bakar alternatif. Penerapan elektrolisis dalam industri memberikan banyak keuntungan, seperti efisiensi produksi, kualitas produk yang lebih baik, dan juga dapat mengurangi dampak negatif terhadap lingkungan.
Elektrolisis dalam Industri Metalurgi
Elektrolisis memegang peranan penting dalam industri metalurgi, khususnya dalam proses produksi dan pemurnian logam. Proses ini memungkinkan ekstraksi logam dari bijihnya, serta pemurnian logam yang sudah diekstraksi. Contohnya, dalam produksi aluminium, bijih bauksit yang mengandung aluminium oksida (Al2O3) dilebur dan kemudian dielektrolisis untuk memisahkan aluminium murni. Proses ini melibatkan penggunaan sel elektrolisis dengan elektroda karbon sebagai anoda dan katoda. Arus listrik yang dialirkan melalui sel elektrolisis menyebabkan ion aluminium (Al3+) dalam lelehan bauksit bergerak menuju katoda, di mana mereka direduksi menjadi aluminium logam. Proses ini menghasilkan aluminium murni dengan kualitas tinggi.
Selain produksi, elektrolisis juga digunakan untuk memurnikan logam. Misalnya, dalam proses pemurnian tembaga, tembaga kasar yang mengandung sejumlah kecil logam lain seperti perak, emas, dan nikel dilebur dan dielektrolisis. Tembaga murni kemudian diendapkan pada katoda, sementara logam lain tetap berada dalam larutan elektrolit. Proses ini menghasilkan tembaga dengan kemurnian tinggi yang dapat digunakan dalam berbagai aplikasi, seperti kabel listrik dan komponen elektronik.
Elektrolisis dalam Industri Kimia
Elektrolisis juga memiliki peran penting dalam industri kimia, digunakan dalam produksi berbagai senyawa kimia penting, seperti klorin (Cl2) dan natrium hidroksida (NaOH). Proses produksi klorin dan natrium hidroksida melalui elektrolisis disebut dengan proses klor-alkali. Proses ini melibatkan elektrolisis larutan garam (NaCl) dengan menggunakan sel elektrolisis khusus. Di dalam sel elektrolisis, ion natrium (Na+) bergerak menuju katoda, di mana mereka direduksi menjadi natrium logam. Sementara itu, ion klorida (Cl–) bergerak menuju anoda, di mana mereka dioksidasi menjadi klorin gas. Natrium logam kemudian bereaksi dengan air untuk membentuk natrium hidroksida dan hidrogen gas. Proses ini menghasilkan klorin gas dan natrium hidroksida yang keduanya merupakan bahan kimia penting dalam berbagai industri, seperti produksi plastik, kertas, dan sabun.
- Produksi Klorin: Klorin digunakan dalam berbagai aplikasi, seperti pemutih, disinfektan, dan produksi plastik PVC. Dalam proses elektrolisis, klorin dihasilkan melalui oksidasi ion klorida di anoda.
- Produksi Natrium Hidroksida: Natrium hidroksida merupakan bahan kimia penting dalam berbagai industri, seperti produksi sabun, kertas, dan rayon. Dalam proses elektrolisis, natrium hidroksida dihasilkan melalui reaksi natrium logam dengan air.
Dampak Positif dan Negatif Elektrolisis dalam Industri
Penggunaan elektrolisis dalam industri memiliki dampak positif dan negatif terhadap lingkungan. Berikut beberapa dampaknya:
- Dampak Positif:
- Meningkatkan efisiensi produksi dengan mengurangi limbah dan emisi.
- Memperoleh produk dengan kualitas tinggi.
- Meningkatkan daya saing industri melalui penggunaan teknologi yang lebih maju.
- Dampak Negatif:
- Meningkatkan konsumsi energi, terutama jika proses elektrolisis menggunakan sumber energi fosil.
- Membuang limbah elektrolit yang dapat mencemari lingkungan.
- Membutuhkan investasi modal yang besar untuk membangun infrastruktur dan peralatan elektrolisis.
Oleh karena itu, penting untuk menerapkan teknologi elektrolisis dengan bijak dan bertanggung jawab untuk meminimalkan dampak negatif terhadap lingkungan. Penggunaan sumber energi terbarukan, seperti energi surya dan angin, dapat membantu mengurangi konsumsi energi dan emisi gas rumah kaca. Selain itu, perlu dilakukan pengelolaan limbah elektrolit yang tepat untuk mencegah pencemaran lingkungan.
Peranan Elektrolisis dalam Teknologi Masa Depan
Elektrolisis, proses kimia yang memanfaatkan arus listrik untuk memisahkan senyawa menjadi komponen-komponennya, telah lama dikenal dan digunakan dalam berbagai bidang. Namun, di era teknologi yang terus berkembang, elektrolisis semakin memainkan peran penting dalam pengembangan teknologi masa depan yang berkelanjutan dan inovatif.
Pengembangan Teknologi Masa Depan
Elektrolisis memiliki potensi besar dalam pengembangan teknologi masa depan, terutama dalam bidang penyimpanan energi dan produksi bahan kimia. Berikut adalah beberapa contoh konkret:
- Baterai Lithium-ion: Elektrolisis digunakan dalam proses produksi baterai lithium-ion, salah satu teknologi penyimpanan energi yang paling umum saat ini. Elektrolisis digunakan untuk menghasilkan bahan-bahan penting seperti lithium cobalt oxide (LiCoO2) dan lithium iron phosphate (LiFePO4) yang digunakan sebagai katoda dalam baterai lithium-ion. Proses ini memungkinkan produksi baterai dengan kepadatan energi tinggi, masa pakai yang lama, dan efisiensi yang tinggi.
- Sel Bahan Bakar: Elektrolisis berperan penting dalam produksi hidrogen, bahan bakar bersih yang dapat digunakan dalam sel bahan bakar. Proses elektrolisis air menghasilkan hidrogen dan oksigen, yang kemudian dapat digunakan untuk menghasilkan energi listrik dalam sel bahan bakar. Sel bahan bakar merupakan teknologi yang menjanjikan untuk mengurangi emisi gas rumah kaca dan menghasilkan energi bersih dan efisien.
Energi Terbarukan dan Penyimpanan Energi
Elektrolisis dapat memainkan peran penting dalam mengatasi tantangan energi terbarukan dan penyimpanan energi. Salah satu cara elektrolisis berkontribusi adalah melalui produksi hidrogen dari sumber energi terbarukan seperti tenaga surya dan angin.
- Produksi Hidrogen: Hidrogen dapat diproduksi melalui elektrolisis air menggunakan energi terbarukan. Hidrogen yang dihasilkan dapat disimpan dan digunakan sebagai bahan bakar bersih untuk transportasi atau industri. Dengan demikian, elektrolisis memungkinkan penyimpanan energi terbarukan dalam bentuk hidrogen, mengatasi keterbatasan intermittensi energi terbarukan.
- Penyimpanan Energi: Elektrolisis juga dapat digunakan untuk menyimpan energi terbarukan dalam bentuk bahan kimia. Misalnya, elektrolisis dapat digunakan untuk menghasilkan hidrogen dari air, yang kemudian dapat disimpan dan digunakan untuk menghasilkan listrik melalui sel bahan bakar saat dibutuhkan. Ini memungkinkan penyimpanan energi terbarukan dalam bentuk hidrogen, yang dapat digunakan untuk menghasilkan listrik saat dibutuhkan.
Daur Ulang dan Pemulihan Logam Berharga
Elektrolisis juga memiliki peran penting dalam proses daur ulang dan pemulihan logam berharga. Elektrolisis dapat digunakan untuk memisahkan logam berharga dari limbah elektronik, baterai bekas, dan sumber lainnya.
- Pemulihan Logam Berharga: Elektrolisis dapat digunakan untuk memisahkan logam berharga seperti emas, perak, dan platinum dari limbah elektronik dan baterai bekas. Proses ini melibatkan elektrolisis larutan yang mengandung logam berharga, yang kemudian dapat dipisahkan dan dimurnikan. Elektrolisis memungkinkan pemulihan logam berharga dengan efisiensi tinggi dan ramah lingkungan.
- Daur Ulang Logam: Elektrolisis juga dapat digunakan untuk daur ulang logam seperti aluminium, tembaga, dan nikel. Proses ini melibatkan elektrolisis larutan yang mengandung logam yang ingin didaur ulang, yang kemudian dapat dipisahkan dan dimurnikan. Elektrolisis memungkinkan daur ulang logam dengan efisiensi tinggi dan mengurangi kebutuhan akan penambangan logam baru.
Ringkasan Penutup
Memahami elektrolisis membuka pintu untuk memahami banyak proses kimia yang terjadi di sekitar kita. Dari baterai yang kita gunakan sehari-hari hingga produksi logam yang menjadi bahan baku berbagai teknologi, elektrolisis memainkan peran penting. Dengan latihan dan pemahaman yang kuat, kita dapat menguasai konsep ini dan melangkah lebih jauh dalam mempelajari dunia kimia.




