Pernahkah kamu bertanya-tanya mengapa logam seperti besi dan tembaga begitu kuat dan mudah dibentuk? Rahasianya terletak pada ikatan logam, sebuah ikatan kimia yang unik yang menghubungkan atom-atom logam dalam struktur yang kuat dan fleksibel. Ikatan logam berperan penting dalam berbagai aspek kehidupan kita, mulai dari peralatan rumah tangga hingga infrastruktur yang kita gunakan setiap hari. Melalui contoh soal ikatan logam, kamu akan menjelajahi lebih dalam tentang bagaimana ikatan ini bekerja dan mengapa logam memiliki sifat-sifat yang khas.
Contoh soal ikatan logam akan membantumu memahami konsep dasar ikatan logam, seperti teori elektron bebas dan model elektron terdelokalisasi. Kamu akan diajak untuk menguji pemahamanmu tentang ciri-ciri ikatan logam, aplikasi dalam kehidupan sehari-hari, dan bagaimana ikatan ini mempengaruhi sifat fisik dan kimia logam. Siap untuk mengasah kemampuanmu dalam memahami ikatan logam?
Pengertian Ikatan Logam
Ikatan logam merupakan salah satu jenis ikatan kimia yang bertanggung jawab atas sifat unik logam seperti kekuatan, konduktivitas, dan kilau. Ikatan ini terjadi karena interaksi antara elektron valensi (elektron di kulit terluar) atom logam yang saling terikat dalam suatu “lautan elektron” yang bergerak bebas.
Contoh Ikatan Logam dalam Kehidupan Sehari-hari
Contoh konkret ikatan logam dapat kita temukan dalam kehidupan sehari-hari. Misalnya, kabel listrik terbuat dari tembaga yang merupakan logam. Kabel listrik mampu menghantarkan arus listrik karena adanya elektron bebas yang dapat bergerak bebas di dalam “lautan elektron” tembaga. Contoh lainnya adalah perhiasan emas. Emas merupakan logam yang tahan terhadap korosi dan memiliki kilau yang khas. Sifat ini dihasilkan dari ikatan logam yang kuat antara atom-atom emas.
Perbandingan Ikatan Logam dengan Ikatan Ion dan Kovalen
| Sifat | Ikatan Logam | Ikatan Ion | Ikatan Kovalen |
|---|---|---|---|
| Pembentukan | Elektron valensi dilepaskan dan membentuk “lautan elektron” | Transfer elektron dari atom logam ke atom non-logam | Pembagian elektron antara dua atom non-logam |
| Sifat Fisik | Padat, kuat, konduktor listrik dan panas yang baik, mudah ditempa dan dibentuk | Padat, rapuh, konduktor listrik dan panas yang buruk dalam keadaan padat, konduktor yang baik dalam keadaan cair | Padat, cair, atau gas, konduktor listrik dan panas yang buruk |
| Titik Leleh dan Didih | Tinggi | Tinggi | Rendah |
| Contoh | Besi, tembaga, emas, perak | NaCl, MgO, CaCl2 | H2O, CO2, CH4 |
Ciri-ciri Ikatan Logam
Ikatan logam merupakan ikatan kimia yang bertanggung jawab atas sifat khas logam seperti kekuatan, konduktivitas, dan kemampuan ditempa. Ikatan ini terbentuk akibat gaya tarik-menarik antara ion positif logam dengan elektron valensi yang bergerak bebas. Untuk memahami lebih dalam tentang ikatan logam, mari kita bahas ciri-ciri khasnya.
Titik Leleh dan Titik Didih Tinggi
Logam umumnya memiliki titik leleh dan titik didih yang tinggi. Hal ini dikarenakan ikatan logam yang kuat membutuhkan energi yang besar untuk memutus ikatan tersebut. Elektron valensi yang bergerak bebas dalam kisi logam membentuk “awan elektron” yang mengikat ion positif logam dengan kuat. Untuk melelehkan logam, dibutuhkan energi yang cukup untuk mengatasi gaya tarik-menarik yang kuat antara ion positif dan awan elektron ini.
Contoh soal ikatan logam biasanya melibatkan penggambaran struktur atom dan bagaimana mereka berikatan untuk membentuk logam. Misalnya, kita bisa diminta untuk menjelaskan mengapa logam bersifat konduktor listrik dan panas yang baik. Nah, berbicara soal “baik”, mungkin kamu juga tertarik dengan contoh soal laporan keuangan sederhana, seperti yang bisa kamu temukan di situs ini.
Soal-soal laporan keuangan sederhana dapat membantu kamu memahami dasar-dasar akuntansi dan bagaimana perusahaan mencatat transaksi keuangannya. Setelah kamu memahami contoh soal ikatan logam dan laporan keuangan sederhana, kamu akan lebih siap menghadapi berbagai soal kimia dan ekonomi yang lebih kompleks!
Konduktivitas Listrik dan Panas
Logam merupakan konduktor listrik dan panas yang baik. Sifat ini disebabkan oleh elektron valensi yang bergerak bebas dalam kisi logam. Elektron-elektron ini dapat dengan mudah bergerak dan membawa muatan listrik, sehingga memungkinkan logam untuk menghantarkan arus listrik. Selain itu, elektron-elektron ini juga dapat mentransfer energi panas dengan mudah, sehingga logam dapat menghantarkan panas dengan baik.
- Ketika logam dipanaskan, elektron-elektron valensi menyerap energi dan bergerak lebih cepat, sehingga panas dapat ditransfer dengan mudah melalui kisi logam.
- Elektron-elektron valensi yang bergerak bebas juga memungkinkan logam untuk menghantarkan arus listrik dengan baik. Ketika tegangan listrik diberikan, elektron-elektron ini bergerak menuju kutub positif, sehingga menghasilkan arus listrik.
Sifat Mekanis Logam
Logam umumnya memiliki sifat mekanis yang baik, seperti kekuatan, ketangguhan, dan kemampuan ditempa. Hal ini disebabkan oleh ikatan logam yang kuat dan sifat elektron valensi yang bergerak bebas.
- Kekuatan logam berasal dari gaya tarik-menarik yang kuat antara ion positif dan awan elektron.
- Ketangguhan logam berasal dari kemampuan elektron valensi untuk bergerak bebas, sehingga logam dapat menyerap energi tanpa patah.
- Kemampuan ditempa logam berasal dari kemampuan elektron valensi untuk bergerak bebas, sehingga logam dapat dibentuk tanpa putus.
Contoh Soal Ikatan Logam
Ikatan logam merupakan ikatan kimia yang terjadi antara atom-atom logam. Ikatan ini dibentuk oleh gaya tarik-menarik antara inti atom logam dengan elektron valensi yang terdelokalisasi. Untuk menguji pemahaman tentang ikatan logam, berikut beberapa contoh soal yang dapat kamu pelajari.
Soal Pilihan Ganda
Berikut adalah lima contoh soal pilihan ganda tentang ikatan logam, disertai kunci jawaban:
- Manakah dari pernyataan berikut yang benar tentang ikatan logam?
- Ikatan logam hanya terjadi antara atom-atom logam yang sama.
- Ikatan logam melibatkan pemakaian bersama elektron valensi.
- Ikatan logam menyebabkan logam bersifat lunak.
- Ikatan logam menyebabkan logam bersifat isolator.
Kunci Jawaban: b. Ikatan logam melibatkan pemakaian bersama elektron valensi.
- Manakah dari sifat berikut yang TIDAK dimiliki oleh logam?
- Konduktivitas listrik yang tinggi
- Konduktivitas panas yang tinggi
- Kekerasan yang tinggi
- Keuletan yang tinggi
Kunci Jawaban: c. Kekerasan yang tinggi.
- Manakah dari logam berikut yang memiliki titik leleh tertinggi?
- Sodium (Na)
- Magnesium (Mg)
- Aluminium (Al)
- Tungsten (W)
Kunci Jawaban: d. Tungsten (W).
- Manakah dari logam berikut yang paling mudah ditempa?
- Besi (Fe)
- Tembaga (Cu)
- Emas (Au)
- Platina (Pt)
Kunci Jawaban: c. Emas (Au).
- Manakah dari logam berikut yang paling banyak digunakan dalam pembuatan kabel listrik?
- Tembaga (Cu)
- Aluminium (Al)
- Emas (Au)
- Perak (Ag)
Kunci Jawaban: a. Tembaga (Cu).
Soal Uraian
Berikut adalah tiga contoh soal uraian tentang ikatan logam yang menguji pemahaman tentang teori dan contoh:
- Jelaskan bagaimana ikatan logam terbentuk dan bagaimana ikatan ini menyebabkan logam memiliki sifat-sifat khas seperti konduktivitas listrik dan panas yang tinggi, serta keuletan dan ketangguhan yang baik.
- Berikan contoh aplikasi ikatan logam dalam kehidupan sehari-hari, misalnya dalam pembuatan alat elektronik, perhiasan, dan bahan bangunan. Jelaskan bagaimana sifat-sifat logam yang terkait dengan ikatan logam berperan dalam aplikasi tersebut.
- Bandingkan dan kontraskan sifat-sifat logam dengan sifat-sifat senyawa ionik dan kovalen. Jelaskan bagaimana perbedaan dalam struktur dan ikatan menyebabkan perbedaan sifat tersebut.
Contoh Soal Aplikasi Ikatan Logam
Berikut adalah contoh soal tentang ikatan logam yang melibatkan aplikasi dalam kehidupan sehari-hari:
Alat elektronik seperti komputer, smartphone, dan televisi menggunakan logam sebagai komponen penting. Jelaskan bagaimana sifat-sifat logam yang terkait dengan ikatan logam berperan dalam pembuatan alat elektronik tersebut. Berikan contoh spesifik logam yang digunakan dalam alat elektronik dan jelaskan fungsinya.
Aplikasi Ikatan Logam
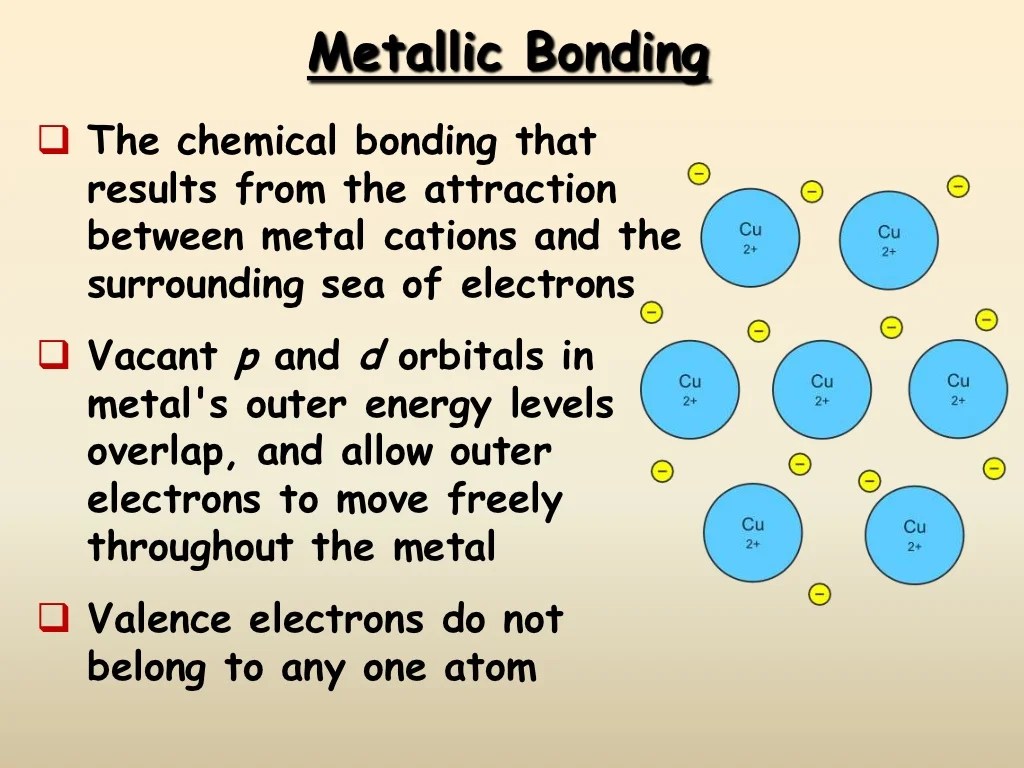
Ikatan logam adalah gaya tarik-menarik yang kuat antara atom-atom logam. Ikatan ini terbentuk karena elektron valensi dalam atom logam bergerak bebas di antara atom-atom lainnya, membentuk “lautan elektron”. Struktur unik ini memberikan logam sifat-sifat yang khas, seperti konduktivitas listrik dan panas yang tinggi, keuletan, dan kekerasan. Sifat-sifat ini membuat logam sangat berguna dalam berbagai aplikasi teknologi dan industri.
Aplikasi Ikatan Logam dalam Teknologi dan Industri
Ikatan logam berperan penting dalam berbagai teknologi dan industri. Sifat-sifat uniknya memungkinkan logam digunakan dalam berbagai aplikasi, mulai dari peralatan rumah tangga hingga infrastruktur yang rumit. Berikut beberapa contohnya:
- Konduktivitas Listrik dan Panas: Logam seperti tembaga, aluminium, dan emas digunakan dalam kabel listrik, komponen elektronik, dan peralatan pemanas karena kemampuannya menghantarkan listrik dan panas dengan baik.
- Keuletan dan Kekerasan: Logam seperti baja, besi, dan aluminium digunakan dalam konstruksi bangunan, jembatan, dan kendaraan karena kekuatan dan ketahanannya terhadap deformasi.
- Sifat Magnetik: Logam seperti besi dan nikel digunakan dalam pembuatan magnet permanen dan elektromagnet, yang digunakan dalam berbagai aplikasi, seperti motor listrik, generator, dan peralatan medis.
- Refleksi Cahaya: Logam seperti perak dan aluminium digunakan dalam pembuatan cermin, peralatan optik, dan panel surya karena kemampuannya memantulkan cahaya.
Contoh Penggunaan Logam dalam Kehidupan Sehari-hari
Logam hadir di sekitar kita dalam berbagai bentuk dan aplikasi. Berikut beberapa contoh penggunaan logam dalam kehidupan sehari-hari:
- Peralatan Rumah Tangga: Peralatan masak, perlengkapan makan, peralatan elektronik, dan perhiasan seringkali terbuat dari logam seperti baja, aluminium, perak, dan emas.
- Infrastruktur: Jembatan, gedung pencakar langit, dan kendaraan umumnya menggunakan logam seperti baja, besi, dan aluminium sebagai bahan konstruksi utama.
- Transportasi: Kendaraan bermotor, pesawat terbang, kereta api, dan kapal menggunakan logam sebagai bahan konstruksi utama karena kekuatan dan ketahanannya.
- Industri: Logam digunakan dalam berbagai industri, seperti otomotif, elektronik, konstruksi, dan manufaktur.
Jenis Logam dan Aplikasinya
| Jenis Logam | Aplikasi |
|---|---|
| Baja | Konstruksi bangunan, jembatan, kendaraan, peralatan industri |
| Aluminium | Konstruksi ringan, peralatan rumah tangga, kemasan, industri penerbangan |
| Tembaga | Kabel listrik, komponen elektronik, peralatan pemanas, pipa air |
| Emas | Perhiasan, elektronik, investasi, pelapisan |
| Perak | Perhiasan, peralatan optik, fotografi, pelapisan |
| Besi | Konstruksi, peralatan industri, magnet |
| Nikel | Magnet, baterai, baja tahan karat |
| Titanium | Implantasi medis, industri penerbangan, peralatan olahraga |
Ikatan Logam dan Sifat Fisik Logam
Ikatan logam merupakan gaya tarik-menarik yang kuat antara atom-atom logam. Ikatan ini unik karena melibatkan elektron valensi yang terdelokalisasi, yaitu elektron yang bebas bergerak di seluruh kisi kristal logam. Kebebasan elektron ini memungkinkan logam memiliki sifat fisik khas, seperti kekerasan, keuletan, dan titik leleh yang tinggi.
Hubungan Ikatan Logam dan Sifat Fisik Logam
Ikatan logam yang kuat memiliki pengaruh besar terhadap sifat fisik logam. Berikut penjelasan hubungannya:
- Kekerasan: Kekerasan logam ditentukan oleh kekuatan ikatan logamnya. Semakin kuat ikatan logam, semakin sulit untuk memisahkan atom-atom logam, sehingga logam tersebut akan lebih keras. Misalnya, besi memiliki ikatan logam yang kuat, sehingga dikenal sebagai logam yang keras.
- Keuletan: Keuletan adalah kemampuan logam untuk ditarik menjadi kawat tanpa putus. Keuletan logam juga dipengaruhi oleh kekuatan ikatan logam. Elektron yang terdelokalisasi memungkinkan atom-atom logam untuk bergerak relatif satu sama lain tanpa memutus ikatan logam. Misalnya, emas dan perak sangat ulet, sehingga mudah dibentuk menjadi berbagai macam bentuk, seperti perhiasan.
- Titik Leleh: Titik leleh adalah suhu di mana logam berubah dari padat menjadi cair. Ikatan logam yang kuat membutuhkan energi yang besar untuk memisahkan atom-atom logam, sehingga logam memiliki titik leleh yang tinggi. Misalnya, tungsten memiliki titik leleh tertinggi di antara semua logam, mencapai 3422 derajat Celcius, karena ikatan logamnya yang sangat kuat.
Faktor yang Mempengaruhi Sifat Fisik Logam
Beberapa faktor dapat mempengaruhi sifat fisik logam, di antaranya:
- Jenis Atom: Jenis atom logam menentukan kekuatan ikatan logam. Atom-atom dengan jari-jari atom yang kecil dan jumlah elektron valensi yang banyak cenderung membentuk ikatan logam yang lebih kuat. Misalnya, logam transisi seperti besi, nikel, dan kobalt memiliki ikatan logam yang kuat karena memiliki banyak elektron valensi.
- Jumlah Elektron Valensi: Semakin banyak elektron valensi yang dimiliki atom logam, semakin kuat ikatan logam yang terbentuk. Hal ini karena semakin banyak elektron yang terdelokalisasi, semakin kuat gaya tarik-menarik antara ion positif dan elektron bebas. Misalnya, logam alkali memiliki satu elektron valensi, sehingga ikatan logamnya lemah, sedangkan logam alkali tanah memiliki dua elektron valensi, sehingga ikatan logamnya lebih kuat.
- Temperatur: Temperatur juga mempengaruhi kekuatan ikatan logam. Pada suhu tinggi, atom-atom logam memiliki energi kinetik yang lebih tinggi, sehingga mudah untuk memisahkan atom-atom logam. Hal ini menyebabkan penurunan kekuatan ikatan logam dan penurunan titik leleh logam. Misalnya, baja pada suhu tinggi akan menjadi lebih lunak dan mudah dibentuk.
Ikatan Logam dan Sifat Kimia Logam
Ikatan logam merupakan salah satu jenis ikatan kimia yang bertanggung jawab atas sifat khas logam, seperti konduktivitas listrik dan panas yang tinggi, titik leleh dan didih yang tinggi, serta sifat mekanik yang kuat. Ikatan logam terbentuk karena adanya gaya tarik-menarik antara ion positif logam dengan elektron valensi yang terdelokalisasi.
Reaktivitas Logam
Reaktivitas logam ditentukan oleh seberapa mudah atom logam melepaskan elektron valensinya dan membentuk ion positif. Ikatan logam mempengaruhi reaktivitas logam karena elektron valensi yang terdelokalisasi dapat dengan mudah berpindah dari satu atom ke atom lainnya. Hal ini memungkinkan logam untuk membentuk ion positif dengan mudah, sehingga logam menjadi reaktif.
- Logam alkali dan alkali tanah, seperti natrium (Na) dan kalsium (Ca), sangat reaktif karena memiliki satu atau dua elektron valensi yang mudah dilepas. Contohnya, natrium bereaksi hebat dengan air menghasilkan hidrogen dan natrium hidroksida.
- Logam transisi, seperti besi (Fe) dan tembaga (Cu), umumnya kurang reaktif dibandingkan logam alkali dan alkali tanah karena elektron valensinya lebih terikat kuat pada inti atom.
Ketahanan terhadap Korosi
Korosi adalah proses degradasi material logam akibat reaksi kimia dengan lingkungan, seperti udara atau air. Ketahanan terhadap korosi ditentukan oleh seberapa mudah logam membentuk lapisan oksida pelindung pada permukaannya. Ikatan logam mempengaruhi ketahanan terhadap korosi karena elektron valensi yang terdelokalisasi dapat membentuk lapisan oksida yang kuat dan stabil.
- Logam yang tahan terhadap korosi, seperti emas (Au) dan platinum (Pt), memiliki elektron valensi yang terikat kuat pada inti atom, sehingga sulit untuk membentuk ion positif. Hal ini menyebabkan logam tersebut tidak mudah bereaksi dengan lingkungan dan membentuk lapisan oksida pelindung yang stabil.
- Logam yang mudah berkarat, seperti besi (Fe), memiliki elektron valensi yang mudah dilepas, sehingga mudah bereaksi dengan oksigen dan air membentuk karat (Fe2O3.xH2O). Karat merupakan lapisan oksida yang rapuh dan tidak melindungi logam dari korosi lebih lanjut.
Logam yang Mudah Bereaksi dengan Asam
Logam yang mudah bereaksi dengan asam, seperti logam alkali dan alkali tanah, memiliki elektron valensi yang mudah dilepas. Reaksi logam dengan asam menghasilkan hidrogen gas dan garam logam. Contohnya, natrium (Na) bereaksi dengan asam klorida (HCl) menghasilkan hidrogen gas (H2) dan natrium klorida (NaCl):
2Na(s) + 2HCl(aq) → 2NaCl(aq) + H2(g)
Reaksi ini terjadi karena logam alkali dan alkali tanah memiliki energi ionisasi yang rendah, sehingga mudah melepaskan elektron valensinya dan membentuk ion positif. Ion positif logam kemudian bereaksi dengan ion negatif asam, membentuk garam logam.
Ikatan Logam dan Logam Paduan
Ikatan logam merupakan gaya tarik-menarik yang kuat antara atom-atom logam. Ikatan ini terbentuk karena elektron valensi pada atom logam bergerak bebas di antara ion-ion logam positif yang tersusun dalam kisi kristal. Ikatan logam ini memiliki beberapa karakteristik penting, seperti titik leleh dan titik didih yang tinggi, konduktivitas listrik dan panas yang baik, serta sifat yang kuat dan mudah ditempa.
Peran Ikatan Logam dalam Pembentukan Logam Paduan
Logam paduan adalah campuran dari dua atau lebih logam, atau logam dengan non-logam. Pembentukan logam paduan memanfaatkan prinsip ikatan logam untuk menghasilkan material dengan sifat yang berbeda dari logam penyusunnya. Ketika dua logam dicampur, atom-atom logam akan saling berikatan membentuk kisi kristal baru. Ikatan logam yang terbentuk dalam logam paduan dapat bervariasi tergantung pada jenis logam penyusunnya dan proporsi masing-masing logam dalam campuran.
Contoh Logam Paduan
Beberapa contoh logam paduan yang umum digunakan dalam kehidupan sehari-hari adalah:
- Kuningan: Campuran tembaga (Cu) dan seng (Zn). Kuningan memiliki sifat yang kuat, tahan korosi, dan mudah dibentuk, sehingga sering digunakan untuk membuat perlengkapan rumah tangga, perhiasan, dan instrumen musik.
- Perunggu: Campuran tembaga (Cu) dan timah (Sn). Perunggu memiliki sifat yang keras, tahan korosi, dan tahan terhadap gesekan, sehingga sering digunakan untuk membuat patung, peralatan, dan komponen mesin.
- Baja: Campuran besi (Fe) dan karbon (C). Baja memiliki sifat yang kuat, tahan lama, dan fleksibel, sehingga sering digunakan untuk membangun jembatan, gedung, dan kendaraan.
Sifat Logam Paduan, Contoh soal ikatan logam
Sifat logam paduan dapat berbeda dengan sifat logam penyusunnya. Perbedaan ini dapat dijelaskan dengan memperhatikan bagaimana ikatan logam berperan dalam membentuk kisi kristal logam paduan.
- Kekerasan: Logam paduan umumnya lebih keras dibandingkan dengan logam penyusunnya. Hal ini karena adanya atom-atom dari logam lain yang mengganggu susunan teratur atom-atom dalam kisi kristal. Gangguan ini menyebabkan atom-atom logam lebih sulit untuk bergerak, sehingga logam paduan menjadi lebih keras.
- Titik Leleh: Titik leleh logam paduan dapat lebih tinggi atau lebih rendah dibandingkan dengan titik leleh logam penyusunnya. Hal ini tergantung pada jenis logam penyusunnya dan proporsi masing-masing logam dalam campuran. Jika atom-atom logam dalam paduan memiliki ukuran yang berbeda, ikatan logam akan menjadi lebih kuat, sehingga titik lelehnya menjadi lebih tinggi. Sebaliknya, jika atom-atom logam dalam paduan memiliki ukuran yang sama, ikatan logam akan menjadi lebih lemah, sehingga titik lelehnya menjadi lebih rendah.
- Tahan Korosi: Logam paduan dapat memiliki ketahanan korosi yang lebih baik dibandingkan dengan logam penyusunnya. Hal ini karena adanya atom-atom dari logam lain yang membentuk lapisan pelindung pada permukaan logam. Lapisan pelindung ini mencegah logam dari bereaksi dengan oksigen dan air, sehingga mencegah terjadinya korosi.
Ikatan Logam dan Sifat Elektrokimia Logam: Contoh Soal Ikatan Logam
Ikatan logam merupakan salah satu jenis ikatan kimia yang berperan penting dalam menentukan sifat elektrokimia logam. Ikatan ini bertanggung jawab atas sifat-sifat unik logam, seperti konduktivitas listrik dan panas yang tinggi, serta keuletan dan kekerasan. Dalam artikel ini, kita akan membahas bagaimana ikatan logam mempengaruhi sifat elektrokimia logam, seperti potensial reduksi dan sifat elektrolitik.
Potensial Reduksi dan Ikatan Logam
Potensial reduksi merupakan ukuran kecenderungan suatu atom untuk menerima elektron dan menjadi ion negatif. Ikatan logam memiliki pengaruh signifikan terhadap potensial reduksi logam. Dalam ikatan logam, elektron valensi dari atom logam terdelokalisasi dan membentuk “lautan elektron” yang mengelilingi ion logam positif. Kebebasan pergerakan elektron ini membuat logam mudah kehilangan elektron, sehingga potensial reduksi logam cenderung lebih negatif.
Contoh Logam yang Mudah Teroksidasi
Logam yang mudah teroksidasi memiliki potensial reduksi yang lebih negatif. Contoh logam yang mudah teroksidasi adalah natrium (Na). Natrium memiliki satu elektron valensi yang mudah dilepas untuk membentuk ion Na+. Ikatan logam dalam natrium lemah karena hanya satu elektron valensi yang terdelokalisasi. Hal ini menyebabkan natrium mudah kehilangan elektron dan teroksidasi menjadi ion Na+.
Sifat Elektrolitik dan Ikatan Logam
Sifat elektrolitik mengacu pada kemampuan suatu zat untuk menghantarkan arus listrik. Logam memiliki sifat elektrolitik yang tinggi karena adanya lautan elektron yang bebas bergerak. Elektron-elektron ini dapat membawa muatan listrik melalui logam. Semakin kuat ikatan logam, semakin banyak elektron yang terdelokalisasi, dan semakin tinggi sifat elektrolitik logam.
Contoh Logam dengan Sifat Elektrolitik Tinggi
Logam seperti tembaga (Cu) dan perak (Ag) memiliki sifat elektrolitik yang tinggi. Hal ini disebabkan oleh ikatan logam yang kuat dalam logam-logam ini. Ikatan logam yang kuat menyebabkan banyak elektron terdelokalisasi, sehingga memungkinkan arus listrik mengalir dengan mudah melalui logam.
Ikatan Logam dan Sifat Magnetik Logam
Ikatan logam adalah gaya tarik-menarik yang kuat antara atom-atom logam. Ikatan ini terbentuk karena elektron valensi logam yang terdelokalisasi, bergerak bebas di seluruh kisi logam. Gerakan elektron yang bebas ini memungkinkan logam memiliki sifat-sifat unik seperti konduktivitas listrik dan panas yang tinggi, serta sifat mekanik yang kuat.
Sifat magnetik logam juga dipengaruhi oleh ikatan logam. Berdasarkan bagaimana logam berinteraksi dengan medan magnet, logam dapat diklasifikasikan menjadi tiga jenis: feromagnetik, paramagnetik, dan diamagnetik.
Feromagnetisme
Logam feromagnetik memiliki sifat magnetik yang sangat kuat. Ketika berada dalam medan magnet, mereka dapat menjadi magnet permanen. Hal ini terjadi karena elektron dalam atom logam tersebut memiliki momen magnetik yang sejajar dan saling memperkuat, membentuk domain magnetik yang besar. Domain-domain ini kemudian akan sejajar dengan medan magnet luar, sehingga logam menjadi termagnetisasi.
- Contoh logam feromagnetik: besi (Fe), nikel (Ni), kobalt (Co), dan paduannya seperti baja.
Paramagnetisme
Logam paramagnetik memiliki sifat magnetik yang lemah. Mereka tertarik ke medan magnet, tetapi tidak menjadi magnet permanen. Hal ini karena elektron dalam atom logam tersebut memiliki momen magnetik yang tidak sejajar, sehingga tidak membentuk domain magnetik yang besar.
- Contoh logam paramagnetik: aluminium (Al), platina (Pt), dan magnesium (Mg).
Diamagnetisme
Logam diamagnetik memiliki sifat magnetik yang sangat lemah. Mereka ditolak oleh medan magnet. Hal ini karena elektron dalam atom logam tersebut memiliki momen magnetik yang berpasangan dan saling meniadakan, sehingga tidak ada momen magnetik total.
- Contoh logam diamagnetik: emas (Au), tembaga (Cu), dan perak (Ag).
Faktor yang Mempengaruhi Sifat Magnetik Logam
Beberapa faktor yang dapat mempengaruhi sifat magnetik logam, antara lain:
- Struktur kristal: Struktur kristal logam dapat memengaruhi bagaimana elektron-elektron dalam atom logam tersebut berinteraksi dan membentuk domain magnetik. Logam dengan struktur kristal yang sederhana, seperti besi, cenderung bersifat feromagnetik. Sementara logam dengan struktur kristal yang kompleks, seperti tembaga, cenderung bersifat diamagnetik.
- Jumlah elektron valensi: Jumlah elektron valensi dalam atom logam dapat memengaruhi kekuatan momen magnetiknya. Logam dengan jumlah elektron valensi yang tinggi, seperti besi, cenderung memiliki momen magnetik yang kuat dan bersifat feromagnetik.
Ringkasan Terakhir
Dengan mempelajari contoh soal ikatan logam, kamu akan mendapatkan pemahaman yang lebih mendalam tentang sifat-sifat logam dan bagaimana ikatan kimia berperan dalam membentuk dunia di sekitar kita. Mulai dari konstruksi bangunan hingga peralatan elektronik, ikatan logam memiliki peran yang vital dalam berbagai bidang kehidupan. Jadi, jangan ragu untuk terus menggali lebih dalam tentang ikatan logam dan bagaimana ia membentuk sifat-sifat materi yang kita gunakan setiap hari.





