Ikatan kimia, seperti lem yang tak terlihat, memegang erat atom-atom untuk membentuk molekul dan senyawa. Tanpa ikatan ini, dunia kita akan menjadi tempat yang sangat berbeda! Bayangkan, tidak ada air, udara, atau bahkan tubuh kita! Jadi, bagaimana ikatan kimia bekerja? Bagaimana kita bisa memprediksi jenis ikatan yang terbentuk? Melalui contoh soal ikatan kimia beserta jawabannya, kita akan menjelajahi dunia molekul dan menguji pemahaman kita tentang ikatan kimia.
Contoh soal ini akan mengantarkan kita pada berbagai jenis ikatan kimia, seperti ikatan ionik, kovalen, dan logam. Kita akan belajar bagaimana ikatan-ikatan ini terbentuk, sifat-sifatnya, dan bagaimana mereka berperan dalam membentuk dunia di sekitar kita. Siap untuk menjelajahi dunia mikroskopis yang menarik ini?
Pengertian Ikatan Kimia
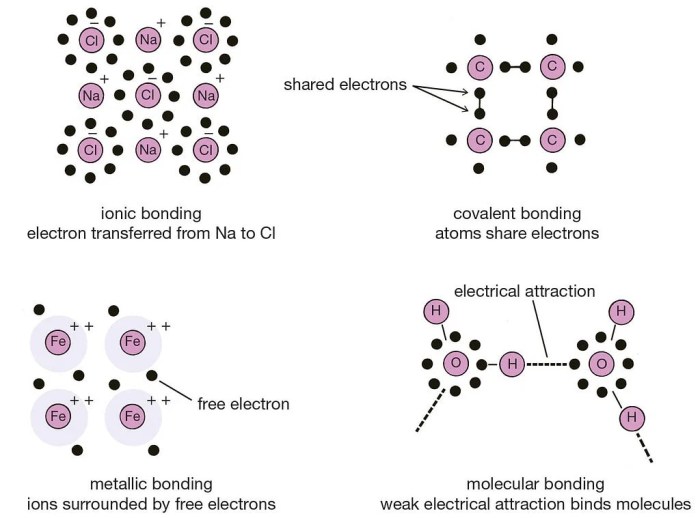
Ikatan kimia adalah gaya tarik-menarik yang terjadi antara atom-atom, baik atom yang sama maupun atom yang berbeda. Gaya tarik-menarik ini memungkinkan atom-atom untuk bergabung dan membentuk molekul atau senyawa. Ikatan kimia sangat penting dalam kehidupan sehari-hari karena berperan dalam pembentukan berbagai macam zat, mulai dari air yang kita minum hingga udara yang kita hirup.
Jenis-Jenis Ikatan Kimia
Terdapat tiga jenis utama ikatan kimia, yaitu ikatan ionik, ikatan kovalen, dan ikatan logam. Masing-masing jenis ikatan memiliki karakteristik yang berbeda, yang memengaruhi sifat-sifat senyawa yang dibentuknya.
| Jenis Ikatan | Jenis Atom yang Terlibat | Sifat Ikatan | Contoh Senyawa |
|---|---|---|---|
| Ikatan Ionik | Logam dan Non-logam | Terbentuk karena transfer elektron dari atom logam ke atom non-logam. Ikatan ini bersifat kuat dan menghasilkan senyawa dengan titik leleh dan titik didih yang tinggi. | NaCl (Garam dapur), MgO (Magnesium oksida) |
| Ikatan Kovalen | Non-logam dan Non-logam | Terbentuk karena pemakaian bersama pasangan elektron antara dua atom non-logam. Ikatan ini dapat bersifat polar atau nonpolar, dan menghasilkan senyawa dengan titik leleh dan titik didih yang bervariasi. | H2O (Air), CO2 (Karbon dioksida), CH4 (Metana) |
| Ikatan Logam | Logam dan Logam | Terbentuk karena pemakaian bersama elektron-elektron valensi antara atom-atom logam. Ikatan ini bersifat kuat dan menghasilkan senyawa dengan sifat-sifat seperti konduktivitas listrik dan panas yang baik. | Fe (Besi), Cu (Tembaga), Al (Aluminium) |
Peran Ikatan Kimia dalam Pembentukan Molekul dan Senyawa
Ikatan kimia berperan penting dalam pembentukan molekul dan senyawa. Molekul adalah gabungan dari dua atau lebih atom yang terikat secara kovalen. Senyawa adalah zat yang terbentuk dari dua atau lebih unsur yang terikat secara kimia. Ikatan kimia menentukan bentuk, sifat, dan reaktivitas molekul dan senyawa.
Sebagai contoh, air (H2O) adalah molekul yang terbentuk dari dua atom hidrogen dan satu atom oksigen yang terikat secara kovalen. Ikatan kovalen ini menentukan bentuk molekul air yang bengkok, yang memengaruhi sifat-sifatnya, seperti titik didih yang tinggi dan kemampuan untuk melarutkan banyak zat.
Ikatan Ionik
Ikatan ionik merupakan salah satu jenis ikatan kimia yang terbentuk akibat adanya gaya tarik-menarik elektrostatik antara ion bermuatan positif (kation) dan ion bermuatan negatif (anion).
Pembentukan Ikatan Ionik
Ikatan ionik terjadi ketika atom-atom yang memiliki perbedaan keelektronegatifan yang besar bereaksi. Atom dengan keelektronegatifan tinggi cenderung menarik elektron dari atom dengan keelektronegatifan rendah. Atom yang kehilangan elektron menjadi ion positif (kation), sedangkan atom yang menerima elektron menjadi ion negatif (anion). Gaya tarik-menarik elektrostatik antara kation dan anion inilah yang membentuk ikatan ionik.
Contohnya, natrium (Na) memiliki satu elektron valensi dan mudah melepaskan elektron tersebut untuk membentuk ion positif Na+. Klorin (Cl) memiliki tujuh elektron valensi dan cenderung menerima satu elektron untuk membentuk ion negatif Cl-. Ketika natrium dan klorin bereaksi, natrium melepaskan satu elektronnya ke klorin, membentuk ion Na+ dan Cl-. Kedua ion tersebut kemudian saling tarik-menarik dan membentuk senyawa ionik NaCl (garam dapur).
Ikatan Kovalen: Contoh Soal Ikatan Kimia Beserta Jawabannya
Ikatan kovalen merupakan jenis ikatan kimia yang terbentuk ketika dua atom berbagi pasangan elektron. Berbeda dengan ikatan ionik yang melibatkan transfer elektron, ikatan kovalen terjadi ketika dua atom memiliki daya tarik yang sama terhadap elektron.
Pembentukan Ikatan Kovalen
Ikatan kovalen terbentuk ketika dua atom saling mendekat dan orbital atomnya saling tumpang tindih. Tumpang tindih ini memungkinkan elektron dari kedua atom untuk menempati ruang yang sama, membentuk pasangan elektron yang terikat. Pembentukan ikatan kovalen dapat diilustrasikan dengan contoh sederhana, yaitu molekul hidrogen (H2). Dua atom hidrogen masing-masing memiliki satu elektron pada kulit terluarnya. Ketika dua atom hidrogen saling mendekat, orbital 1s dari masing-masing atom saling tumpang tindih, dan elektron-elektron mereka membentuk pasangan elektron yang terikat. Pasangan elektron ini kemudian tertarik ke kedua inti atom hidrogen, membentuk ikatan kovalen tunggal.
Perbedaan Ikatan Kovalen Tunggal, Rangkap, dan Rangkap Tiga
Ikatan kovalen dapat dibedakan berdasarkan jumlah pasangan elektron yang dibagikan antara dua atom.
- Ikatan Kovalen Tunggal: Terbentuk ketika dua atom berbagi satu pasangan elektron. Contoh: Molekul hidrogen (H2) dan molekul air (H2O).
- Ikatan Kovalen Rangkap: Terbentuk ketika dua atom berbagi dua pasangan elektron. Contoh: Molekul oksigen (O2) dan molekul karbon dioksida (CO2).
- Ikatan Kovalen Rangkap Tiga: Terbentuk ketika dua atom berbagi tiga pasangan elektron. Contoh: Molekul nitrogen (N2) dan molekul asetilena (C2H2).
Perbedaan Sifat Senyawa Ionik dan Kovalen
| Sifat | Senyawa Ionik | Senyawa Kovalen |
|---|---|---|
| Pembentukan Ikatan | Transfer elektron | Pembagian elektron |
| Titik Leleh dan Didih | Tinggi | Rendah |
| Keadaan Fisik pada Suhu Ruangan | Padatan | Gas, cair, atau padat |
| Kelarutan dalam Air | Larut | Tidak larut |
| Konduktivitas Listrik | Konduktif dalam keadaan cair atau larutan | Tidak konduktif |
Ikatan Logam
Ikatan logam merupakan jenis ikatan kimia yang terjadi antara atom-atom logam. Ikatan ini bertanggung jawab atas sifat-sifat unik logam, seperti konduktivitas listrik dan panas yang tinggi, serta sifat lentur dan mudah ditempa.
Pembentukan Ikatan Logam
Ikatan logam terbentuk karena adanya delokalisasi elektron valensi dari atom-atom logam. Dalam logam, elektron valensi tidak terikat pada atom tertentu, tetapi bebas bergerak di seluruh kisi logam. Elektron-elektron ini membentuk “awan elektron” yang menyelubungi ion-ion logam positif yang tersusun dalam kisi. Gaya tarik-menarik antara ion logam positif dan awan elektron inilah yang membentuk ikatan logam.
Contoh ikatan logam dapat ditemukan pada logam seperti emas (Au), perak (Ag), tembaga (Cu), aluminium (Al), dan besi (Fe).
Sifat-sifat Logam
Sifat-sifat khas logam yang dikaitkan dengan jenis ikatannya meliputi:
- Konduktivitas listrik dan panas yang tinggi: Elektron valensi yang terdelokalisasi dapat dengan mudah bergerak, sehingga memungkinkan logam untuk menghantarkan arus listrik dan panas dengan baik.
- Sifat lentur dan mudah ditempa: Awan elektron yang menyelubungi ion logam positif memungkinkan atom-atom logam untuk bergerak relatif satu sama lain tanpa memutus ikatan. Hal ini membuat logam dapat dibentuk dan dibentuk kembali tanpa mudah patah.
- Titik leleh dan titik didih yang tinggi: Ikatan logam yang kuat membutuhkan energi yang tinggi untuk memutusnya, sehingga logam memiliki titik leleh dan titik didih yang tinggi.
- Kilau logam: Elektron-elektron terdelokalisasi dapat menyerap dan memancarkan cahaya dengan mudah, memberikan logam kilau yang khas.
Contoh Soal Ikatan Logam
Soal: Jelaskan mengapa logam seperti tembaga (Cu) dapat menghantarkan listrik dengan baik.
Penyelesaian: Tembaga dapat menghantarkan listrik dengan baik karena memiliki elektron valensi yang terdelokalisasi. Elektron-elektron ini bebas bergerak di seluruh kisi logam, sehingga dapat dengan mudah membawa arus listrik.
Teori Ikatan Valensi
Teori ikatan valensi (TV) merupakan model kimia yang digunakan untuk menjelaskan ikatan kimia dan struktur molekul. TV berfokus pada penggunaan elektron valensi, yaitu elektron di kulit terluar atom, untuk membentuk ikatan. Teori ini membantu kita memahami bagaimana atom bergabung untuk membentuk molekul dan memprediksi sifat-sifat molekul tersebut.
Konsep Dasar Teori Ikatan Valensi
Konsep dasar TV didasarkan pada beberapa prinsip:
- Atom berusaha untuk mencapai konfigurasi elektron stabil seperti gas mulia, dengan delapan elektron di kulit terluarnya (aturan oktet).
- Atom dapat mencapai konfigurasi stabil dengan berbagi elektron dengan atom lain, membentuk ikatan kovalen.
- Jumlah ikatan yang dapat dibentuk oleh atom ditentukan oleh jumlah elektron valensinya.
- Bentuk molekul ditentukan oleh geometri ikatan yang dibentuk oleh atom-atom.
Penggunaan Teori Ikatan Valensi untuk Memprediksi Bentuk Molekul
TV dapat digunakan untuk memprediksi bentuk molekul dengan mempertimbangkan jumlah pasangan elektron ikatan dan pasangan elektron bebas di sekitar atom pusat. Pasangan elektron ikatan adalah elektron yang terlibat dalam pembentukan ikatan, sedangkan pasangan elektron bebas adalah elektron yang tidak terlibat dalam pembentukan ikatan. Bentuk molekul ditentukan oleh penolakan antar pasangan elektron, baik ikatan maupun bebas. Semakin besar penolakan antar pasangan elektron, semakin besar sudut ikatan.
Contoh Soal tentang Penggunaan Teori Ikatan Valensi untuk Menentukan Bentuk Molekul
Misalnya, kita ingin menentukan bentuk molekul air (H2O). Atom oksigen memiliki enam elektron valensi, dan dua atom hidrogen masing-masing memiliki satu elektron valensi. Oksigen akan berbagi dua elektronnya dengan dua atom hidrogen, membentuk dua ikatan kovalen. Selain itu, oksigen memiliki dua pasangan elektron bebas. Karena penolakan antar pasangan elektron, kedua pasangan elektron bebas akan menempati posisi yang berlawanan, sehingga bentuk molekul air menjadi bengkok atau V-shaped.
Bentuk molekul air adalah bengkok atau V-shaped.
Teori Hibridisasi Orbital
Teori hibridisasi orbital merupakan konsep penting dalam kimia yang menjelaskan bagaimana orbital atom bergabung untuk membentuk orbital hibrida yang baru, yang kemudian digunakan untuk membentuk ikatan kimia. Teori ini membantu kita memahami bentuk molekul dan sifat kimia suatu senyawa.
Konsep Dasar Teori Hibridisasi Orbital
Teori hibridisasi orbital menyatakan bahwa orbital atom dengan energi yang sedikit berbeda dapat bergabung untuk membentuk orbital hibrida yang baru, yang memiliki energi yang sama dan bentuk yang berbeda. Proses hibridisasi ini melibatkan pencampuran orbital atom s, p, dan d.
Orbital hibrida memiliki karakteristik yang berbeda dari orbital atom asalnya. Orbital hibrida memiliki energi yang lebih tinggi daripada orbital atom asalnya, tetapi mereka juga lebih stabil. Hal ini disebabkan karena elektron-elektron dalam orbital hibrida lebih terdelokalisasi dan memiliki kesempatan yang lebih besar untuk berinteraksi dengan inti atom.
Penggunaan Teori Hibridisasi Orbital untuk Menjelaskan Bentuk Molekul
Teori hibridisasi orbital dapat digunakan untuk menjelaskan bentuk molekul dengan melihat jumlah dan jenis orbital hibrida yang terbentuk. Bentuk molekul ditentukan oleh geometri dari orbital hibrida yang digunakan untuk membentuk ikatan.
Sebagai contoh, molekul metana (CH4) memiliki empat ikatan C-H yang identik. Berdasarkan teori hibridisasi orbital, atom karbon dalam metana memiliki empat orbital hibrida sp3 yang terbentuk dari pencampuran satu orbital s dan tiga orbital p. Keempat orbital hibrida sp3 ini memiliki bentuk tetrahedral dan berorientasi pada sudut 109,5o satu sama lain. Hal ini menyebabkan molekul metana memiliki bentuk tetrahedral.
Contoh Soal: Menentukan Bentuk Molekul Menggunakan Teori Hibridisasi Orbital
Soal: Tentukan bentuk molekul BeCl2 berdasarkan teori hibridisasi orbital.
Penyelesaian:
1. Tentukan konfigurasi elektron atom pusat (Be): Konfigurasi elektron Be adalah 1s2 2s2.
2. Tentukan jumlah ikatan yang terbentuk: Atom Be membentuk dua ikatan dengan atom Cl.
3. Tentukan jenis hibridisasi: Atom Be akan mengalami hibridisasi sp, yaitu pencampuran satu orbital s dan satu orbital p untuk membentuk dua orbital hibrida sp.
4. Tentukan bentuk molekul: Dua orbital hibrida sp ini akan berorientasi linear, sehingga molekul BeCl2 memiliki bentuk linear.
Kesimpulan: Molekul BeCl2 memiliki bentuk linear karena atom Be mengalami hibridisasi sp.
Teori Ikatan Molekul
Teori ikatan molekul merupakan model yang menjelaskan bagaimana atom-atom dalam sebuah molekul saling berikatan. Model ini berfokus pada pembentukan ikatan kovalen, yaitu ikatan yang terbentuk akibat pemakaian bersama pasangan elektron oleh dua atom. Teori ini membantu kita memahami bagaimana struktur molekul, sifat kimia, dan sifat fisik molekul saling berhubungan.
Konsep Dasar Teori Ikatan Molekul, Contoh soal ikatan kimia beserta jawabannya
Teori ikatan molekul didasarkan pada konsep orbital atom dan orbital molekul. Orbital atom adalah daerah ruang di sekitar inti atom tempat elektron berada. Ketika dua atom saling mendekat, orbital atom mereka dapat saling tumpang tindih dan membentuk orbital molekul. Orbital molekul ini merupakan daerah ruang di sekitar inti kedua atom yang dihuni oleh pasangan elektron yang dibagikan.
Penggunaan Teori Ikatan Molekul dalam Memprediksi Sifat Kimia Molekul
Teori ikatan molekul dapat digunakan untuk memprediksi sifat kimia molekul, seperti:
- Bentuk Molekul: Bentuk molekul ditentukan oleh bagaimana orbital atom tumpang tindih dan membentuk orbital molekul. Misalnya, molekul air (H2O) memiliki bentuk bengkok karena dua orbital atom hidrogen tumpang tindih dengan orbital atom oksigen, membentuk dua orbital molekul yang membentuk sudut 104.5 derajat.
- Kekuatan Ikatan: Kekuatan ikatan ditentukan oleh seberapa besar tumpang tindih antara orbital atom. Semakin besar tumpang tindih, semakin kuat ikatannya. Misalnya, ikatan rangkap dua lebih kuat daripada ikatan tunggal karena ada tumpang tindih yang lebih besar antara orbital atom.
- Polaritas Molekul: Polaritas molekul ditentukan oleh distribusi elektron dalam molekul. Jika elektron terdistribusi secara tidak merata, molekul akan bersifat polar. Misalnya, molekul air bersifat polar karena oksigen lebih elektronegatif daripada hidrogen, sehingga elektron lebih tertarik ke oksigen, menciptakan kutub negatif pada oksigen dan kutub positif pada hidrogen.
Contoh Soal
Berikut contoh soal tentang penggunaan teori ikatan molekul untuk memprediksi sifat kimia molekul:
Soal:
Jelaskan bentuk molekul metana (CH4) dan prediksi polaritasnya berdasarkan teori ikatan molekul.
Jawaban:
Metana memiliki struktur tetrahedral. Atom karbon memiliki empat elektron valensi, yang masing-masing tumpang tindih dengan orbital atom hidrogen, membentuk empat orbital molekul yang membentuk sudut 109.5 derajat. Karena semua ikatan C-H bersifat nonpolar dan terdistribusi secara simetris, maka molekul metana bersifat nonpolar.
Gaya Antarmolekul
Gaya antarmolekul adalah gaya tarik-menarik yang terjadi antara molekul-molekul. Gaya ini lebih lemah daripada ikatan kovalen atau ionik yang menyatukan atom dalam sebuah molekul, tetapi gaya antarmolekul tetap penting karena memengaruhi sifat fisik zat seperti titik didih, titik lebur, dan viskositas.
Bingung dengan cara menentukan jumlah elektron valensi pada suatu atom? Atau mungkin kesulitan memahami perbedaan ikatan ion dan kovalen? Tenang, kamu bisa menemukan contoh soal ikatan kimia beserta jawabannya di berbagai sumber online. Soal-soal ini bisa membantumu memahami konsep ikatan kimia dengan lebih baik.
Ingat, untuk menguasai materi kimia, latihan soal sangat penting! Sama seperti mempelajari materi “much and many” yang bisa dipraktekkan dengan mengerjakan contoh soal yang tersedia di situs ini. Dengan latihan yang konsisten, kamu akan lebih mudah memahami dan menguasai konsep ikatan kimia, sehingga kamu siap menghadapi ujian kimia dengan percaya diri.
Jenis-jenis Gaya Antarmolekul
Ada tiga jenis utama gaya antarmolekul:
- Gaya dipol-dipol terjadi antara molekul polar, yaitu molekul yang memiliki momen dipol permanen. Momen dipol ini terjadi karena distribusi elektron yang tidak merata dalam molekul, sehingga ujung molekul memiliki muatan parsial positif dan negatif. Gaya tarik-menarik antara kutub positif dan negatif pada molekul yang berbeda inilah yang disebut gaya dipol-dipol.
- Gaya London terjadi antara semua molekul, baik polar maupun nonpolar. Gaya ini muncul karena fluktuasi sementara dalam distribusi elektron di sekitar atom, yang menyebabkan munculnya dipol sesaat. Dipol sesaat ini kemudian menginduksi dipol sesaat pada molekul di sekitarnya, sehingga terjadi gaya tarik-menarik yang lemah. Gaya London juga disebut gaya dispersi London.
- Ikatan hidrogen adalah jenis gaya dipol-dipol yang kuat yang terjadi antara molekul yang mengandung atom hidrogen yang terikat pada atom elektronegatif seperti oksigen, nitrogen, atau fluor. Atom hidrogen yang terikat pada atom elektronegatif memiliki muatan parsial positif yang kuat, sehingga dapat membentuk ikatan hidrogen yang kuat dengan pasangan elektron bebas pada atom elektronegatif lain.
Pengaruh Gaya Antarmolekul terhadap Sifat Fisik Zat
Gaya antarmolekul memengaruhi sifat fisik zat dengan cara berikut:
- Titik didih: Semakin kuat gaya antarmolekul, semakin tinggi titik didih zat. Ini karena energi yang lebih banyak diperlukan untuk mengatasi gaya tarik-menarik antara molekul dan mengubah zat dari keadaan cair menjadi gas.
- Titik lebur: Semakin kuat gaya antarmolekul, semakin tinggi titik lebur zat. Ini karena energi yang lebih banyak diperlukan untuk mengatasi gaya tarik-menarik antara molekul dan mengubah zat dari keadaan padat menjadi cair.
- Viskositas: Semakin kuat gaya antarmolekul, semakin tinggi viskositas zat. Ini karena molekul lebih sulit bergerak satu sama lain karena adanya gaya tarik-menarik yang kuat.
Contoh Soal Pengaruh Gaya Antarmolekul terhadap Titik Didih dan Titik Lebur
Berikut adalah contoh soal tentang pengaruh gaya antarmolekul terhadap titik didih dan titik lebur:
| Senyawa | Jenis Gaya Antarmolekul | Titik Didih (°C) | Titik Lebur (°C) |
|---|---|---|---|
| Metana (CH4) | Gaya London | -161 | -182 |
| Etanol (C2H5OH) | Ikatan hidrogen, gaya dipol-dipol, gaya London | 78 | -114 |
| Amonia (NH3) | Ikatan hidrogen, gaya dipol-dipol, gaya London | -33 | -78 |
Dari tabel di atas, dapat dilihat bahwa titik didih dan titik lebur etanol dan amonia lebih tinggi daripada metana. Hal ini karena etanol dan amonia memiliki ikatan hidrogen, yang merupakan gaya antarmolekul yang lebih kuat daripada gaya London yang terjadi di metana. Ikatan hidrogen menyebabkan molekul etanol dan amonia saling tarik-menarik dengan lebih kuat, sehingga membutuhkan energi yang lebih banyak untuk memisahkannya dan mengubahnya menjadi gas atau cair.
Penerapan Ikatan Kimia dalam Kehidupan Sehari-hari
Ikatan kimia adalah dasar dari semua materi di alam semesta, dan pemahaman tentang ikatan kimia sangat penting dalam berbagai bidang kehidupan. Dari industri dan kesehatan hingga teknologi, ikatan kimia memainkan peran penting dalam pengembangan dan kemajuan berbagai aspek kehidupan manusia.
Industri
Ikatan kimia memiliki peran penting dalam berbagai industri, mulai dari manufaktur hingga produksi energi. Beberapa contoh penerapan ikatan kimia dalam industri:
- Industri Petrokimia: Ikatan kimia sangat penting dalam industri petrokimia. Proses seperti pemisahan, pemurnian, dan sintesis senyawa organik, seperti plastik, bahan bakar, dan pupuk, melibatkan pemahaman tentang ikatan kimia. Misalnya, ikatan kovalen dalam molekul hidrokarbon memungkinkan pembentukan rantai panjang yang membentuk dasar berbagai produk petrokimia.
- Industri Metalurgi: Dalam industri metalurgi, ikatan kimia memainkan peran kunci dalam pembuatan dan pengolahan logam. Ikatan logam, misalnya, bertanggung jawab atas sifat kuat, konduktif, dan mudah dibentuk dari logam. Pemahaman tentang ikatan logam memungkinkan kita untuk mengendalikan sifat-sifat logam, seperti kekuatan dan ketahanan korosi.
- Industri Keramik: Ikatan kimia juga penting dalam industri keramik. Ikatan ionik dalam keramik memberikan sifat tahan panas, tahan korosi, dan kekuatan tinggi. Contohnya, keramik seperti porselen dan kaca tahan terhadap suhu tinggi karena ikatan ionik yang kuat di antara atom-atomnya.
Kesehatan
Ikatan kimia memainkan peran penting dalam bidang kesehatan. Beberapa contoh penerapan ikatan kimia dalam bidang kesehatan:
- Sintesis Obat: Pemahaman tentang ikatan kimia sangat penting dalam sintesis obat. Para ahli kimia menggunakan prinsip-prinsip ikatan kimia untuk merancang dan mensintesis molekul obat yang dapat berinteraksi dengan target biologis tertentu dalam tubuh, seperti enzim atau protein. Misalnya, obat aspirin, yang digunakan untuk meredakan nyeri dan demam, bekerja dengan menghambat enzim yang terlibat dalam proses inflamasi.
- Diagnostik: Ikatan kimia juga penting dalam diagnostik medis. Teknik seperti Magnetic Resonance Imaging (MRI) dan Positron Emission Tomography (PET) menggunakan prinsip-prinsip ikatan kimia untuk menghasilkan gambar yang detail dari organ dan jaringan tubuh. Misalnya, MRI memanfaatkan sifat magnetik inti atom hidrogen dalam molekul air untuk menghasilkan gambar yang detail dari organ tubuh.
- Biomaterial: Ikatan kimia memainkan peran penting dalam pengembangan biomaterial, yaitu material yang dirancang untuk berinteraksi dengan sistem biologis. Contohnya, implan medis, seperti sendi buatan dan tulang buatan, dibuat dengan menggunakan material yang memiliki ikatan kimia yang kuat dan kompatibel dengan jaringan tubuh.
Teknologi
Ikatan kimia memiliki peran yang sangat penting dalam pengembangan teknologi baru. Pemahaman tentang ikatan kimia memungkinkan kita untuk menciptakan material baru dengan sifat yang unik, mengembangkan perangkat elektronik yang lebih efisien, dan mendesain proses industri yang lebih ramah lingkungan.
- Material Baru: Ikatan kimia memainkan peran kunci dalam pengembangan material baru dengan sifat yang unik. Misalnya, graphene, material dua dimensi yang terbuat dari atom karbon yang terikat dalam struktur heksagonal, memiliki kekuatan tarik yang luar biasa, konduktivitas listrik yang tinggi, dan fleksibilitas yang sangat baik. Pemahaman tentang ikatan kimia memungkinkan kita untuk mengendalikan sifat-sifat material baru ini, membuka jalan untuk aplikasi baru dalam berbagai bidang, seperti elektronik, energi, dan kedokteran.
- Perangkat Elektronik: Ikatan kimia juga penting dalam pengembangan perangkat elektronik. Misalnya, transistor, komponen dasar dari komputer dan perangkat elektronik lainnya, bekerja dengan mengontrol aliran arus listrik melalui material semikonduktor. Pemahaman tentang ikatan kimia memungkinkan kita untuk mendesain transistor yang lebih kecil, lebih cepat, dan lebih efisien.
- Energi: Ikatan kimia sangat penting dalam pengembangan teknologi energi. Misalnya, sel surya, yang mengubah energi matahari menjadi energi listrik, bekerja dengan menggunakan material semikonduktor yang menyerap cahaya dan menghasilkan elektron. Pemahaman tentang ikatan kimia memungkinkan kita untuk mendesain sel surya yang lebih efisien dan hemat biaya.
Ringkasan Akhir
Memahami ikatan kimia adalah kunci untuk memahami bagaimana materi berinteraksi dan membentuk dunia kita. Dengan memahami konsep-konsep dasar ikatan kimia, kita dapat membuka pintu menuju berbagai bidang ilmu pengetahuan dan teknologi. Dari pengembangan obat-obatan hingga penciptaan material baru, pemahaman kita tentang ikatan kimia sangatlah penting.





