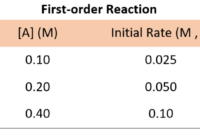
Pernahkah kamu bertanya-tanya mengapa beberapa reaksi kimia berlangsung dengan cepat, sementara yang lain membutuhkan waktu lama? Kinetika kimia adalah cabang ilmu kimia yang mempelajari laju reaksi dan faktor-faktor yang memengaruhinya. Melalui pemahaman kinetika kimia, kita dapat mengendalikan laju reaksi dan memanipulasinya untuk mencapai hasil yang diinginkan. Contoh soal kinetika kimia akan membantu kamu memahami konsep-konsep dasar dan menerapkannya dalam berbagai situasi.
Dari memahami teori tumbukan hingga menentukan hukum laju reaksi, contoh soal kinetika kimia akan memandu kamu dalam menjelajahi dunia molekul yang dinamis. Kamu akan mempelajari bagaimana suhu, konsentrasi, luas permukaan, dan katalis dapat memengaruhi laju reaksi. Contoh soal juga akan membantu kamu dalam mengidentifikasi langkah penentu laju dalam reaksi multi-langkah dan memahami peran katalis dalam mempercepat reaksi.
Pengertian Kinetika Kimia: Contoh Soal Kinetika Kimia
Kinetika kimia adalah cabang ilmu kimia yang mempelajari tentang laju dan mekanisme reaksi kimia. Kinetika kimia membantu kita memahami bagaimana reaksi kimia berlangsung dan faktor-faktor apa yang dapat memengaruhi kecepatannya.
Konsep Dasar Kinetika Kimia
Konsep dasar kinetika kimia berpusat pada laju reaksi. Laju reaksi adalah ukuran seberapa cepat reaktan berubah menjadi produk dalam suatu reaksi kimia. Semakin cepat laju reaksi, semakin cepat reaktan habis dan produk terbentuk. Laju reaksi biasanya dinyatakan dalam satuan konsentrasi per satuan waktu, misalnya mol per liter per detik (mol/L·s).
Contoh Reaksi Kimia Sederhana dan Faktor-Faktor yang Memengaruhi Laju Reaksi
Sebagai contoh, perhatikan reaksi sederhana antara asam klorida (HCl) dan magnesium (Mg) untuk menghasilkan magnesium klorida (MgCl2) dan hidrogen (H2):
2 HCl(aq) + Mg(s) → MgCl2(aq) + H2(g)
Laju reaksi ini dapat dipengaruhi oleh beberapa faktor, yaitu:
- Konsentrasi reaktan: Semakin tinggi konsentrasi reaktan, semakin banyak tumbukan antara molekul reaktan, sehingga laju reaksi akan meningkat.
- Suhu: Peningkatan suhu akan meningkatkan energi kinetik molekul reaktan, sehingga lebih banyak tumbukan yang menghasilkan reaksi, dan laju reaksi akan meningkat.
- Luas permukaan: Untuk reaksi yang melibatkan zat padat, luas permukaan yang lebih besar akan meningkatkan laju reaksi karena lebih banyak permukaan yang tersedia untuk kontak dengan reaktan lainnya.
- Keberadaan katalis: Katalis adalah zat yang mempercepat laju reaksi tanpa dikonsumsi dalam proses reaksi. Katalis bekerja dengan menurunkan energi aktivasi reaksi, sehingga lebih banyak molekul yang memiliki energi cukup untuk bereaksi.
Perbedaan Reaksi Orde Nol, Orde Satu, dan Orde Dua
Orde reaksi menunjukkan bagaimana laju reaksi dipengaruhi oleh perubahan konsentrasi reaktan. Berikut tabel yang menunjukkan perbedaan antara reaksi orde nol, orde satu, dan orde dua:
| Orde Reaksi | Persamaan Laju | Satuan Konstanta Laju (k) | Keterangan |
|---|---|---|---|
| Orde Nol | Laju = k | mol/L·s | Laju reaksi tidak bergantung pada konsentrasi reaktan. |
| Orde Satu | Laju = k[A] | s-1 | Laju reaksi sebanding dengan konsentrasi reaktan. |
| Orde Dua | Laju = k[A]2 atau Laju = k[A][B] | L·mol-1·s-1 | Laju reaksi sebanding dengan kuadrat konsentrasi reaktan atau dengan hasil kali konsentrasi dua reaktan. |
Faktor-Faktor yang Mempengaruhi Laju Reaksi
Laju reaksi merupakan ukuran seberapa cepat reaksi kimia berlangsung. Kecepatan reaksi ini dapat dipengaruhi oleh berbagai faktor, dan memahami faktor-faktor ini sangat penting dalam mengendalikan dan memprediksi hasil reaksi kimia. Dalam pembahasan ini, kita akan mengulas lima faktor utama yang memengaruhi laju reaksi kimia, dengan contoh-contoh ilustrasi yang mudah dipahami.
Suhu
Suhu merupakan faktor utama yang memengaruhi laju reaksi. Semakin tinggi suhu, semakin cepat laju reaksi. Hal ini karena suhu yang lebih tinggi menyebabkan partikel-partikel reaktan bergerak lebih cepat, sehingga lebih sering terjadi tumbukan antar partikel. Tumbukan yang lebih sering dan dengan energi kinetik yang lebih tinggi meningkatkan peluang terjadinya reaksi.
Sebagai ilustrasi, bayangkan kamu sedang menggoreng telur. Telur akan matang lebih cepat di atas api yang lebih panas. Hal ini karena panas dari api meningkatkan suhu telur, sehingga partikel-partikel dalam telur bergerak lebih cepat dan lebih sering bereaksi dengan panas, menyebabkan telur matang lebih cepat.
Konsentrasi Reaktan
Konsentrasi reaktan juga memengaruhi laju reaksi. Semakin tinggi konsentrasi reaktan, semakin cepat laju reaksi. Hal ini karena semakin banyak partikel reaktan dalam suatu volume, semakin sering terjadi tumbukan antar partikel, sehingga peluang terjadinya reaksi juga meningkat.
Sebagai contoh, bayangkan kamu mencampur gula dengan air. Gula akan larut lebih cepat dalam air jika konsentrasinya lebih tinggi. Hal ini karena semakin banyak partikel gula dalam air, semakin sering terjadi tumbukan antara partikel gula dengan air, sehingga gula akan larut lebih cepat.
Luas Permukaan
Luas permukaan juga memengaruhi laju reaksi. Semakin luas permukaan reaktan, semakin cepat laju reaksi. Hal ini karena semakin luas permukaan, semakin banyak partikel reaktan yang terpapar dengan reaktan lain, sehingga peluang terjadinya reaksi juga meningkat.
Sebagai contoh, serbuk kayu akan terbakar lebih cepat dibandingkan dengan kayu balok. Hal ini karena serbuk kayu memiliki luas permukaan yang jauh lebih besar dibandingkan dengan kayu balok, sehingga lebih banyak partikel kayu yang terpapar dengan oksigen, sehingga reaksi pembakaran berlangsung lebih cepat.
Katalis
Katalis adalah zat yang dapat mempercepat laju reaksi tanpa ikut bereaksi. Katalis bekerja dengan menurunkan energi aktivasi reaksi, yaitu energi minimum yang dibutuhkan agar reaksi dapat berlangsung. Katalis tidak mengubah hasil reaksi, tetapi hanya mempercepat laju reaksi.
Contohnya, enzim adalah katalis biologis yang mempercepat reaksi kimia dalam tubuh kita. Enzim bekerja dengan menurunkan energi aktivasi reaksi, sehingga reaksi dapat berlangsung lebih cepat dan efisien.
Sifat Reaktan
Sifat reaktan juga memengaruhi laju reaksi. Beberapa reaktan lebih reaktif daripada yang lain. Reaksi yang melibatkan reaktan yang lebih reaktif akan berlangsung lebih cepat. Sebagai contoh, logam alkali seperti natrium sangat reaktif dan bereaksi dengan air dengan cepat, sedangkan logam transisi seperti emas relatif tidak reaktif dan tidak bereaksi dengan air.
Teori Tumbukan

Teori tumbukan merupakan salah satu teori penting dalam kinetika kimia yang menjelaskan bagaimana laju reaksi kimia dipengaruhi oleh tumbukan antara molekul-molekul reaktan. Teori ini menyatakan bahwa reaksi kimia hanya dapat terjadi ketika molekul-molekul reaktan bertumbukan dengan energi kinetik yang cukup dan orientasi yang tepat.
Hubungan Teori Tumbukan dengan Laju Reaksi
Teori tumbukan memberikan penjelasan tentang bagaimana laju reaksi kimia dipengaruhi oleh beberapa faktor, seperti konsentrasi reaktan, suhu, dan luas permukaan. Berikut penjelasan lebih lanjut:
- Konsentrasi reaktan: Semakin tinggi konsentrasi reaktan, semakin banyak molekul reaktan yang tersedia untuk bertumbukan. Dengan demikian, peluang terjadinya tumbukan efektif akan meningkat, yang mengakibatkan laju reaksi meningkat.
- Suhu: Peningkatan suhu akan meningkatkan energi kinetik rata-rata molekul reaktan. Akibatnya, jumlah tumbukan yang memiliki energi kinetik yang cukup untuk mengatasi energi aktivasi akan meningkat, sehingga laju reaksi meningkat.
- Luas permukaan: Untuk reaksi yang melibatkan zat padat, luas permukaan yang lebih besar akan meningkatkan peluang tumbukan antara molekul reaktan dan permukaan zat padat. Ini akan meningkatkan laju reaksi.
Peran Energi Aktivasi dalam Teori Tumbukan
Energi aktivasi merupakan energi minimum yang harus dimiliki oleh molekul reaktan agar dapat bereaksi. Dalam teori tumbukan, energi aktivasi berperan sebagai penghalang energi yang harus diatasi oleh molekul reaktan agar dapat bertumbukan secara efektif.
Hanya tumbukan yang memiliki energi kinetik yang sama dengan atau lebih besar dari energi aktivasi yang dapat menyebabkan reaksi kimia. Hal ini karena energi aktivasi diperlukan untuk memutuskan ikatan kimia pada molekul reaktan dan membentuk ikatan kimia baru pada produk.
Berikut adalah ilustrasi sederhana yang menunjukkan proses tumbukan efektif dan tidak efektif dalam reaksi kimia:
| Tumbukan Efektif | Tumbukan Tidak Efektif |
|
Ilustrasi: Dua molekul reaktan dengan energi kinetik yang cukup dan orientasi yang tepat bertumbukan, sehingga terjadi pemutusan ikatan kimia pada reaktan dan pembentukan ikatan kimia baru pada produk. |
Ilustrasi: Dua molekul reaktan dengan energi kinetik yang tidak cukup atau orientasi yang tidak tepat bertumbukan. Tumbukan ini tidak menghasilkan reaksi kimia karena tidak cukup energi untuk mengatasi energi aktivasi atau orientasi molekul tidak memungkinkan pembentukan ikatan kimia baru. |
Hukum Laju Reaksi
Hukum laju reaksi merupakan persamaan matematis yang menyatakan hubungan antara laju reaksi dengan konsentrasi reaktan. Hukum laju reaksi ini sangat penting dalam memahami bagaimana reaksi kimia berlangsung dan bagaimana faktor-faktor seperti suhu dan konsentrasi mempengaruhi laju reaksi.
Menentukan Hukum Laju Reaksi
Hukum laju reaksi dapat ditentukan dengan melakukan eksperimen dan menganalisis data yang diperoleh. Untuk menentukan hukum laju reaksi, kita perlu mengetahui orde reaksi terhadap setiap reaktan. Orde reaksi menunjukkan pengaruh perubahan konsentrasi reaktan terhadap laju reaksi.
Contoh soal kinetika kimia seringkali melibatkan perhitungan laju reaksi dan faktor-faktor yang mempengaruhinya. Misalnya, kita bisa menganalisis bagaimana suhu mempengaruhi kecepatan reaksi dekomposisi hidrogen peroksida. Penting untuk diingat bahwa memahami kinetika kimia juga dapat membantu kita dalam memahami proses-proses yang lebih kompleks, seperti reaksi kimia dalam tubuh manusia.
Konsep ini juga dapat dikaitkan dengan studi kasus kehilangan dan berduka, seperti yang dibahas dalam contoh soal kasus kehilangan dan berduka. Misalnya, memahami bagaimana individu bereaksi terhadap kehilangan dapat dianalogikan dengan memahami laju reaksi dalam kinetika kimia, dimana faktor-faktor seperti dukungan sosial dan mekanisme koping dapat mempengaruhi laju proses penyembuhan.
- Orde reaksi terhadap suatu reaktan dapat ditentukan dengan melakukan eksperimen dengan mengubah konsentrasi reaktan tersebut, sambil menjaga konsentrasi reaktan lainnya tetap konstan. Dengan mengamati perubahan laju reaksi, kita dapat menentukan orde reaksi terhadap reaktan tersebut.
- Misalnya, jika penggandaan konsentrasi suatu reaktan mengakibatkan laju reaksi menjadi dua kali lipat, maka orde reaksi terhadap reaktan tersebut adalah satu. Jika penggandaan konsentrasi reaktan mengakibatkan laju reaksi menjadi empat kali lipat, maka orde reaksi terhadap reaktan tersebut adalah dua.
Contoh Soal Menentukan Orde Reaksi dan Konstanta Laju Reaksi
Misalnya, kita ingin menentukan hukum laju reaksi untuk reaksi berikut:
A + B → C
Data eksperimen menunjukkan hasil berikut:
| Eksperimen | [A] (M) | [B] (M) | Laju Reaksi (M/s) |
|---|---|---|---|
| 1 | 0.1 | 0.1 | 0.001 |
| 2 | 0.2 | 0.1 | 0.004 |
| 3 | 0.1 | 0.2 | 0.002 |
Untuk menentukan orde reaksi terhadap A, kita bandingkan eksperimen 1 dan 2. Pada eksperimen 2, konsentrasi A digandakan, sedangkan konsentrasi B tetap sama. Laju reaksi menjadi empat kali lipat. Ini menunjukkan bahwa orde reaksi terhadap A adalah dua.
Untuk menentukan orde reaksi terhadap B, kita bandingkan eksperimen 1 dan 3. Pada eksperimen 3, konsentrasi B digandakan, sedangkan konsentrasi A tetap sama. Laju reaksi menjadi dua kali lipat. Ini menunjukkan bahwa orde reaksi terhadap B adalah satu.
Hukum laju reaksi untuk reaksi ini adalah:
Laju = k[A]2[B]
Konstanta laju reaksi (k) dapat ditentukan dengan memasukkan data dari salah satu eksperimen ke dalam hukum laju reaksi. Misalnya, dengan menggunakan data dari eksperimen 1:
0.001 = k(0.1)2(0.1)
k = 10 M-2s-1
Hubungan Antara Orde Reaksi, Konstanta Laju Reaksi, dan Waktu Paruh Reaksi
Orde reaksi, konstanta laju reaksi, dan waktu paruh reaksi saling berhubungan. Waktu paruh reaksi adalah waktu yang dibutuhkan untuk konsentrasi reaktan berkurang menjadi setengahnya. Hubungan antara ketiga faktor ini dirangkum dalam tabel berikut:
| Orde Reaksi | Konstanta Laju Reaksi (k) | Waktu Paruh (t1/2) |
|---|---|---|
| 0 | k | t1/2 = [A]0 / 2k |
| 1 | k | t1/2 = ln(2) / k |
| 2 | k | t1/2 = 1 / k[A]0 |
Mekanisme Reaksi
Reaksi kimia tidak selalu terjadi dalam satu langkah tunggal. Banyak reaksi terjadi melalui serangkaian langkah yang disebut mekanisme reaksi. Mekanisme reaksi memberikan gambaran yang lebih rinci tentang bagaimana reaktan berubah menjadi produk, termasuk pembentukan zat antara yang tidak stabil.
Langkah-langkah dalam Reaksi Multi-Langkah
Reaksi multi-langkah terdiri dari beberapa langkah elementer, yaitu reaksi yang terjadi dalam satu langkah tunggal. Setiap langkah elementer memiliki persamaan laju sendiri, yang menggambarkan kecepatan langkah tersebut.
- Langkah elementer: Reaksi yang terjadi dalam satu langkah tunggal, melibatkan tumbukan langsung antara molekul reaktan.
- Zat antara: Spesies yang terbentuk dalam satu langkah elementer dan dikonsumsi dalam langkah berikutnya. Zat antara tidak stabil dan biasanya berumur pendek.
- Langkah penentu laju: Langkah elementer yang paling lambat dalam mekanisme reaksi. Langkah ini menentukan kecepatan keseluruhan reaksi.
Contoh Reaksi Multi-Langkah
Sebagai contoh, perhatikan reaksi pembentukan ozon (O3) dari oksigen (O2):
O2 + O → O3
Reaksi ini sebenarnya terjadi melalui dua langkah elementer:
- O2 + O → O + O3 (langkah lambat)
- O + O2 → O3 (langkah cepat)
Langkah pertama adalah langkah penentu laju karena merupakan langkah paling lambat. Langkah kedua terjadi jauh lebih cepat dan tidak memengaruhi kecepatan keseluruhan reaksi.
Diagram Energi Potensial, Contoh soal kinetika kimia
Diagram energi potensial dapat digunakan untuk menggambarkan mekanisme reaksi multi-langkah. Diagram ini menunjukkan perubahan energi potensial selama reaksi, dengan sumbu x mewakili kemajuan reaksi dan sumbu y mewakili energi potensial.
Untuk reaksi multi-langkah, diagram energi potensial akan menunjukkan beberapa puncak dan lembah. Setiap puncak mewakili keadaan transisi, yaitu keadaan energi tinggi yang terjadi selama langkah elementer. Setiap lembah mewakili zat antara. Energi aktivasi untuk setiap langkah elementer adalah perbedaan energi antara keadaan transisi dan reaktan untuk langkah tersebut.
Dalam diagram energi potensial untuk reaksi pembentukan ozon, kita akan melihat dua puncak dan satu lembah. Puncak pertama mewakili keadaan transisi untuk langkah pertama, dan lembah mewakili zat antara (O). Puncak kedua mewakili keadaan transisi untuk langkah kedua. Energi aktivasi untuk langkah pertama lebih tinggi daripada energi aktivasi untuk langkah kedua, yang sesuai dengan langkah pertama menjadi langkah penentu laju.
Katalis
Katalis adalah zat yang dapat mempercepat laju reaksi kimia tanpa ikut bereaksi dalam reaksi tersebut. Katalis bekerja dengan menyediakan jalur reaksi alternatif yang memiliki energi aktivasi lebih rendah, sehingga lebih banyak molekul yang memiliki energi yang cukup untuk bereaksi.
Peran Katalis
Katalis tidak ikut bereaksi dalam reaksi, artinya katalis tidak menjadi reaktan atau produk dalam reaksi. Katalis hanya mempercepat laju reaksi dengan menurunkan energi aktivasi. Setelah reaksi selesai, katalis dapat diperoleh kembali dalam bentuk aslinya.
Contoh Katalis Homogen dan Heterogen
Katalis dapat dibedakan menjadi dua jenis, yaitu katalis homogen dan katalis heterogen.
Katalis Homogen
Katalis homogen adalah katalis yang berada dalam fase yang sama dengan reaktan. Contohnya:
- Reaksi oksidasi sulfur dioksida (SO2) menjadi sulfur trioksida (SO3) dengan menggunakan katalis vanadium pentoksida (V2O5) dalam fase gas.
- Reaksi hidrolisis ester dengan menggunakan katalis asam kuat seperti asam sulfat (H2SO4) dalam fase cair.
Katalis Heterogen
Katalis heterogen adalah katalis yang berada dalam fase berbeda dengan reaktan. Contohnya:
- Reaksi hidrogenasi minyak sayur dengan menggunakan katalis nikel (Ni) dalam fase padat.
- Reaksi oksidasi amonia (NH3) menjadi nitrogen oksida (NO) dengan menggunakan katalis platinum (Pt) dalam fase padat.
Perbedaan Katalis Positif dan Katalis Negatif
| Katalis | Penjelasan | Contoh |
|---|---|---|
| Katalis Positif | Katalis yang mempercepat laju reaksi | Enzim dalam tubuh manusia |
| Katalis Negatif | Katalis yang memperlambat laju reaksi | Senyawa antioksidan yang digunakan sebagai pengawet makanan |
Soal Latihan Kinetika Kimia
Kinetika kimia adalah cabang ilmu kimia yang mempelajari laju reaksi dan faktor-faktor yang memengaruhi laju tersebut. Konsep-konsep kinetika kimia sangat penting untuk memahami bagaimana reaksi kimia berlangsung dan bagaimana mengoptimalkan proses kimia. Untuk menguji pemahaman Anda tentang kinetika kimia, berikut ini beberapa soal latihan.
Faktor-faktor yang Memengaruhi Laju Reaksi
Laju reaksi dipengaruhi oleh berbagai faktor, seperti konsentrasi reaktan, suhu, luas permukaan, dan keberadaan katalis. Soal-soal latihan berikut akan membantu Anda memahami bagaimana faktor-faktor ini memengaruhi laju reaksi.
- Bagaimana perubahan konsentrasi reaktan memengaruhi laju reaksi? Jelaskan dengan menggunakan hukum laju reaksi dan berikan contoh.
- Bagaimana suhu memengaruhi laju reaksi? Jelaskan dengan menggunakan teori tumbukan dan berikan contoh.
- Bagaimana luas permukaan memengaruhi laju reaksi? Jelaskan dengan menggunakan contoh reaksi yang melibatkan padatan.
- Bagaimana katalis memengaruhi laju reaksi? Jelaskan dengan menggunakan diagram energi dan berikan contoh.
Hukum Laju Reaksi
Hukum laju reaksi adalah persamaan matematis yang menyatakan hubungan antara laju reaksi dengan konsentrasi reaktan. Soal-soal latihan berikut akan membantu Anda memahami bagaimana menentukan hukum laju reaksi dan menggunakannya untuk memprediksi laju reaksi.
- Bagaimana menentukan hukum laju reaksi dari data eksperimen? Jelaskan dengan menggunakan contoh.
- Bagaimana menentukan orde reaksi terhadap setiap reaktan dan orde reaksi total dari hukum laju reaksi? Jelaskan dengan menggunakan contoh.
- Bagaimana menentukan konstanta laju reaksi dari hukum laju reaksi dan data eksperimen? Jelaskan dengan menggunakan contoh.
Mekanisme Reaksi
Mekanisme reaksi adalah urutan langkah-langkah elementer yang terjadi selama reaksi kimia. Soal-soal latihan berikut akan membantu Anda memahami bagaimana menentukan mekanisme reaksi dan menggunakannya untuk memprediksi laju reaksi.
- Bagaimana menentukan langkah penentu laju dari mekanisme reaksi? Jelaskan dengan menggunakan contoh.
- Bagaimana menentukan persamaan laju reaksi berdasarkan mekanisme reaksi? Jelaskan dengan menggunakan contoh.
- Bagaimana menggunakan teori keadaan transisi untuk menjelaskan mekanisme reaksi? Jelaskan dengan menggunakan contoh.
Aplikasi Kinetika Kimia
Kinetika kimia memiliki aplikasi yang luas dalam berbagai bidang kehidupan, mulai dari kehidupan sehari-hari hingga industri dan kesehatan. Ilmu ini membantu kita memahami laju dan mekanisme reaksi kimia, yang sangat penting untuk mengoptimalkan proses kimia dan merancang produk baru.
Aplikasi Kinetika Kimia dalam Kehidupan Sehari-hari
Kinetika kimia membantu kita memahami dan mengendalikan berbagai proses kimia yang terjadi di sekitar kita. Berikut beberapa contohnya:
- Pemasakan makanan: Kinetika kimia membantu kita memahami bagaimana suhu dan waktu memengaruhi laju reaksi kimia dalam memasak. Misalnya, memasak daging pada suhu tinggi akan mempercepat reaksi kimia yang menyebabkan daging matang lebih cepat.
- Penyimpanan makanan: Kinetika kimia membantu kita memahami bagaimana suhu dan kelembapan memengaruhi laju reaksi kimia yang menyebabkan makanan membusuk. Misalnya, menyimpan makanan di lemari es dapat memperlambat laju reaksi kimia yang menyebabkan pembusukan, sehingga makanan dapat bertahan lebih lama.
- Pembakaran bahan bakar: Kinetika kimia membantu kita memahami bagaimana laju reaksi kimia dalam pembakaran bahan bakar memengaruhi efisiensi pembakaran. Misalnya, mesin mobil dirancang agar pembakaran bahan bakar terjadi dengan laju yang optimal untuk menghasilkan tenaga yang maksimal.
Akhir Kata
Mempelajari kinetika kimia tidak hanya penting dalam memahami dunia kimia, tetapi juga memiliki aplikasi yang luas dalam berbagai bidang. Kinetika kimia membantu kita dalam mengembangkan obat-obatan yang lebih efektif, menciptakan bahan-bahan baru, dan meningkatkan efisiensi proses industri. Dengan memahami contoh soal kinetika kimia, kamu akan memiliki pemahaman yang lebih mendalam tentang bagaimana reaksi kimia terjadi dan bagaimana kita dapat mengendalikannya untuk mencapai tujuan kita.