Contoh soal rumus molekul – Pernahkah Anda bertanya-tanya bagaimana para ilmuwan dapat menentukan rumus kimia suatu senyawa? Rumus molekul, yang merupakan representasi simbolis dari susunan atom dalam suatu molekul, menjadi kunci untuk memahami sifat dan perilaku senyawa. Melalui contoh soal dan penyelesaiannya, kita akan menjelajahi dunia rumus molekul dan mengungkap bagaimana rumus ini berperan penting dalam kimia.
Menentukan rumus molekul suatu senyawa merupakan langkah penting dalam memahami struktur dan sifatnya. Proses ini melibatkan perhitungan massa atom relatif (Ar) dan perbandingan jumlah atom dalam suatu senyawa. Dengan mempelajari contoh soal dan penyelesaiannya, kita dapat memahami konsep rumus molekul dengan lebih baik dan mengaplikasikannya dalam berbagai bidang, seperti industri, kesehatan, dan lingkungan.
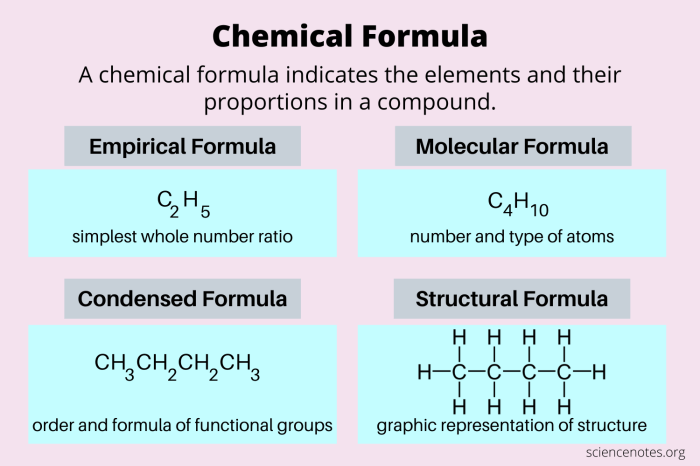
Pengertian Rumus Molekul
Rumus molekul adalah sebuah cara untuk menunjukkan jenis dan jumlah atom yang menyusun sebuah molekul. Rumus ini memberikan gambaran lengkap tentang komposisi sebuah senyawa, dengan mencantumkan simbol kimia dan jumlah atom masing-masing unsur yang terkandung di dalamnya.
Contoh Rumus Molekul
Rumus molekul memberikan informasi yang lebih detail dibandingkan dengan rumus empiris. Berikut beberapa contoh rumus molekul dan senyawa yang diwakilinya:
- H2O (Air)
- CO2 (Karbon dioksida)
- C6H12O6 (Glukosa)
- NaCl (Natrium klorida)
Perbedaan Rumus Molekul dan Rumus Empiris
Rumus molekul menunjukkan jumlah atom sebenarnya yang menyusun sebuah molekul, sedangkan rumus empiris menunjukkan perbandingan terkecil dari atom-atom dalam suatu senyawa. Rumus empiris tidak menunjukkan jumlah atom yang sebenarnya, melainkan perbandingan terkecil dari atom-atom dalam senyawa tersebut.
Sebagai contoh, rumus molekul glukosa adalah C6H12O6, sedangkan rumus empirisnya adalah CH2O. Rumus empiris menunjukkan bahwa dalam glukosa, atom karbon, hidrogen, dan oksigen terdapat dalam perbandingan 1:2:1.
Cara Menentukan Rumus Molekul
Rumus molekul merupakan representasi dari jenis dan jumlah atom yang menyusun suatu molekul. Rumus molekul sangat penting dalam kimia karena memberikan informasi tentang komposisi suatu senyawa. Menentukan rumus molekul suatu senyawa dapat dilakukan melalui berbagai cara, salah satunya adalah dengan menggunakan data empiris dan data massa molekul relatif (Mr).
Langkah-langkah Menentukan Rumus Molekul
Berikut adalah langkah-langkah yang dapat digunakan untuk menentukan rumus molekul suatu senyawa:
- Tentukan rumus empiris senyawa tersebut. Rumus empiris menunjukkan perbandingan paling sederhana dari atom-atom dalam suatu senyawa.
- Tentukan massa molekul relatif (Mr) senyawa tersebut. Mr dapat diperoleh dari data eksperimen atau dari tabel periodik.
- Hitung massa molekul relatif (Mr) dari rumus empiris.
- Bagilah Mr senyawa dengan Mr rumus empiris. Hasil bagi ini menunjukkan faktor pengali untuk rumus empiris.
- Kalikan rumus empiris dengan faktor pengali yang diperoleh pada langkah sebelumnya. Hasilnya adalah rumus molekul senyawa tersebut.
Contoh Soal dan Penyelesaian
Berikut adalah contoh soal dan penyelesaiannya dalam menentukan rumus molekul suatu senyawa:
Sebuah senyawa organik memiliki rumus empiris CH2O dan massa molekul relatif (Mr) sebesar 180. Tentukan rumus molekul senyawa tersebut.
- Rumus empiris: CH2O
- Mr senyawa: 180
- Mr rumus empiris: 12 + 2 + 16 = 30
- Faktor pengali: 180 / 30 = 6
- Rumus molekul: (CH2O)6 = C6H12O6
Jadi, rumus molekul senyawa tersebut adalah C6H12O6.
Tabel Langkah-langkah Menentukan Rumus Molekul
| Langkah | Contoh Soal | Penyelesaian |
|---|---|---|
| Tentukan rumus empiris senyawa tersebut. | Sebuah senyawa organik memiliki rumus empiris CH2O. | Rumus empiris: CH2O |
| Tentukan massa molekul relatif (Mr) senyawa tersebut. | Massa molekul relatif (Mr) senyawa tersebut sebesar 180. | Mr senyawa: 180 |
| Hitung massa molekul relatif (Mr) dari rumus empiris. | Mr rumus empiris: 12 + 2 + 16 = 30 | |
| Bagilah Mr senyawa dengan Mr rumus empiris. | Faktor pengali: 180 / 30 = 6 | |
| Kalikan rumus empiris dengan faktor pengali yang diperoleh pada langkah sebelumnya. | Rumus molekul: (CH2O)6 = C6H12O6 |
Contoh Soal Rumus Molekul dan Penyelesaiannya
Rumus molekul merupakan representasi kimia yang menunjukkan jenis dan jumlah atom yang terdapat dalam suatu molekul. Untuk menentukan rumus molekul, kita perlu memahami konsep massa atom relatif (Ar) dan bagaimana mengaplikasikannya dalam perhitungan.
Contoh Soal Rumus Molekul dengan Perhitungan Ar
Contoh soal ini akan membahas bagaimana menentukan rumus molekul suatu senyawa dengan menggunakan data massa atom relatif (Ar).
- Misalkan kita memiliki senyawa dengan massa molekul relatif (Mr) sebesar 180 dan diketahui senyawa tersebut terdiri dari atom karbon (C), hidrogen (H), dan oksigen (O). Ar C = 12, Ar H = 1, dan Ar O = 16.
- Langkah pertama adalah menentukan rumus empiris senyawa tersebut. Rumus empiris adalah rumus paling sederhana yang menunjukkan perbandingan atom-atom dalam suatu senyawa. Untuk menentukan rumus empiris, kita perlu membagi jumlah atom setiap unsur dengan jumlah atom terkecil.
- Misalnya, jika senyawa tersebut memiliki 6 atom karbon, 12 atom hidrogen, dan 6 atom oksigen, maka rumus empirisnya adalah CH2O.
- Langkah selanjutnya adalah menentukan rumus molekul senyawa tersebut. Rumus molekul menunjukkan jumlah atom yang sebenarnya dalam suatu molekul. Untuk menentukan rumus molekul, kita perlu membandingkan Mr senyawa dengan Mr rumus empiris.
- Dalam contoh ini, Mr CH2O adalah 30. Karena Mr senyawa adalah 180, maka rumus molekulnya adalah (CH2O)6 atau C6H12O6.
Contoh Soal Rumus Molekul Kompleks
Contoh soal ini akan membahas bagaimana menentukan rumus molekul suatu senyawa kompleks.
- Misalkan kita memiliki senyawa kompleks dengan rumus empiris C2H5NO2 dan Mr sebesar 123.
- Langkah pertama adalah menentukan Mr rumus empiris. Mr C2H5NO2 adalah 75.
- Langkah selanjutnya adalah membagi Mr senyawa dengan Mr rumus empiris. 123 / 75 = 1,64.
- Karena hasil bagi ini mendekati 1,6, maka rumus molekul senyawa tersebut adalah (C2H5NO2)1,6 atau C3,2H8N1,6O3,2.
- Karena rumus molekul harus terdiri dari bilangan bulat, kita perlu mengalikan rumus tersebut dengan faktor 5.
- Maka, rumus molekul senyawa tersebut adalah C16H40N8O16.
Hubungan Rumus Molekul dengan Sifat Senyawa
Rumus molekul, yang menunjukkan jenis dan jumlah atom dalam suatu molekul, ternyata menyimpan informasi penting tentang sifat-sifat senyawa. Informasi ini dapat membantu kita memahami bagaimana suatu senyawa berinteraksi dengan senyawa lain, bagaimana ia berperilaku dalam berbagai kondisi, dan bahkan bagaimana ia dapat digunakan dalam berbagai aplikasi.
Pengaruh Rumus Molekul terhadap Sifat Senyawa
Rumus molekul memberikan gambaran tentang komposisi suatu senyawa, yang secara langsung memengaruhi sifat-sifatnya. Beberapa sifat yang dipengaruhi oleh rumus molekul meliputi:
- Titik leleh dan titik didih: Senyawa dengan ikatan antarmolekul yang kuat, seperti ikatan hidrogen, cenderung memiliki titik leleh dan titik didih yang lebih tinggi dibandingkan dengan senyawa dengan ikatan yang lebih lemah. Rumus molekul membantu kita memahami jenis ikatan antarmolekul yang ada dalam suatu senyawa.
- Kelarutan: Kelarutan suatu senyawa dalam pelarut tertentu dipengaruhi oleh polaritas molekulnya. Senyawa polar cenderung larut dalam pelarut polar, sedangkan senyawa nonpolar larut dalam pelarut nonpolar. Rumus molekul dapat memberikan petunjuk tentang polaritas suatu senyawa.
- Reaktivitas: Rumus molekul dapat menunjukkan gugus fungsi yang ada dalam suatu senyawa. Gugus fungsi merupakan bagian molekul yang memiliki sifat kimia khusus dan dapat bereaksi dengan senyawa lain. Semakin kompleks rumus molekul, semakin banyak gugus fungsi yang dimilikinya, dan semakin tinggi potensi reaktifitasnya.
Contoh Perbedaan Sifat Senyawa dengan Rumus Molekul Berbeda
Perhatikan contoh berikut:
| Senyawa | Rumus Molekul | Sifat |
|---|---|---|
| Air | H2O | Cair pada suhu kamar, titik didih tinggi, polar, pelarut yang baik untuk senyawa polar. |
| Metana | CH4 | Gas pada suhu kamar, titik didih rendah, nonpolar, tidak larut dalam air. |
Air (H2O) memiliki ikatan hidrogen yang kuat, sehingga memiliki titik didih yang tinggi dan bersifat polar. Metana (CH4) hanya memiliki ikatan Van der Waals yang lemah, sehingga memiliki titik didih yang rendah dan bersifat nonpolar. Perbedaan rumus molekul ini menghasilkan perbedaan sifat yang signifikan antara kedua senyawa tersebut.
Rumus Molekul dan Jenis Ikatan Kimia
Rumus molekul juga dapat memberikan informasi tentang jenis ikatan kimia yang ada dalam suatu senyawa. Misalnya, rumus molekul CO2 menunjukkan bahwa karbon (C) terikat pada dua atom oksigen (O) dengan ikatan kovalen rangkap. Ikatan kovalen rangkap ini lebih kuat daripada ikatan kovalen tunggal, sehingga CO2 memiliki titik didih yang lebih tinggi dibandingkan dengan senyawa yang hanya memiliki ikatan kovalen tunggal.
Memahami hubungan antara rumus molekul dan sifat senyawa sangat penting dalam berbagai bidang, seperti kimia, biologi, dan farmasi. Dengan mempelajari rumus molekul, kita dapat memprediksi dan memahami sifat-sifat senyawa, serta merancang senyawa baru dengan sifat yang diinginkan.
Contoh soal rumus molekul seringkali muncul dalam pelajaran kimia, membantu kita memahami bagaimana atom-atom bergabung membentuk senyawa. Konsep ini juga dapat dikaitkan dengan dunia perpajakan, seperti contohnya dalam menghitung PPh 21. Untuk mempelajari lebih lanjut tentang perhitungan PPh 21, kamu bisa mengunjungi contoh soal pph 21 beserta jawabannya yang bisa membantu kamu memahami cara menghitung pajak penghasilan.
Setelah mempelajari contoh soal PPh 21, kamu akan lebih memahami bagaimana konsep rumus molekul dapat diterapkan dalam berbagai bidang, termasuk perpajakan.
Penerapan Rumus Molekul dalam Kehidupan Sehari-hari
Rumus molekul merupakan representasi kimia yang menunjukkan jenis dan jumlah atom yang menyusun suatu molekul. Rumus ini bukan sekadar simbol, tetapi memiliki peran penting dalam berbagai bidang kehidupan, mulai dari industri hingga kesehatan dan lingkungan.
Penerapan Rumus Molekul dalam Bidang Industri
Rumus molekul memainkan peran penting dalam pengembangan dan produksi berbagai produk industri. Berikut beberapa contohnya:
- Industri Petrokimia: Rumus molekul membantu dalam memahami struktur dan sifat hidrokarbon, yang merupakan bahan baku utama dalam industri petrokimia. Hal ini memungkinkan para ahli kimia untuk merancang proses yang efisien untuk menghasilkan berbagai produk seperti plastik, bahan bakar, dan pelumas.
- Industri Farmasi: Rumus molekul digunakan untuk menentukan struktur dan fungsi molekul obat. Dengan memahami rumus molekul obat, para ilmuwan dapat merancang obat baru yang lebih efektif dan aman.
- Industri Pangan: Rumus molekul membantu dalam mengendalikan kualitas dan keamanan pangan. Misalnya, rumus molekul digunakan untuk menentukan kadar nutrisi dalam makanan dan untuk mengidentifikasi bahan kimia berbahaya yang mungkin terkandung dalam makanan.
Peranan Rumus Molekul dalam Kimia
Rumus molekul adalah representasi sederhana namun penting dalam kimia. Ia memberikan informasi tentang jenis dan jumlah atom yang menyusun suatu molekul. Informasi ini sangat penting dalam memahami struktur, sifat, dan perilaku suatu senyawa.
Memahami Struktur dan Sifat Senyawa
Rumus molekul memberikan informasi tentang jumlah atom yang menyusun suatu molekul, yang membantu kita memahami struktur molekul tersebut. Misalnya, rumus molekul air (H2O) menunjukkan bahwa setiap molekul air terdiri dari dua atom hidrogen dan satu atom oksigen. Informasi ini memungkinkan kita untuk membayangkan bagaimana atom-atom tersebut terhubung dalam molekul, yang pada gilirannya membantu kita memahami sifat-sifat fisik dan kimia air.
Peran Rumus Molekul dalam Reaksi Kimia
Rumus molekul berperan penting dalam menggambarkan reaksi kimia. Mereka membantu kita memahami perubahan yang terjadi pada molekul selama reaksi, seperti pemutusan dan pembentukan ikatan kimia. Misalnya, dalam reaksi pembakaran metana (CH4), rumus molekul membantu kita memahami bahwa metana bereaksi dengan oksigen (O2) untuk menghasilkan karbon dioksida (CO2) dan air (H2O).
CH4 + 2O2 → CO2 + 2H2O
Rumus molekul juga membantu kita menentukan jumlah pereaksi dan produk yang terlibat dalam reaksi, yang sangat penting dalam perhitungan stoikiometri.
Contoh Reaksi Kimia yang Melibatkan Rumus Molekul
Salah satu contoh reaksi kimia yang melibatkan rumus molekul adalah reaksi netralisasi asam dan basa. Misalnya, reaksi antara asam klorida (HCl) dan natrium hidroksida (NaOH) menghasilkan garam natrium klorida (NaCl) dan air (H2O).
HCl + NaOH → NaCl + H2O
Dalam reaksi ini, rumus molekul membantu kita memahami bahwa satu molekul asam klorida bereaksi dengan satu molekul natrium hidroksida untuk menghasilkan satu molekul natrium klorida dan satu molekul air.
Kesulitan dalam Menentukan Rumus Molekul
Menentukan rumus molekul suatu senyawa merupakan langkah penting dalam memahami sifat dan perilaku senyawa tersebut. Namun, proses ini tidak selalu mudah dan bisa dihadapkan pada beberapa kesulitan.
Kesulitan dalam Menentukan Rumus Molekul, Contoh soal rumus molekul
Beberapa kesulitan yang mungkin dihadapi dalam menentukan rumus molekul suatu senyawa adalah:
- Ketidakpastian tentang komposisi unsur: Terkadang, sulit untuk mengetahui dengan pasti komposisi unsur dalam suatu senyawa. Hal ini bisa terjadi karena berbagai faktor, seperti keberadaan pengotor atau ketidakmampuan untuk memisahkan semua komponen senyawa.
- Ketidakpastian tentang jumlah atom dalam molekul: Bahkan jika komposisi unsur diketahui, masih bisa sulit untuk menentukan jumlah atom setiap unsur dalam molekul. Hal ini disebabkan oleh beberapa faktor, seperti keberadaan isomer atau kesulitan dalam menentukan struktur molekul secara pasti.
- Ketidakpastian tentang struktur molekul: Struktur molekul sangat penting untuk menentukan rumus molekul. Namun, menentukan struktur molekul bisa menjadi proses yang rumit, terutama untuk senyawa kompleks.
Contoh Kasus
Misalnya, ketika mempelajari senyawa organik, kita mungkin menghadapi kesulitan dalam menentukan rumus molekul suatu senyawa hidrokarbon. Rumus empiris senyawa ini mungkin sama, tetapi rumus molekulnya bisa berbeda. Misalnya, senyawa C2H4 dan C4H8 memiliki rumus empiris yang sama, yaitu CH2. Namun, rumus molekulnya berbeda, yaitu C2H4 untuk etena dan C4H8 untuk butena.
Cara Mengatasi Kesulitan
Ada beberapa cara untuk mengatasi kesulitan dalam menentukan rumus molekul:
- Analisis Elemental: Teknik ini digunakan untuk menentukan komposisi unsur dalam suatu senyawa. Dengan mengetahui persentase massa setiap unsur, kita dapat menentukan rumus empiris senyawa tersebut.
- Spektroskopi: Teknik spektroskopi, seperti spektroskopi massa dan spektroskopi NMR, dapat memberikan informasi tentang struktur molekul dan massa molekul suatu senyawa. Informasi ini dapat digunakan untuk menentukan rumus molekul.
- Kristalografi sinar-X: Teknik ini digunakan untuk menentukan struktur tiga dimensi kristal. Informasi ini dapat digunakan untuk menentukan rumus molekul dan struktur molekul senyawa tersebut.
- Simulasi Komputasi: Simulasi komputasi dapat digunakan untuk memprediksi struktur dan sifat molekul. Informasi ini dapat membantu dalam menentukan rumus molekul dan memahami perilaku senyawa.
Aplikasi Rumus Molekul dalam Penelitian
Rumus molekul merupakan representasi kimia yang menunjukkan jenis dan jumlah atom yang terdapat dalam suatu molekul. Penggunaan rumus molekul dalam penelitian kimia sangat penting, karena memberikan informasi mendasar tentang komposisi dan struktur molekul.
Peran Rumus Molekul dalam Penelitian Kimia
Rumus molekul berperan penting dalam berbagai aspek penelitian kimia, seperti:
- Identifikasi Senyawa: Rumus molekul membantu mengidentifikasi senyawa secara unik, membedakannya dari senyawa lain dengan komposisi yang berbeda.
- Sintesis Senyawa: Rumus molekul menjadi panduan dalam merancang dan melaksanakan sintesis senyawa baru, dengan menentukan atom-atom yang dibutuhkan dan bagaimana mereka harus dihubungkan.
- Pengembangan Model Molekuler: Rumus molekul memberikan dasar untuk membangun model molekuler, yang membantu dalam memahami sifat dan perilaku molekul.
- Analisis Data Spektroskopi: Data spektroskopi, seperti spektroskopi massa atau spektroskopi resonansi magnetik nuklir (NMR), diinterpretasikan dengan bantuan rumus molekul untuk mengidentifikasi senyawa yang dipelajari.
- Pemodelan Komputasi: Rumus molekul digunakan dalam simulasi dan pemodelan komputasi untuk memprediksi sifat dan perilaku molekul, seperti energi, struktur, dan reaktivitas.
Kesimpulan Akhir
Memahami rumus molekul membuka pintu bagi kita untuk menjelajahi dunia kimia yang kompleks. Dengan contoh soal dan penyelesaiannya, kita dapat mengungkap rahasia di balik struktur dan sifat senyawa, serta memahami peranannya dalam berbagai aspek kehidupan. Melalui pemahaman ini, kita dapat mengapresiasi keindahan dan kompleksitas ilmu kimia serta memanfaatkannya untuk kemajuan manusia.





