Contoh soal sifat koligatif larutan elektrolit – Pernahkah kamu bertanya-tanya mengapa air laut terasa asin? Atau mengapa es krim bisa tetap dingin meskipun berada di suhu ruangan? Jawabannya terletak pada sifat koligatif larutan, yang merupakan perubahan sifat fisik larutan akibat adanya zat terlarut. Dalam larutan elektrolit, zat terlarut terionisasi, sehingga sifat koligatifnya menjadi lebih kompleks. Mari kita telusuri lebih dalam tentang sifat koligatif larutan elektrolit melalui contoh soal dan pembahasannya.
Sifat koligatif larutan elektrolit merupakan topik menarik dalam kimia yang membantu kita memahami bagaimana perilaku larutan dalam kehidupan sehari-hari. Topik ini meliputi penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik. Kita akan mempelajari faktor-faktor yang mempengaruhi sifat koligatif, seperti konsentrasi larutan, jenis zat terlarut, dan suhu. Dengan memahami konsep ini, kita dapat menjelaskan berbagai fenomena, seperti mengapa air laut membeku pada suhu yang lebih rendah daripada air tawar, atau bagaimana infus dapat membantu pasien mendapatkan nutrisi.
Pengertian Sifat Koligatif Larutan Elektrolit
Sifat koligatif larutan adalah sifat yang bergantung pada jumlah partikel zat terlarut dalam suatu larutan, dan tidak bergantung pada jenis zat terlarut itu sendiri. Sifat ini dapat diamati pada larutan elektrolit maupun larutan non-elektrolit, tetapi terdapat perbedaan penting antara keduanya.
Perbedaan Sifat Koligatif Larutan Elektrolit dan Non-Elektrolit
Perbedaan utama antara sifat koligatif larutan elektrolit dan non-elektrolit terletak pada jumlah partikel zat terlarut yang dihasilkan dalam larutan. Larutan elektrolit, seperti garam (NaCl) atau asam kuat (HCl), terionisasi dalam air, menghasilkan ion-ion yang merupakan partikel terlarut. Sementara itu, larutan non-elektrolit, seperti gula (C12H22O11), tidak terionisasi dalam air, sehingga hanya molekul utuh yang bertindak sebagai partikel terlarut.
Oleh karena itu, larutan elektrolit memiliki jumlah partikel terlarut yang lebih banyak dibandingkan dengan larutan non-elektrolit dengan konsentrasi yang sama. Hal ini menyebabkan efek yang lebih besar pada sifat koligatif larutan elektrolit. Sebagai contoh, penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik akan lebih besar pada larutan elektrolit dibandingkan dengan larutan non-elektrolit dengan konsentrasi yang sama.
Contoh Soal dan Pembahasan
Misalnya, jika kita membandingkan larutan 0,1 M NaCl dan 0,1 M glukosa, larutan NaCl akan memiliki titik didih yang lebih tinggi dibandingkan dengan larutan glukosa. Hal ini karena NaCl terionisasi menjadi ion Na+ dan Cl–, sehingga jumlah partikel terlarut dalam larutan NaCl lebih banyak dibandingkan dengan larutan glukosa.
Berikut adalah contoh soal dan pembahasan tentang sifat koligatif larutan elektrolit:
Suatu larutan elektrolit 0,1 M memiliki titik didih 100,5 °C. Jika diketahui Kb air = 0,52 °C/m, tentukan faktor van’t Hoff (i) larutan tersebut!
Berikut adalah langkah-langkah untuk menyelesaikan soal tersebut:
- Menentukan kenaikan titik didih (ΔTb): ΔTb = Tb – Tbo = 100,5 °C – 100 °C = 0,5 °C
- Menentukan molalitas (m) larutan: m = ΔTb / Kb = 0,5 °C / 0,52 °C/m = 0,96 m
- Menentukan faktor van’t Hoff (i): i = ΔTb / (Kb x m) = 0,5 °C / (0,52 °C/m x 0,96 m) = 1,02
Jadi, faktor van’t Hoff (i) larutan elektrolit tersebut adalah 1,02. Hal ini menunjukkan bahwa larutan tersebut terionisasi menjadi 1,02 partikel dalam larutan.
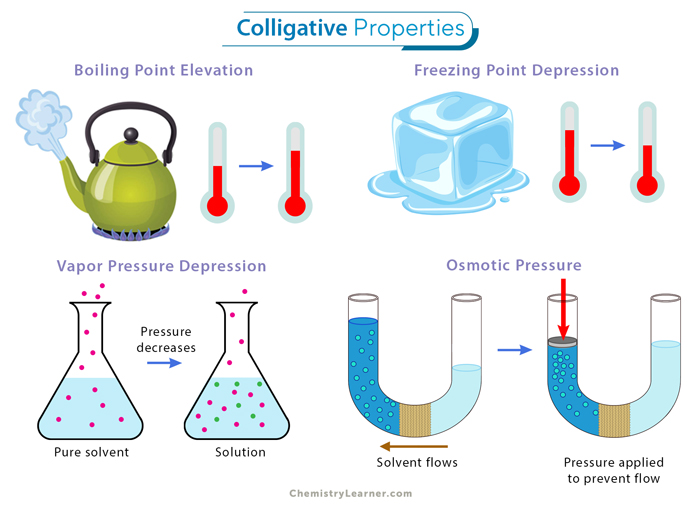
Jenis-Jenis Sifat Koligatif Larutan Elektrolit
Sifat koligatif larutan adalah sifat yang bergantung pada jumlah partikel zat terlarut dalam larutan, bukan pada jenis zat terlarutnya. Pada larutan elektrolit, zat terlarut terionisasi dalam larutan, sehingga jumlah partikel dalam larutan lebih banyak dibandingkan dengan larutan nonelektrolit. Hal ini menyebabkan sifat koligatif larutan elektrolit lebih besar dibandingkan dengan larutan nonelektrolit dengan konsentrasi yang sama.
Jenis-Jenis Sifat Koligatif Larutan Elektrolit
Sifat koligatif larutan elektrolit meliputi:
- Penurunan Tekanan Uap
- Kenaikan Titik Didih
- Penurunan Titik Beku
- Tekanan Osmotik
Penurunan Tekanan Uap
Penurunan tekanan uap adalah penurunan tekanan uap jenuh suatu pelarut akibat penambahan zat terlarut. Pada larutan elektrolit, penurunan tekanan uap lebih besar dibandingkan dengan larutan nonelektrolit dengan konsentrasi yang sama karena jumlah partikel zat terlarut lebih banyak.
Rumus penurunan tekanan uap: ΔP = P° – P = Xt . P°
Keterangan:
- ΔP = penurunan tekanan uap
- P° = tekanan uap pelarut murni
- P = tekanan uap larutan
- Xt = fraksi mol zat terlarut
Untuk larutan elektrolit, rumus tersebut perlu dimodifikasi dengan faktor van’t Hoff (i):
ΔP = i . Xt . P°
Faktor van’t Hoff (i) menunjukkan jumlah ion yang dihasilkan oleh satu molekul zat terlarut dalam larutan. Misalnya, NaCl terionisasi menjadi Na+ dan Cl–, sehingga i = 2.
Contoh Soal
Hitunglah penurunan tekanan uap larutan yang dibuat dengan melarutkan 11,7 gram NaCl (Mr = 58,5) dalam 200 gram air (Mr = 18) pada suhu 25°C. Tekanan uap air murni pada suhu 25°C adalah 23,8 mmHg.
Pembahasan
1. Hitung molalitas larutan:
Molalitas = (massa zat terlarut / Mr zat terlarut) / massa pelarut (kg)
Molalitas = (11,7 g / 58,5 g/mol) / 0,2 kg = 1 mol/kg
2. Hitung faktor van’t Hoff (i) untuk NaCl:
i = 2 (karena NaCl terionisasi menjadi 2 ion)
3. Hitung fraksi mol zat terlarut (Xt):
Xt = mol zat terlarut / (mol zat terlarut + mol pelarut)
Mol pelarut = 200 g / 18 g/mol = 11,11 mol
Xt = 1 mol / (1 mol + 11,11 mol) = 0,083
4. Hitung penurunan tekanan uap:
ΔP = i . Xt . P°
ΔP = 2 . 0,083 . 23,8 mmHg = 3,96 mmHg
Jadi, penurunan tekanan uap larutan NaCl tersebut adalah 3,96 mmHg.
Kenaikan Titik Didih
Kenaikan titik didih adalah kenaikan titik didih suatu pelarut akibat penambahan zat terlarut. Pada larutan elektrolit, kenaikan titik didih lebih besar dibandingkan dengan larutan nonelektrolit dengan konsentrasi yang sama karena jumlah partikel zat terlarut lebih banyak.
Rumus kenaikan titik didih: ΔTb = Kb . m . i
Keterangan:
- ΔTb = kenaikan titik didih
- Kb = tetapan kenaikan titik didih molal pelarut
- m = molalitas larutan
- i = faktor van’t Hoff
Contoh Soal
Hitunglah kenaikan titik didih larutan yang dibuat dengan melarutkan 5,85 gram NaCl (Mr = 58,5) dalam 500 gram air (Mr = 18). Kb air = 0,52 °C/m.
Pembahasan
1. Hitung molalitas larutan:
Molalitas = (massa zat terlarut / Mr zat terlarut) / massa pelarut (kg)
Molalitas = (5,85 g / 58,5 g/mol) / 0,5 kg = 0,2 mol/kg
2. Hitung faktor van’t Hoff (i) untuk NaCl:
i = 2 (karena NaCl terionisasi menjadi 2 ion)
3. Hitung kenaikan titik didih:
ΔTb = Kb . m . i
ΔTb = 0,52 °C/m . 0,2 mol/kg . 2 = 0,21 °C
Jadi, kenaikan titik didih larutan NaCl tersebut adalah 0,21 °C.
Penurunan Titik Beku
Penurunan titik beku adalah penurunan titik beku suatu pelarut akibat penambahan zat terlarut. Pada larutan elektrolit, penurunan titik beku lebih besar dibandingkan dengan larutan nonelektrolit dengan konsentrasi yang sama karena jumlah partikel zat terlarut lebih banyak.
Rumus penurunan titik beku: ΔTf = Kf . m . i
Keterangan:
- ΔTf = penurunan titik beku
- Kf = tetapan penurunan titik beku molal pelarut
- m = molalitas larutan
- i = faktor van’t Hoff
Contoh Soal
Hitunglah penurunan titik beku larutan yang dibuat dengan melarutkan 10 gram glukosa (Mr = 180) dalam 250 gram air (Mr = 18). Kf air = 1,86 °C/m.
Pembahasan
1. Hitung molalitas larutan:
Molalitas = (massa zat terlarut / Mr zat terlarut) / massa pelarut (kg)
Molalitas = (10 g / 180 g/mol) / 0,25 kg = 0,22 mol/kg
2. Hitung faktor van’t Hoff (i) untuk glukosa:
i = 1 (karena glukosa tidak terionisasi dalam larutan)
3. Hitung penurunan titik beku:
ΔTf = Kf . m . i
ΔTf = 1,86 °C/m . 0,22 mol/kg . 1 = 0,41 °C
Jadi, penurunan titik beku larutan glukosa tersebut adalah 0,41 °C.
Tekanan Osmotik, Contoh soal sifat koligatif larutan elektrolit
Tekanan osmotik adalah tekanan yang diperlukan untuk menghentikan aliran pelarut melalui membran semipermeabel dari larutan encer ke larutan pekat. Pada larutan elektrolit, tekanan osmotik lebih besar dibandingkan dengan larutan nonelektrolit dengan konsentrasi yang sama karena jumlah partikel zat terlarut lebih banyak.
Rumus tekanan osmotik: π = M . R . T . i
Keterangan:
- π = tekanan osmotik
- M = molaritas larutan
- R = tetapan gas ideal (0,082 L.atm/mol.K)
- T = suhu dalam Kelvin
- i = faktor van’t Hoff
Contoh Soal
Hitunglah tekanan osmotik larutan yang dibuat dengan melarutkan 1,71 gram sukrosa (Mr = 342) dalam 100 mL air (Mr = 18) pada suhu 27°C.
Pembahasan
1. Hitung molaritas larutan:
Molaritas = (massa zat terlarut / Mr zat terlarut) / volume larutan (L)
Molaritas = (1,71 g / 342 g/mol) / 0,1 L = 0,05 mol/L
2. Hitung faktor van’t Hoff (i) untuk sukrosa:
i = 1 (karena sukrosa tidak terionisasi dalam larutan)
3. Hitung tekanan osmotik:
π = M . R . T . i
π = 0,05 mol/L . 0,082 L.atm/mol.K . (27 + 273) K . 1 = 1,3 atm
Jadi, tekanan osmotik larutan sukrosa tersebut adalah 1,3 atm.
Tabel Ringkasan Sifat Koligatif Larutan Elektrolit
| Sifat Koligatif | Rumus | Contoh Aplikasi |
|---|---|---|
| Penurunan Tekanan Uap | ΔP = i . Xt . P° | Pengawetan makanan dengan menambahkan garam atau gula untuk menurunkan tekanan uap air dalam makanan, sehingga bakteri sulit berkembang biak. |
| Kenaikan Titik Didih | ΔTb = Kb . m . i | Pembuatan sirup atau larutan gula dengan titik didih yang lebih tinggi, sehingga lebih tahan lama. |
| Penurunan Titik Beku | ΔTf = Kf . m . i | Pembuatan antibeku untuk mobil dengan menambahkan zat terlarut seperti etilen glikol untuk menurunkan titik beku air, sehingga mesin mobil tidak membeku pada suhu dingin. |
| Tekanan Osmotik | π = M . R . T . i | Proses osmosis pada sel tumbuhan, di mana air masuk ke dalam sel tumbuhan melalui membran sel, sehingga sel tumbuhan menjadi turgid dan tegak. |
Faktor yang Mempengaruhi Sifat Koligatif Larutan Elektrolit
Sifat koligatif larutan elektrolit dipengaruhi oleh beberapa faktor yang memengaruhi perubahan sifat fisik larutan. Faktor-faktor ini berperan penting dalam menentukan seberapa besar perubahan sifat koligatif yang terjadi. Perubahan sifat koligatif ini dapat diukur dan digunakan untuk menentukan sifat larutan, seperti konsentrasi atau massa molar zat terlarut.
Konsentrasi Zat Terlarut
Konsentrasi zat terlarut merupakan faktor utama yang memengaruhi sifat koligatif larutan elektrolit. Semakin tinggi konsentrasi zat terlarut, semakin besar perubahan sifat koligatif yang terjadi. Hal ini karena semakin banyak partikel zat terlarut yang terlarut dalam pelarut, semakin banyak pula interaksi antara partikel zat terlarut dan pelarut, sehingga menyebabkan perubahan sifat koligatif yang lebih besar.
- Contohnya, semakin tinggi konsentrasi larutan NaCl, semakin tinggi pula titik didih larutan tersebut.
- Sebagai ilustrasi, jika kita membandingkan larutan NaCl 0,1 M dengan larutan NaCl 0,5 M, larutan NaCl 0,5 M akan memiliki titik didih yang lebih tinggi karena konsentrasi zat terlarutnya lebih tinggi.
Jenis Zat Terlarut
Jenis zat terlarut juga memengaruhi sifat koligatif larutan elektrolit. Zat terlarut yang bersifat elektrolit kuat akan menghasilkan lebih banyak ion dalam larutan dibandingkan dengan zat terlarut yang bersifat elektrolit lemah. Hal ini karena zat terlarut elektrolit kuat terionisasi sempurna dalam larutan, sedangkan zat terlarut elektrolit lemah hanya terionisasi sebagian.
- Sebagai contoh, larutan NaCl (elektrolit kuat) akan memiliki titik didih yang lebih tinggi dibandingkan dengan larutan glukosa (non-elektrolit) dengan konsentrasi yang sama.
- Ini karena NaCl terionisasi sempurna menjadi ion Na+ dan Cl-, sehingga menghasilkan lebih banyak partikel dalam larutan dibandingkan dengan glukosa yang tidak terionisasi.
Suhu
Suhu juga memengaruhi sifat koligatif larutan elektrolit. Semakin tinggi suhu, semakin besar perubahan sifat koligatif yang terjadi. Hal ini karena pada suhu yang lebih tinggi, partikel-partikel dalam larutan bergerak lebih cepat dan memiliki energi kinetik yang lebih tinggi, sehingga interaksi antara partikel-partikel tersebut semakin kuat.
- Sebagai contoh, titik didih larutan NaCl akan lebih tinggi pada suhu 100 °C dibandingkan dengan pada suhu 25 °C.
- Ini karena pada suhu yang lebih tinggi, energi kinetik partikel-partikel dalam larutan lebih tinggi, sehingga lebih sulit untuk menguapkan pelarut dan menyebabkan titik didih yang lebih tinggi.
Diagram Hubungan Faktor dan Sifat Koligatif
Berikut adalah diagram yang menunjukkan hubungan antara faktor-faktor yang memengaruhi sifat koligatif larutan elektrolit dan nilai sifat koligatif:
| Faktor | Pengaruh terhadap Sifat Koligatif |
|---|---|
| Konsentrasi Zat Terlarut | Semakin tinggi konsentrasi, semakin besar perubahan sifat koligatif. |
| Jenis Zat Terlarut | Elektrolit kuat menghasilkan perubahan sifat koligatif yang lebih besar dibandingkan dengan elektrolit lemah. |
| Suhu | Semakin tinggi suhu, semakin besar perubahan sifat koligatif. |
Soal Latihan Sifat Koligatif Larutan Elektrolit
Sifat koligatif larutan merupakan sifat yang bergantung pada jumlah partikel zat terlarut dalam larutan, bukan pada jenis zat terlarutnya. Pada larutan elektrolit, zat terlarut akan terionisasi dalam larutan sehingga jumlah partikel zat terlarut akan meningkat, dan hal ini akan mempengaruhi nilai sifat koligatif larutan.
Berikut ini adalah beberapa soal latihan tentang sifat koligatif larutan elektrolit yang dapat membantu kamu memahami konsep ini lebih dalam.
Soal Latihan Sifat Koligatif Larutan Elektrolit
Soal latihan ini mencakup berbagai tingkat kesulitan, mulai dari soal dasar hingga soal yang lebih menantang. Setiap soal dilengkapi dengan kunci jawaban dan pembahasan yang detail, sehingga kamu dapat memeriksa jawabanmu dan memahami konsep yang terkait dengan soal tersebut.
| Soal | Kunci Jawaban | Pembahasan |
|---|---|---|
| 1. Hitunglah penurunan tekanan uap jenuh larutan yang dibuat dengan melarutkan 17,1 gram gula (Mr = 342) dalam 500 gram air pada suhu 25°C. Tekanan uap jenuh air pada suhu tersebut adalah 23,8 mmHg. | 0,95 mmHg | Penurunan tekanan uap jenuh larutan dapat dihitung dengan menggunakan rumus: $$\Delta P = P^o – P$$ Dimana: * $\Delta P$ adalah penurunan tekanan uap jenuh larutan * $P^o$ adalah tekanan uap jenuh pelarut murni * $P$ adalah tekanan uap jenuh larutan Dalam soal ini, $P^o$ = 23,8 mmHg. Untuk menghitung $P$, kita perlu mengetahui fraksi mol gula dalam larutan. Fraksi mol gula dapat dihitung dengan menggunakan rumus: $$X_gula = \fracn_gulan_gula + n_air$$ Dimana: * $X_gula$ adalah fraksi mol gula * $n_gula$ adalah jumlah mol gula * $n_air$ adalah jumlah mol air Jumlah mol gula dapat dihitung dengan membagi massa gula dengan Mr gula: $$n_gula = \frac17,1 \text gram342 \text gram/mol = 0,05 \text mol$$ Jumlah mol air dapat dihitung dengan membagi massa air dengan Mr air: $$n_air = \frac500 \text gram18 \text gram/mol = 27,78 \text mol$$ Sehingga fraksi mol gula adalah: $$X_gula = \frac0,05 \text mol0,05 \text mol + 27,78 \text mol = 0,0018$$ Tekanan uap jenuh larutan dapat dihitung dengan menggunakan hukum Raoult: $$P = X_air \times P^o$$ Dimana: * $X_air$ adalah fraksi mol air * $P^o$ adalah tekanan uap jenuh pelarut murni Fraksi mol air dapat dihitung dengan menggunakan rumus: $$X_air = 1 – X_gula = 1 – 0,0018 = 0,9982$$ Sehingga tekanan uap jenuh larutan adalah: $$P = 0,9982 \times 23,8 \text mmHg = 23,76 \text mmHg$$ Penurunan tekanan uap jenuh larutan adalah: $$\Delta P = 23,8 \text mmHg – 23,76 \text mmHg = 0,04 \text mmHg$$ Jadi, penurunan tekanan uap jenuh larutan yang dibuat dengan melarutkan 17,1 gram gula (Mr = 342) dalam 500 gram air pada suhu 25°C adalah 0,04 mmHg. |
| 2. Hitunglah titik didih larutan yang dibuat dengan melarutkan 11,7 gram NaCl (Mr = 58,5) dalam 250 gram air. Kenaikan titik didih molal air adalah 0,52 °C/m. | 100,21 °C | Titik didih larutan dapat dihitung dengan menggunakan rumus: $$\Delta T_b = K_b \times m \times i$$ Dimana: * $\Delta T_b$ adalah kenaikan titik didih larutan * $K_b$ adalah kenaikan titik didih molal pelarut * $m$ adalah molalitas larutan * $i$ adalah faktor van’t Hoff Dalam soal ini, $K_b$ = 0,52 °C/m. Untuk menghitung $m$, kita perlu mengetahui jumlah mol NaCl dan massa air dalam kg. Jumlah mol NaCl dapat dihitung dengan membagi massa NaCl dengan Mr NaCl: $$n_NaCl = \frac11,7 \text gram58,5 \text gram/mol = 0,2 \text mol$$ Massa air dalam kg adalah 0,25 kg. Molalitas larutan dapat dihitung dengan menggunakan rumus: $$m = \fracn_NaClm_air = \frac0,2 \text mol0,25 \text kg = 0,8 \text mol/kg$$ Faktor van’t Hoff untuk NaCl adalah 2, karena NaCl terionisasi menjadi 2 ion dalam larutan: $$NaCl(aq) \rightleftharpoons Na^+(aq) + Cl^-(aq)$$ Sehingga kenaikan titik didih larutan adalah: $$\Delta T_b = 0,52 \text °C/m \times 0,8 \text mol/kg \times 2 = 0,832 \text °C$$ Titik didih larutan adalah: $$T_b = T_b^o + \Delta T_b = 100 \text °C + 0,832 \text °C = 100,832 \text °C$$ Jadi, titik didih larutan yang dibuat dengan melarutkan 11,7 gram NaCl (Mr = 58,5) dalam 250 gram air adalah 100,832 °C. |
| 3. Hitunglah tekanan osmotik larutan yang dibuat dengan melarutkan 5,85 gram NaCl (Mr = 58,5) dalam 250 mL air pada suhu 27°C. | 5,44 atm | Tekanan osmotik larutan dapat dihitung dengan menggunakan rumus: $$\pi = M \times R \times T \times i$$ Dimana: * $\pi$ adalah tekanan osmotik larutan * $M$ adalah molaritas larutan * $R$ adalah tetapan gas ideal (0,082 L atm/mol K) * $T$ adalah suhu dalam Kelvin * $i$ adalah faktor van’t Hoff Dalam soal ini, $T$ = 27°C + 273 = 300 K. Untuk menghitung $M$, kita perlu mengetahui jumlah mol NaCl dan volume larutan dalam liter. Jumlah mol NaCl dapat dihitung dengan membagi massa NaCl dengan Mr NaCl: $$n_NaCl = \frac5,85 \text gram58,5 \text gram/mol = 0,1 \text mol$$ Volume larutan dalam liter adalah 0,25 L. Molaritas larutan dapat dihitung dengan menggunakan rumus: $$M = \fracn_NaClV_larutan = \frac0,1 \text mol0,25 \text L = 0,4 \text mol/L$$ Faktor van’t Hoff untuk NaCl adalah 2, karena NaCl terionisasi menjadi 2 ion dalam larutan: $$NaCl(aq) \rightleftharpoons Na^+(aq) + Cl^-(aq)$$ Sehingga tekanan osmotik larutan adalah: $$\pi = 0,4 \text mol/L \times 0,082 \text L atm/mol K \times 300 \text K \times 2 = 19,68 \text atm$$ Jadi, tekanan osmotik larutan yang dibuat dengan melarutkan 5,85 gram NaCl (Mr = 58,5) dalam 250 mL air pada suhu 27°C adalah 19,68 atm. |
| 4. Hitunglah titik beku larutan yang dibuat dengan melarutkan 34,2 gram sukrosa (Mr = 342) dalam 500 gram air. Penurunan titik beku molal air adalah 1,86 °C/m. | -0,19 °C | Titik beku larutan dapat dihitung dengan menggunakan rumus: $$\Delta T_f = K_f \times m \times i$$ Dimana: * $\Delta T_f$ adalah penurunan titik beku larutan * $K_f$ adalah penurunan titik beku molal pelarut * $m$ adalah molalitas larutan * $i$ adalah faktor van’t Hoff Dalam soal ini, $K_f$ = 1,86 °C/m. Untuk menghitung $m$, kita perlu mengetahui jumlah mol sukrosa dan massa air dalam kg. Jumlah mol sukrosa dapat dihitung dengan membagi massa sukrosa dengan Mr sukrosa: $$n_sukrosa = \frac34,2 \text gram342 \text gram/mol = 0,1 \text mol$$ Massa air dalam kg adalah 0,5 kg. Molalitas larutan dapat dihitung dengan menggunakan rumus: $$m = \fracn_sukrosam_air = \frac0,1 \text mol0,5 \text kg = 0,2 \text mol/kg$$ Faktor van’t Hoff untuk sukrosa adalah 1, karena sukrosa tidak terionisasi dalam larutan. Sehingga penurunan titik beku larutan adalah: $$\Delta T_f = 1,86 \text °C/m \times 0,2 \text mol/kg \times 1 = 0,372 \text °C$$ Titik beku larutan adalah: $$T_f = T_f^o – \Delta T_f = 0 \text °C – 0,372 \text °C = -0,372 \text °C$$ Jadi, titik beku larutan yang dibuat dengan melarutkan 34,2 gram sukrosa (Mr = 342) dalam 500 gram air adalah -0,372 °C. |
| 5. Larutan glukosa (Mr = 180) dengan konsentrasi 0,1 M memiliki tekanan osmotik 2,46 atm pada suhu 27°C. Hitunglah derajat ionisasi larutan glukosa. | 0 | Derajat ionisasi larutan glukosa dapat dihitung dengan menggunakan rumus: $$\alpha = \fraci – 1n – 1$$ Dimana: * $\alpha$ adalah derajat ionisasi * $i$ adalah faktor van’t Hoff * $n$ adalah jumlah ion yang dihasilkan dari satu molekul zat terlarut Faktor van’t Hoff dapat dihitung dengan menggunakan rumus: $$i = \frac\piM \times R \times T$$ Dimana: * $\pi$ adalah tekanan osmotik larutan * $M$ adalah molaritas larutan * $R$ adalah tetapan gas ideal (0,082 L atm/mol K) * $T$ adalah suhu dalam Kelvin Dalam soal ini, $\pi$ = 2,46 atm, $M$ = 0,1 M, $T$ = 27°C + 273 = 300 K. Sehingga faktor van’t Hoff adalah: $$i = \frac2,46 \text atm0,1 \text mol/L \times 0,082 \text L atm/mol K \times 300 \text K = 1$$ Glukosa tidak terionisasi dalam larutan, sehingga $n$ = 1. Derajat ionisasi larutan glukosa adalah: $$\alpha = \frac1 – 11 – 1 = 0$$ Jadi, derajat ionisasi larutan glukosa adalah 0. |
Penjelasan tentang Faktor van’t Hoff
Sifat koligatif larutan elektrolit, seperti penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik, dipengaruhi oleh jumlah partikel zat terlarut dalam larutan. Namun, larutan elektrolit memiliki keunikan karena terurai menjadi ion-ion dalam larutan, sehingga jumlah partikel yang sebenarnya dalam larutan lebih banyak dibandingkan dengan larutan nonelektrolit dengan konsentrasi yang sama. Faktor van’t Hoff (i) digunakan untuk memperhitungkan jumlah ion yang dihasilkan oleh larutan elektrolit, sehingga memungkinkan kita untuk menghitung sifat koligatif larutan elektrolit secara akurat.
Pengertian Faktor van’t Hoff (i)
Faktor van’t Hoff (i) adalah faktor koreksi yang menyatakan rasio jumlah partikel zat terlarut yang sebenarnya dalam larutan dengan jumlah partikel zat terlarut yang ditambahkan ke dalam larutan. Faktor ini menunjukkan derajat ionisasi atau disosiasi larutan elektrolit. Semakin besar nilai i, semakin banyak ion yang dihasilkan dalam larutan dan semakin besar pengaruhnya terhadap sifat koligatif.
Contoh Soal dan Pembahasan tentang Perhitungan Faktor van’t Hoff untuk Larutan Elektrolit
Misalnya, larutan NaCl dengan konsentrasi 0,1 M. NaCl terurai menjadi ion Na+ dan ion Cl- dalam larutan. Jika asumsi derajat disosiasi NaCl adalah 100%, maka 1 mol NaCl akan terurai menjadi 1 mol Na+ dan 1 mol Cl-, sehingga total jumlah ion dalam larutan adalah 2 mol. Faktor van’t Hoff (i) untuk NaCl dalam kasus ini adalah 2, karena jumlah partikel yang sebenarnya dalam larutan (2 mol) adalah dua kali lipat dari jumlah partikel yang ditambahkan (1 mol).
i = (jumlah partikel yang sebenarnya dalam larutan) / (jumlah partikel yang ditambahkan)
Perhitungan faktor van’t Hoff (i) dapat dilakukan dengan menggunakan rumus:
i = 1 + α(n-1)
Dimana:
- α adalah derajat disosiasi
- n adalah jumlah ion yang dihasilkan dari satu molekul zat terlarut
Tabel Contoh Larutan Elektrolit, Nilai Faktor van’t Hoff, dan Jumlah Ion yang Dihasilkan dalam Larutan
| Larutan Elektrolit | Nilai Faktor van’t Hoff (i) | Jumlah Ion yang Dihasilkan |
|---|---|---|
| NaCl | 2 | Na+ dan Cl- |
| KCl | 2 | K+ dan Cl- |
| CaCl2 | 3 | Ca2+ dan 2Cl- |
| AlCl3 | 4 | Al3+ dan 3Cl- |
| MgSO4 | 2 | Mg2+ dan SO42- |
Perbedaan Sifat Koligatif Larutan Elektrolit dan Non-Elektrolit
Sifat koligatif larutan adalah sifat yang bergantung pada jumlah partikel zat terlarut dalam larutan, bukan pada jenis zat terlarutnya. Larutan elektrolit dan non-elektrolit memiliki perbedaan dalam sifat koligatifnya karena perbedaan dalam jumlah partikel yang dihasilkan saat dilarutkan dalam air.
Perbedaan Sifat Koligatif Larutan Elektrolit dan Non-Elektrolit
Perbedaan utama antara larutan elektrolit dan non-elektrolit terletak pada kemampuannya menghantarkan arus listrik. Larutan elektrolit dapat menghantarkan arus listrik karena terurai menjadi ion-ion dalam larutan, sedangkan larutan non-elektrolit tidak terurai menjadi ion sehingga tidak dapat menghantarkan arus listrik.
- Larutan elektrolit adalah larutan yang mengandung zat terlarut yang terurai menjadi ion-ion dalam larutan. Ion-ion ini dapat bergerak bebas dalam larutan dan dapat menghantarkan arus listrik. Contoh larutan elektrolit adalah larutan garam (NaCl), asam kuat (HCl), dan basa kuat (NaOH).
- Larutan non-elektrolit adalah larutan yang mengandung zat terlarut yang tidak terurai menjadi ion-ion dalam larutan. Zat terlarut ini tetap dalam bentuk molekul utuh dan tidak dapat menghantarkan arus listrik. Contoh larutan non-elektrolit adalah larutan gula (C12H22O11) dan alkohol (C2H5OH).
Perbedaan ini juga memengaruhi nilai sifat koligatif larutan. Larutan elektrolit memiliki nilai sifat koligatif yang lebih tinggi dibandingkan dengan larutan non-elektrolit pada konsentrasi yang sama. Hal ini karena larutan elektrolit menghasilkan lebih banyak partikel terlarut dalam larutan, sehingga meningkatkan efek sifat koligatif.
Contoh Soal dan Pembahasan
Berikut ini adalah contoh soal dan pembahasan tentang perhitungan sifat koligatif larutan elektrolit dan non-elektrolit.
Suatu larutan 0,1 molal glukosa (C6H12O6) dan larutan 0,1 molal NaCl memiliki titik beku yang berbeda. Jelaskan perbedaan titik beku kedua larutan tersebut!
Pembahasan:
- Glukosa (C6H12O6) adalah zat non-elektrolit, artinya tidak terurai menjadi ion dalam larutan. Sehingga, 1 mol glukosa akan menghasilkan 1 mol partikel terlarut dalam larutan.
- NaCl adalah zat elektrolit, artinya terurai menjadi ion-ion dalam larutan. 1 mol NaCl akan terurai menjadi 1 mol Na+ dan 1 mol Cl–, sehingga menghasilkan 2 mol partikel terlarut dalam larutan.
- Karena NaCl menghasilkan lebih banyak partikel terlarut dibandingkan glukosa pada konsentrasi yang sama, maka penurunan titik beku larutan NaCl akan lebih besar dibandingkan dengan larutan glukosa.
Perbedaan titik beku kedua larutan tersebut dapat dihitung menggunakan rumus:
ΔTf = Kf x m x i
Dimana:
- ΔTf adalah penurunan titik beku
- Kf adalah tetapan penurunan titik beku molal
- m adalah molalitas larutan
- i adalah faktor van’t Hoff
Faktor van’t Hoff (i) menunjukkan jumlah ion yang dihasilkan dari 1 mol zat terlarut dalam larutan. Untuk glukosa, i = 1, sedangkan untuk NaCl, i = 2.
Dari rumus tersebut, terlihat bahwa penurunan titik beku (ΔTf) berbanding lurus dengan faktor van’t Hoff (i). Karena NaCl memiliki faktor van’t Hoff yang lebih besar dibandingkan glukosa, maka penurunan titik beku larutan NaCl akan lebih besar dibandingkan dengan larutan glukosa.
Diagram Perbedaan Nilai Sifat Koligatif
Berikut ini adalah diagram yang menunjukkan perbedaan nilai sifat koligatif larutan elektrolit dan non-elektrolit pada konsentrasi yang sama.
| Sifat Koligatif | Larutan Non-Elektrolit | Larutan Elektrolit |
|---|---|---|
| Penurunan Titik Beku (ΔTf) | Lebih rendah | Lebih tinggi |
| Kenaikan Titik Didih (ΔTb) | Lebih rendah | Lebih tinggi |
| Tekanan Osmotik (π) | Lebih rendah | Lebih tinggi |
Diagram ini menunjukkan bahwa nilai sifat koligatif larutan elektrolit selalu lebih tinggi dibandingkan dengan larutan non-elektrolit pada konsentrasi yang sama. Hal ini disebabkan oleh jumlah partikel terlarut yang lebih banyak dalam larutan elektrolit.
Penerapan Sifat Koligatif Larutan Elektrolit dalam Bidang Industri
Sifat koligatif larutan, khususnya larutan elektrolit, memiliki peran penting dalam berbagai industri. Larutan elektrolit, yang mengandung ion-ion yang dapat menghantarkan arus listrik, memiliki sifat unik yang dapat dimanfaatkan untuk berbagai proses industri. Penerapannya dapat kita temukan dalam berbagai bidang, seperti pembuatan baterai, pembuatan sabun, dan proses elektrokimia.
Contoh soal sifat koligatif larutan elektrolit biasanya membahas tentang penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmosis. Konsep-konsep ini penting untuk dipahami, terutama bagi kamu yang ingin menguasai kimia. Nah, buat kamu yang ingin mencoba soal-soal sejenis yang lebih menantang, bisa nih dicoba contoh soal Cambridge Test yang bisa kamu temukan di situs web tersebut.
Dengan latihan yang cukup, kamu akan lebih percaya diri dalam menghadapi soal-soal sifat koligatif larutan elektrolit, baik di ujian sekolah maupun di tingkat yang lebih tinggi.
Pembuatan Baterai
Baterai merupakan perangkat yang mengubah energi kimia menjadi energi listrik. Prinsip kerja baterai didasarkan pada reaksi redoks yang melibatkan perpindahan elektron antara dua elektroda yang terendam dalam larutan elektrolit. Larutan elektrolit berperan penting dalam menghantarkan arus listrik antara kedua elektroda.
- Contohnya, pada baterai asam timbal, larutan elektrolit yang digunakan adalah asam sulfat (H2SO4). Asam sulfat terionisasi menjadi ion H+ dan SO42-, yang berperan dalam menghantarkan arus listrik.
- Dalam baterai lithium-ion, larutan elektrolit biasanya berupa garam lithium terlarut dalam pelarut organik. Larutan elektrolit ini memungkinkan pergerakan ion lithium antara anoda dan katoda, sehingga menghasilkan arus listrik.
Pembuatan Sabun
Sabun merupakan surfaktan yang terbuat dari garam asam lemak. Pembuatan sabun melibatkan reaksi saponifikasi, yaitu reaksi antara lemak atau minyak dengan basa kuat, seperti NaOH atau KOH. Larutan elektrolit berperan dalam proses saponifikasi, yaitu sebagai media reaksi dan juga membantu dalam pemisahan sabun dari gliserol.
- Larutan elektrolit yang digunakan dalam pembuatan sabun biasanya berupa larutan NaOH atau KOH. Larutan ini bersifat basa dan membantu dalam memecah ikatan ester dalam lemak atau minyak, menghasilkan asam lemak dan gliserol.
- Setelah reaksi saponifikasi selesai, sabun yang terbentuk akan mengendap di dasar wadah. Larutan elektrolit yang digunakan akan membantu dalam memisahkan sabun dari gliserol.
Proses Elektrokimia
Proses elektrokimia merupakan proses yang melibatkan reaksi kimia dan aliran listrik. Penerapan sifat koligatif larutan elektrolit dalam proses elektrokimia sangat luas, contohnya dalam proses elektroplating, elektrolisis, dan sel bahan bakar.
- Dalam proses elektroplating, larutan elektrolit digunakan sebagai media untuk melapisi permukaan logam dengan logam lain. Contohnya, dalam proses pelapisan emas, larutan elektrolit yang digunakan adalah larutan garam emas (AuCl3).
- Elektrolisis merupakan proses penguraian senyawa kimia menjadi unsur-unsur penyusunnya dengan menggunakan arus listrik. Larutan elektrolit berperan sebagai media untuk menghantarkan arus listrik dan menyediakan ion-ion yang terlibat dalam reaksi elektrokimia.
- Sel bahan bakar merupakan perangkat yang mengubah energi kimia dari bahan bakar menjadi energi listrik melalui reaksi elektrokimia. Larutan elektrolit berperan sebagai media untuk menghantarkan ion antara anoda dan katoda, sehingga menghasilkan arus listrik.
Penerapan sifat koligatif larutan elektrolit dalam industri memiliki dampak positif dan negatif. Dampak positifnya, sifat koligatif larutan elektrolit memungkinkan berbagai proses industri yang efisien dan efektif. Namun, penggunaan larutan elektrolit juga dapat menimbulkan dampak negatif, seperti pencemaran lingkungan jika tidak dikelola dengan baik.
Perhitungan Sifat Koligatif Larutan Elektrolit
Sifat koligatif larutan merupakan sifat yang bergantung pada jumlah partikel zat terlarut dalam larutan, bukan jenis zat terlarutnya. Pada larutan elektrolit, zat terlarut terionisasi dalam larutan, sehingga jumlah partikel dalam larutan lebih banyak dibandingkan dengan larutan non-elektrolit. Hal ini menyebabkan nilai sifat koligatif larutan elektrolit lebih besar daripada larutan non-elektrolit dengan konsentrasi yang sama.
Perhitungan Sifat Koligatif Larutan Elektrolit Menggunakan Faktor van’t Hoff
Untuk menghitung sifat koligatif larutan elektrolit, perlu mempertimbangkan faktor van’t Hoff (i). Faktor van’t Hoff menunjukkan jumlah ion yang dihasilkan dari satu molekul zat terlarut ketika terlarut dalam air. Misalnya, NaCl terionisasi menjadi Na+ dan Cl-, sehingga faktor van’t Hoff (i) untuk NaCl adalah 2. Untuk menghitung sifat koligatif larutan elektrolit, rumusnya adalah:
ΔT = i x K x m
Dimana:
- ΔT adalah perubahan suhu (penurunan titik beku, kenaikan titik didih, atau penurunan tekanan uap)
- i adalah faktor van’t Hoff
- K adalah konstanta krioskopis atau ebullioskopis
- m adalah molalitas larutan
Contoh Soal dan Pembahasan Perhitungan Sifat Koligatif Larutan Elektrolit
Berikut adalah contoh soal dan pembahasan perhitungan sifat koligatif larutan elektrolit:
Sebuah larutan dibuat dengan melarutkan 5,85 gram NaCl (Mr = 58,5 g/mol) dalam 500 gram air. Jika Kf air = 1,86 °C/m, hitunglah penurunan titik beku larutan tersebut!
Berikut langkah-langkah penyelesaiannya:
- Hitung molalitas larutan NaCl:
- mol NaCl = massa NaCl / Mr NaCl = 5,85 g / 58,5 g/mol = 0,1 mol
- molalitas = mol NaCl / massa air (kg) = 0,1 mol / 0,5 kg = 0,2 molal
- Tentukan faktor van’t Hoff (i) untuk NaCl:
- NaCl terionisasi menjadi Na+ dan Cl-, sehingga i = 2
- Hitung penurunan titik beku (ΔTf) larutan NaCl:
- ΔTf = i x Kf x m = 2 x 1,86 °C/m x 0,2 molal = 0,744 °C
- Penambahan garam pada air saat memasak dapat meningkatkan titik didih air. Hal ini disebabkan karena garam terionisasi menjadi ion-ion yang meningkatkan jumlah partikel terlarut dalam air, sehingga titik didih air menjadi lebih tinggi.
- Penambahan garam pada es dapat menurunkan titik beku es. Prinsip ini diterapkan pada pembuatan es krim dan makanan beku lainnya. Garam membantu menurunkan titik beku es, sehingga campuran dapat dibekukan pada suhu yang lebih rendah.
- Penambahan cairan pendingin (antifreeze) ke dalam radiator mobil dapat mencegah air dalam radiator membeku pada suhu rendah. Cairan pendingin ini mengandung zat terlarut yang menurunkan titik beku air, sehingga air tidak membeku pada suhu rendah dan dapat tetap mengalir dalam sistem pendingin mobil.
- Pembuatan larutan infus untuk pasien di rumah sakit. Larutan infus mengandung elektrolit yang diperlukan oleh tubuh, seperti natrium, kalium, dan klorida. Jumlah dan konsentrasi elektrolit dalam larutan infus harus disesuaikan dengan kebutuhan pasien.
- Pembuatan baterai. Baterai merupakan alat yang mengubah energi kimia menjadi energi listrik. Elektrolit dalam baterai berperan penting dalam proses reaksi kimia yang menghasilkan arus listrik.
- Pengolahan air minum. Sifat koligatif larutan elektrolit dapat digunakan untuk mengolah air minum. Misalnya, proses osmosis balik (reverse osmosis) dapat digunakan untuk menghilangkan garam dan kotoran lainnya dari air minum.
Jadi, penurunan titik beku larutan NaCl tersebut adalah 0,744 °C.
Langkah-langkah Perhitungan Sifat Koligatif Larutan Elektrolit dalam Bentuk Flowchart
Berikut adalah flowchart yang menunjukkan langkah-langkah perhitungan sifat koligatif larutan elektrolit:
| Langkah | Keterangan |
|---|---|
| 1 | Hitung molalitas larutan |
| 2 | Tentukan faktor van’t Hoff (i) untuk zat terlarut |
| 3 | Hitung perubahan suhu (ΔT) menggunakan rumus ΔT = i x K x m |
Pentingnya Memahaman Sifat Koligatif Larutan Elektrolit
Sifat koligatif larutan merupakan sifat yang bergantung pada jumlah partikel zat terlarut dalam suatu larutan, bukan pada jenis zat terlarutnya. Larutan elektrolit adalah larutan yang mengandung zat terlarut yang dapat terionisasi dalam pelarut, menghasilkan ion-ion bermuatan listrik. Memahami sifat koligatif larutan elektrolit sangat penting dalam berbagai bidang, mulai dari kehidupan sehari-hari hingga industri.
Penerapan Sifat Koligatif Larutan Elektrolit dalam Kehidupan Sehari-hari
Sifat koligatif larutan elektrolit memiliki peran penting dalam berbagai aspek kehidupan sehari-hari. Berikut beberapa contohnya:
Penerapan Sifat Koligatif Larutan Elektrolit dalam Industri
Sifat koligatif larutan elektrolit memiliki peran penting dalam berbagai proses industri. Berikut beberapa contohnya:
Pentingnya Memahami Sifat Koligatif Larutan Elektrolit dalam Pembelajaran Kimia
Memahami sifat koligatif larutan elektrolit merupakan bagian penting dalam pembelajaran kimia. Hal ini membantu kita untuk memahami bagaimana zat terlarut memengaruhi sifat fisik larutan dan bagaimana sifat-sifat tersebut dapat diaplikasikan dalam berbagai bidang.
Penutupan: Contoh Soal Sifat Koligatif Larutan Elektrolit
Memahami sifat koligatif larutan elektrolit membuka cakrawala baru dalam memahami dunia kimia. Dengan menguasai konsep ini, kita dapat menjelajahi berbagai fenomena menarik, mulai dari proses pembuatan es krim hingga aplikasi penting dalam bidang industri. Sifat koligatif larutan elektrolit menunjukkan bahwa kimia tidak hanya terbatas pada teori, tetapi juga memiliki peran penting dalam kehidupan sehari-hari dan perkembangan teknologi.





