Pernahkah Anda bertanya-tanya bagaimana atom, partikel terkecil penyusun materi, sebenarnya tersusun? Atom, yang sering digambarkan sebagai ‘matahari mini’ dengan elektron mengelilinginya, menyimpan banyak misteri. Contoh Soal Struktur Atom Beserta Jawabannya akan mengajak Anda menjelajahi dunia atom, mengungkap struktur dan sifat-sifatnya melalui serangkaian pertanyaan dan jawaban yang menarik.
Dari model atom Dalton yang sederhana hingga model atom Bohr yang lebih kompleks, kita akan mempelajari bagaimana pemahaman kita tentang atom berkembang seiring waktu. Anda akan memahami konsep penting seperti nomor atom, nomor massa, dan konfigurasi elektron, serta bagaimana konsep ini diterapkan dalam berbagai bidang seperti kimia, fisika, dan teknologi.
Pengertian Struktur Atom
Atom adalah unit terkecil dari suatu unsur yang masih memiliki sifat kimiawi unsur tersebut. Struktur atom menggambarkan susunan partikel-partikel penyusun atom, yang menentukan sifat kimia dan fisika suatu unsur. Bayangkan atom seperti sebuah sistem tata surya mini, dengan inti atom sebagai matahari dan elektron sebagai planet yang mengelilinginya.
Bagian-bagian Utama Atom
Atom terdiri dari tiga bagian utama, yaitu:
- Inti Atom (Nukleus): Inti atom merupakan pusat atom yang mengandung proton dan neutron. Proton bermuatan positif, sedangkan neutron tidak bermuatan. Inti atom memiliki massa yang sangat kecil tetapi mengandung hampir seluruh massa atom.
- Proton: Proton adalah partikel subatomik bermuatan positif yang terdapat di dalam inti atom. Jumlah proton dalam atom menentukan nomor atom suatu unsur, yang menunjukkan identitas unsur tersebut. Misalnya, atom hidrogen memiliki satu proton, atom helium memiliki dua proton, dan seterusnya.
- Neutron: Neutron adalah partikel subatomik netral yang terdapat di dalam inti atom. Neutron tidak memiliki muatan listrik. Jumlah neutron dalam atom dapat bervariasi, yang menghasilkan isotop dari suatu unsur. Isotop adalah atom dari unsur yang sama dengan jumlah proton yang sama, tetapi jumlah neutron yang berbeda. Misalnya, karbon-12 dan karbon-14 adalah isotop karbon. Karbon-12 memiliki 6 proton dan 6 neutron, sedangkan karbon-14 memiliki 6 proton dan 8 neutron.
- Elektron: Elektron adalah partikel subatomik bermuatan negatif yang mengelilingi inti atom dalam orbit tertentu. Elektron memiliki massa yang sangat kecil, jauh lebih kecil daripada proton dan neutron. Elektron bergerak dengan kecepatan tinggi dan membentuk awan elektron di sekitar inti atom. Jumlah elektron dalam atom sama dengan jumlah proton, sehingga atom secara keseluruhan bersifat netral.
Model Atom: Contoh Soal Struktur Atom Beserta Jawabannya
Model atom adalah gambaran tentang struktur atom yang menjelaskan bagaimana atom tersusun dan bagaimana partikel-partikel penyusunnya saling berinteraksi. Model atom telah mengalami berbagai perkembangan seiring dengan kemajuan teknologi dan penemuan-penemuan baru dalam ilmu pengetahuan.
Perkembangan Model Atom
Model atom telah berkembang selama berabad-abad, dimulai dari teori atom yang sederhana hingga model atom yang lebih kompleks dan akurat. Berikut adalah tabel yang merangkum model atom dan penemunya:
| Nama Model Atom | Penemu | Ciri Khas |
|---|---|---|
| Model Atom Dalton | John Dalton (1803) | Atom merupakan bola pejal yang tak terbagi dan memiliki sifat yang sama untuk setiap unsur. |
| Model Atom Thomson | Joseph John Thomson (1897) | Atom merupakan bola bermuatan positif yang di dalamnya tersebar elektron bermuatan negatif. |
| Model Atom Rutherford | Ernest Rutherford (1911) | Atom memiliki inti atom yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif. |
| Model Atom Bohr | Niels Bohr (1913) | Elektron bergerak mengelilingi inti atom pada lintasan tertentu yang disebut kulit elektron. |
Perbedaan Model Atom
Berikut adalah beberapa perbedaan utama antara model atom Dalton, Thomson, Rutherford, dan Bohr:
- Model atom Dalton menganggap atom sebagai bola pejal yang tak terbagi, sedangkan model atom Thomson dan Rutherford menggambarkan atom sebagai struktur yang lebih kompleks dengan inti atom dan elektron.
- Model atom Thomson menempatkan elektron secara acak di dalam bola bermuatan positif, sedangkan model atom Rutherford menempatkan elektron mengelilingi inti atom.
- Model atom Bohr menambahkan konsep kulit elektron, di mana elektron bergerak pada lintasan tertentu di sekitar inti atom.
Perkembangan Model Atom
Perkembangan model atom dapat dijelaskan sebagai berikut:
- Model Atom Dalton (1803): Model ini merupakan model atom yang pertama kali dikemukakan, dan didasarkan pada hukum kekekalan massa dan hukum perbandingan tetap. Model atom Dalton menganggap atom sebagai bola pejal yang tak terbagi dan memiliki sifat yang sama untuk setiap unsur.
- Model Atom Thomson (1897): Model atom Thomson merupakan model atom yang lebih maju dibandingkan dengan model atom Dalton. Model atom Thomson berdasarkan penemuan elektron oleh Thomson. Model atom Thomson menggambarkan atom sebagai bola bermuatan positif yang di dalamnya tersebar elektron bermuatan negatif. Model ini sering disebut sebagai model “plum pudding” karena elektron dianalogikan sebagai kismis yang tersebar dalam adonan roti (plum pudding).
- Model Atom Rutherford (1911): Model atom Rutherford didasarkan pada percobaan hamburan sinar alfa oleh lempeng tipis emas. Model ini menunjukkan bahwa atom memiliki inti atom yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif. Inti atom merupakan bagian terkecil dari atom yang mengandung hampir seluruh massa atom.
- Model Atom Bohr (1913): Model atom Bohr merupakan model atom yang lebih kompleks dibandingkan dengan model atom Rutherford. Model atom Bohr didasarkan pada teori kuantum yang dikemukakan oleh Max Planck. Model atom Bohr menjelaskan bahwa elektron bergerak mengelilingi inti atom pada lintasan tertentu yang disebut kulit elektron. Elektron hanya dapat berpindah dari satu kulit ke kulit lainnya dengan menyerap atau memancarkan energi dalam bentuk foton.
Partikel Penyusun Atom
Atom adalah unit terkecil dari suatu unsur yang masih memiliki sifat kimiawi unsur tersebut. Atom tersusun atas partikel-partikel subatomik yang lebih kecil. Partikel-partikel ini memiliki sifat dan peran yang berbeda dalam menentukan karakteristik atom.
Jenis-Jenis Partikel Penyusun Atom dan Sifatnya, Contoh soal struktur atom beserta jawabannya
Atom terdiri dari tiga jenis partikel subatomik utama: proton, neutron, dan elektron.
- Proton bermuatan positif (+1) dan terletak di inti atom. Proton memiliki massa sekitar 1,6726 × 10-27 kg. Jumlah proton dalam inti atom menentukan nomor atom suatu unsur, yang merupakan identitas unik dari unsur tersebut.
- Neutron tidak bermuatan (netral) dan juga terletak di inti atom. Neutron memiliki massa yang sedikit lebih besar daripada proton, sekitar 1,6749 × 10-27 kg. Neutron berperan dalam menjaga kestabilan inti atom.
- Elektron bermuatan negatif (-1) dan terletak di sekitar inti atom dalam suatu daerah yang disebut kulit elektron. Elektron memiliki massa yang jauh lebih kecil daripada proton dan neutron, sekitar 9,1094 × 10-31 kg. Elektron terlibat dalam pembentukan ikatan kimia dan menentukan sifat kimiawi suatu atom.
Diagram Sederhana Letak Proton, Neutron, dan Elektron dalam Atom
- Gambarlah sebuah lingkaran kecil sebagai inti atom.
- Tuliskan simbol “p” di dalam inti atom untuk mewakili proton.
- Tuliskan simbol “n” di dalam inti atom untuk mewakili neutron.
- Gambarlah beberapa lingkaran yang lebih besar mengelilingi inti atom, mewakili kulit elektron.
- Tuliskan simbol “e” di dalam kulit elektron untuk mewakili elektron.
Contoh Soal Perhitungan Jumlah Proton, Neutron, dan Elektron dalam Atom
- Misalnya, atom karbon (C) memiliki nomor atom 6 dan nomor massa 12.
- Nomor atom menunjukkan jumlah proton dalam inti atom, sehingga atom karbon memiliki 6 proton.
- Nomor massa adalah jumlah proton dan neutron dalam inti atom.
- Karena nomor massa atom karbon adalah 12 dan jumlah protonnya 6, maka jumlah neutronnya adalah 12 – 6 = 6 neutron.
- Dalam keadaan netral, atom memiliki jumlah elektron yang sama dengan jumlah protonnya, sehingga atom karbon memiliki 6 elektron.
Perbedaan Nomor Atom dan Nomor Massa
Nomor atom dan nomor massa adalah dua konsep penting dalam kimia yang membantu kita memahami struktur dan sifat atom.
- Nomor atom (Z) adalah jumlah proton dalam inti atom. Nomor atom menentukan identitas suatu unsur. Misalnya, semua atom dengan nomor atom 6 adalah atom karbon.
- Nomor massa (A) adalah jumlah proton dan neutron dalam inti atom. Nomor massa menentukan isotop suatu unsur. Isotop adalah atom-atom dari unsur yang sama dengan jumlah proton yang sama tetapi jumlah neutron yang berbeda. Misalnya, karbon-12 dan karbon-14 adalah isotop karbon. Karbon-12 memiliki 6 proton dan 6 neutron (A = 12), sedangkan karbon-14 memiliki 6 proton dan 8 neutron (A = 14).
Contoh Cara Menentukan Nomor Atom dan Nomor Massa Suatu Atom
- Misalnya, atom oksigen (O) memiliki 8 proton dan 8 neutron.
- Nomor atom oksigen adalah 8, karena jumlah protonnya adalah 8.
- Nomor massa oksigen adalah 16, karena jumlah proton dan neutronnya adalah 8 + 8 = 16.
Tabel Data Nomor Atom, Nomor Massa, dan Jumlah Proton, Neutron, dan Elektron untuk Beberapa Contoh Atom
| Unsur | Simbol | Nomor Atom (Z) | Nomor Massa (A) | Jumlah Proton | Jumlah Neutron | Jumlah Elektron |
|---|---|---|---|---|---|---|
| Hidrogen | H | 1 | 1 | 1 | 0 | 1 |
| Helium | He | 2 | 4 | 2 | 2 | 2 |
| Litium | Li | 3 | 7 | 3 | 4 | 3 |
| Berilium | Be | 4 | 9 | 4 | 5 | 4 |
| Boron | B | 5 | 11 | 5 | 6 | 5 |
| Karbon | C | 6 | 12 | 6 | 6 | 6 |
| Nitrogen | N | 7 | 14 | 7 | 7 | 7 |
| Oksigen | O | 8 | 16 | 8 | 8 | 8 |
| Fluor | F | 9 | 19 | 9 | 10 | 9 |
| Neon | Ne | 10 | 20 | 10 | 10 | 10 |
Isotop, Isobar, dan Isoton
Dalam mempelajari struktur atom, kita mengenal berbagai istilah yang menggambarkan hubungan antara atom-atom yang berbeda. Tiga di antaranya adalah isotop, isobar, dan isoton. Ketiga istilah ini seringkali membingungkan karena kesamaan nama dan definisinya yang saling berkaitan. Namun, memahami perbedaan di antara ketiganya sangat penting untuk memahami bagaimana atom-atom saling berhubungan dan berperilaku.
Ngerjain soal struktur atom beserta jawabannya emang perlu pemahaman yang mendalam tentang susunan atom. Tapi, jangan lupa juga tentang konsep dasar reaksi kimia yang berhubungan erat dengan struktur atom itu sendiri. Misalnya, contoh soal reaksi kimia tentang reaksi pembakaran bisa dikaitkan dengan struktur atom karbon dan oksigen.
Dengan memahami struktur atom, kamu bakal lebih mudah ngerti proses reaksi kimia yang terjadi, lho!
Pengertian Isotop, Isobar, dan Isoton
Untuk memahami perbedaan ketiga jenis atom ini, mari kita definisikan masing-masing:
- Isotop: Isotop adalah atom-atom dari unsur yang sama yang memiliki jumlah proton yang sama, tetapi jumlah neutronnya berbeda. Artinya, isotop memiliki nomor atom yang sama tetapi nomor massanya berbeda. Contohnya, karbon-12 dan karbon-14 adalah isotop karbon, keduanya memiliki 6 proton, tetapi karbon-12 memiliki 6 neutron sedangkan karbon-14 memiliki 8 neutron.
- Isobar: Isobar adalah atom-atom dari unsur yang berbeda yang memiliki jumlah neutron yang sama tetapi jumlah protonnya berbeda. Artinya, isobar memiliki nomor massa yang sama tetapi nomor atomnya berbeda. Contohnya, argon-40 (18 proton dan 22 neutron) dan kalsium-40 (20 proton dan 20 neutron) adalah isobar karena keduanya memiliki nomor massa 40.
- Isoton: Isoton adalah atom-atom dari unsur yang berbeda yang memiliki jumlah neutron yang sama. Artinya, isoton memiliki nomor massa yang berbeda tetapi memiliki jumlah neutron yang sama. Contohnya, nitrogen-14 (7 proton dan 7 neutron) dan oksigen-15 (8 proton dan 7 neutron) adalah isoton karena keduanya memiliki 7 neutron.
Contoh Atom Isotop, Isobar, dan Isoton
Berikut adalah contoh atom yang merupakan isotop, isobar, dan isoton:
| Jenis Atom | Contoh | Nomor Atom (Z) | Nomor Massa (A) | Jumlah Proton | Jumlah Neutron |
|---|---|---|---|---|---|
| Isotop | Karbon-12 (12C) dan Karbon-14 (14C) | 6 | 12 dan 14 | 6 | 6 dan 8 |
| Isobar | Argon-40 (40Ar) dan Kalsium-40 (40Ca) | 18 dan 20 | 40 | 18 dan 20 | 22 dan 20 |
| Isoton | Nitrogen-14 (14N) dan Oksigen-15 (15O) | 7 dan 8 | 14 dan 15 | 7 dan 8 | 7 |
Perbedaan Isotop, Isobar, dan Isoton
Berikut adalah tabel yang membandingkan ketiga jenis atom tersebut berdasarkan ciri khasnya:
| Ciri Khas | Isotop | Isobar | Isoton |
|---|---|---|---|
| Nomor Atom (Z) | Sama | Berbeda | Berbeda |
| Nomor Massa (A) | Berbeda | Sama | Berbeda |
| Jumlah Proton | Sama | Berbeda | Berbeda |
| Jumlah Neutron | Berbeda | Sama | Sama |
| Sifat Kimia | Hampir sama | Berbeda | Berbeda |
Konfigurasi Elektron
Konfigurasi elektron adalah susunan elektron dalam berbagai tingkat energi dan subtingkat energi di dalam atom. Pengetahuan tentang konfigurasi elektron penting untuk memahami sifat kimia suatu atom, seperti bagaimana atom berikatan dengan atom lainnya dan membentuk senyawa.
Cara Menentukan Konfigurasi Elektron
Konfigurasi elektron suatu atom dapat ditentukan dengan mengikuti aturan-aturan berikut:
- Aturan Aufbau: Elektron-elektron menempati orbital dengan tingkat energi terendah terlebih dahulu. Orbital-orbital dengan tingkat energi yang sama diisi secara bertahap dengan satu elektron di setiap orbital sebelum mengisi orbital yang sama dengan elektron kedua.
- Prinsip Hund: Elektron-elektron dalam subtingkat energi yang sama menempati orbital-orbital yang berbeda terlebih dahulu sebelum mengisi orbital yang sama.
- Prinsip larangan Pauli: Setiap orbital hanya dapat menampung maksimal dua elektron, dan kedua elektron tersebut harus memiliki spin yang berlawanan.
Contohnya, atom nitrogen (N) memiliki 7 elektron. Konfigurasi elektronnya adalah 1s22s22p3.
Contoh Soal Konfigurasi Elektron Atom
Tentukan konfigurasi elektron atom oksigen (O).
- Oksigen memiliki 8 elektron.
- Mengikuti aturan Aufbau, elektron-elektron akan menempati orbital 1s, 2s, dan 2p.
- Konfigurasi elektron atom oksigen adalah 1s22s22p4.
Hubungan Konfigurasi Elektron dengan Sifat Kimia Atom
Konfigurasi elektron suatu atom menentukan bagaimana atom tersebut berikatan dengan atom lainnya. Atom-atom cenderung bereaksi sedemikian rupa sehingga mereka mencapai konfigurasi elektron yang stabil, seperti konfigurasi elektron gas mulia.
- Atom-atom dengan elektron valensi (elektron di kulit terluar) yang hampir penuh cenderung menarik elektron dari atom lain untuk membentuk ion negatif.
- Atom-atom dengan elektron valensi yang sedikit cenderung melepaskan elektron untuk membentuk ion positif.
- Atom-atom dengan elektron valensi yang sama cenderung membentuk ikatan kovalen dengan berbagi elektron.
Soal Latihan Struktur Atom
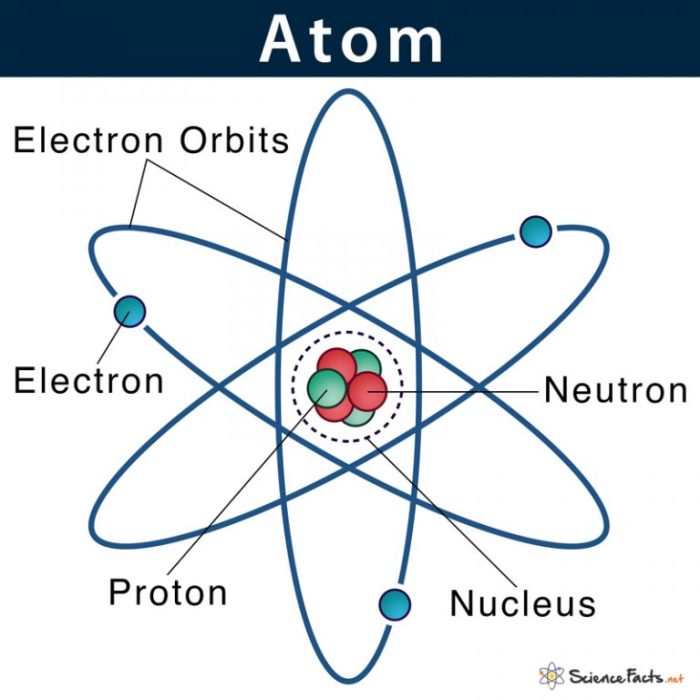
Struktur atom merupakan konsep dasar dalam kimia yang menjelaskan bagaimana atom tersusun. Memahami struktur atom penting untuk memahami sifat kimia suatu unsur dan bagaimana atom berinteraksi membentuk molekul. Untuk menguji pemahamanmu tentang struktur atom, berikut adalah 5 soal latihan yang dapat kamu kerjakan.
Soal Latihan Struktur Atom
Berikut ini adalah 5 soal latihan tentang struktur atom yang dapat kamu kerjakan untuk menguji pemahamanmu. Soal-soal ini mencakup berbagai tingkat kesulitan, mulai dari yang mudah hingga yang menantang.
- Soal 1: Manakah dari berikut ini yang merupakan partikel subatomik yang bermuatan positif?
- Proton
- Neutron
- Elektron
Jawaban: Proton
- Soal 2: Apa yang dimaksud dengan nomor atom?
- Jumlah proton dalam atom
- Jumlah neutron dalam atom
- Jumlah elektron dalam atom
Jawaban: Jumlah proton dalam atom
- Soal 3: Apa perbedaan utama antara isotop?
- Jumlah proton yang berbeda
- Jumlah neutron yang berbeda
- Jumlah elektron yang berbeda
Jawaban: Jumlah neutron yang berbeda
- Soal 4: Jelaskan model atom Bohr dan bagaimana model ini menjelaskan spektrum garis atom hidrogen.
Jawaban: Model atom Bohr menyatakan bahwa elektron bergerak dalam orbit tertentu di sekitar inti atom, dan setiap orbit memiliki tingkat energi yang berbeda. Ketika elektron berpindah dari orbit yang lebih tinggi ke orbit yang lebih rendah, ia memancarkan energi dalam bentuk cahaya. Spektrum garis atom hidrogen dapat dijelaskan dengan model Bohr karena garis-garis spektrum sesuai dengan transisi elektron antara tingkat energi yang berbeda dalam atom hidrogen. - Soal 5: Apa yang dimaksud dengan bilangan kuantum dan bagaimana bilangan kuantum ini digunakan untuk menggambarkan elektron dalam atom?
Jawaban: Bilangan kuantum adalah sekumpulan bilangan yang menggambarkan sifat-sifat elektron dalam atom, seperti tingkat energi, bentuk orbital, dan orientasi spasial. Ada empat bilangan kuantum utama:- Bilangan kuantum utama (n): Menentukan tingkat energi elektron. Semakin besar nilai n, semakin tinggi tingkat energi elektron.
- Bilangan kuantum azimut atau momentum sudut (l): Menentukan bentuk orbital elektron. Nilai l berkisar dari 0 hingga n-1, dan setiap nilai l sesuai dengan bentuk orbital yang berbeda.
- Bilangan kuantum magnetik (ml): Menentukan orientasi spasial orbital elektron. Nilai ml berkisar dari -l hingga +l, termasuk 0.
- Bilangan kuantum spin (ms): Menentukan arah spin elektron. Nilai ms dapat berupa +1/2 atau -1/2.
Bilangan kuantum ini digunakan untuk menggambarkan elektron dalam atom dan menentukan konfigurasi elektron atom.
Ilustrasi Struktur Atom
Untuk memahami struktur atom lebih baik, mari kita gambarkan sebuah ilustrasi sederhana. Bayangkan sebuah bola kecil yang padat di tengah, dibungkus oleh beberapa lingkaran yang berjarak lebih jauh dari bola tersebut. Bola padat di tengah ini merepresentasikan inti atom, sementara lingkaran-lingkaran yang mengelilinginya menggambarkan kulit elektron.
Bagian-bagian Atom
Inti atom merupakan pusat atom yang mengandung proton dan neutron. Proton bermuatan positif, sedangkan neutron tidak bermuatan. Proton dan neutron memiliki massa yang hampir sama. Elektron bermuatan negatif dan berputar mengelilingi inti atom dalam kulit elektron. Elektron memiliki massa yang jauh lebih kecil dibandingkan dengan proton dan neutron.
Orbital Atom dan Kulit Elektron
Orbital atom merupakan daerah di sekitar inti atom di mana kemungkinan ditemukannya elektron paling tinggi. Setiap orbital memiliki bentuk dan tingkat energi yang berbeda. Kulit elektron merupakan kumpulan orbital-orbital atom yang memiliki tingkat energi yang sama. Elektron-elektron dalam kulit elektron yang lebih dekat ke inti atom memiliki energi yang lebih rendah daripada elektron-elektron dalam kulit elektron yang lebih jauh.
Ilustrasi Struktur Atom
Berikut adalah ilustrasi sederhana struktur atom:
| Bagian Atom | Keterangan |
|---|---|
| Inti Atom | Berisi proton dan neutron. Proton bermuatan positif dan neutron tidak bermuatan. |
| Proton | Bermuatan positif dan terletak di inti atom. |
| Neutron | Tidak bermuatan dan terletak di inti atom. |
| Elektron | Bermuatan negatif dan bergerak mengelilingi inti atom dalam kulit elektron. |
| Kulit Elektron | Daerah di sekitar inti atom tempat elektron bergerak. |
| Orbital Atom | Daerah di sekitar inti atom di mana kemungkinan ditemukannya elektron paling tinggi. |
Contoh Ilustrasi
Sebagai contoh, atom karbon memiliki 6 proton, 6 neutron, dan 6 elektron. Keenam proton dan neutron terletak di inti atom, sedangkan keenam elektron bergerak dalam dua kulit elektron. Kulit elektron pertama memiliki 2 elektron, sedangkan kulit elektron kedua memiliki 4 elektron.
Konsep Orbital Atom
Konsep orbital atom menjelaskan bahwa elektron tidak bergerak secara acak di sekitar inti atom, melainkan bergerak dalam orbital-orbital atom yang memiliki bentuk dan tingkat energi tertentu. Misalnya, orbital s memiliki bentuk bola, sedangkan orbital p memiliki bentuk halter. Setiap orbital dapat menampung maksimal 2 elektron.
Konsep Kulit Elektron
Konsep kulit elektron menjelaskan bahwa elektron-elektron dalam atom tersusun dalam beberapa kulit elektron, dengan tingkat energi yang berbeda. Kulit elektron pertama memiliki tingkat energi yang paling rendah, sedangkan kulit elektron berikutnya memiliki tingkat energi yang lebih tinggi. Elektron-elektron dapat berpindah dari satu kulit elektron ke kulit elektron lain dengan menyerap atau melepaskan energi.
Kesimpulan
Ilustrasi struktur atom memberikan gambaran visual tentang susunan bagian-bagian atom, termasuk inti atom, proton, neutron, elektron, kulit elektron, dan orbital atom. Konsep orbital atom dan kulit elektron menjelaskan bagaimana elektron bergerak di sekitar inti atom dan bagaimana energi mereka terdistribusi.
Penerapan Konsep Struktur Atom
Konsep struktur atom, yang menggambarkan susunan partikel-partikel penyusun atom, memiliki peran penting dalam berbagai bidang ilmu pengetahuan dan teknologi. Pemahaman mendalam tentang struktur atom memungkinkan kita untuk memahami sifat dan perilaku zat, serta mengembangkan teknologi baru yang bermanfaat bagi kehidupan manusia.
Penerapan dalam Kehidupan Sehari-hari
Penerapan konsep struktur atom dalam kehidupan sehari-hari mungkin tidak terlihat secara langsung, namun tertanam dalam berbagai teknologi yang kita gunakan. Misalnya, dalam baterai, reaksi kimia yang terjadi melibatkan perpindahan elektron antar atom, yang memungkinkan penyimpanan dan pelepasan energi.
- Elektronik: Transistor, komponen utama dalam berbagai perangkat elektronik, bekerja berdasarkan sifat elektron dalam atom.
- Bahan Bangunan: Pengetahuan tentang ikatan kimia antar atom memungkinkan kita untuk merancang bahan bangunan yang kuat, tahan lama, dan tahan terhadap korosi.
- Pangan: Proses pengolahan pangan, seperti pemanasan, melibatkan perubahan struktur molekul makanan, yang pada dasarnya melibatkan perubahan struktur atom.
- Farmasi: Perkembangan obat-obatan modern didasarkan pada pemahaman tentang struktur atom dan bagaimana atom-atom tersebut berinteraksi dalam tubuh.
Penerapan dalam Bidang Kimia
Konsep struktur atom merupakan dasar dari ilmu kimia. Pemahaman tentang susunan elektron dalam atom memungkinkan kita untuk memprediksi sifat kimia suatu unsur dan bagaimana unsur-unsur tersebut bereaksi satu sama lain untuk membentuk senyawa baru.
- Ikatan Kimia: Ikatan kimia, seperti ikatan kovalen dan ikatan ion, dibentuk melalui interaksi elektron antar atom. Pemahaman tentang ikatan kimia memungkinkan kita untuk memprediksi sifat dan stabilitas senyawa.
- Reaksi Kimia: Reaksi kimia melibatkan pemutusan dan pembentukan ikatan kimia, yang melibatkan perubahan struktur atom. Pemahaman tentang struktur atom memungkinkan kita untuk memahami mekanisme reaksi kimia dan memprediksi produk yang dihasilkan.
- Spektroskopi: Spektroskopi merupakan teknik yang digunakan untuk mempelajari struktur atom dan molekul dengan menganalisis spektrum cahaya yang dipancarkan atau diserap oleh zat.
Penerapan dalam Bidang Fisika
Struktur atom memiliki peran penting dalam berbagai bidang fisika, seperti fisika nuklir, fisika atom, dan fisika partikel.
- Fisi Nuklir: Fisi nuklir merupakan proses pembelahan inti atom, yang melepaskan energi yang sangat besar. Pemahaman tentang struktur inti atom memungkinkan kita untuk mengendalikan proses fisi nuklir dalam reaktor nuklir.
- Fusi Nuklir: Fusi nuklir merupakan proses penggabungan inti atom, yang melepaskan energi yang lebih besar daripada fisi nuklir. Pemahaman tentang struktur inti atom penting untuk mengembangkan teknologi fusi nuklir sebagai sumber energi masa depan.
- Spektroskopi Atom: Spektroskopi atom digunakan untuk mempelajari struktur atom dan sifat-sifatnya, seperti energi ionisasi dan afinitas elektron.
Penerapan dalam Bidang Teknologi
Konsep struktur atom telah mendorong perkembangan teknologi yang bermanfaat bagi kehidupan manusia.
- Nanoteknologi: Nanoteknologi melibatkan manipulasi materi pada skala atom dan molekul. Pemahaman tentang struktur atom memungkinkan kita untuk merancang material baru dengan sifat yang unik, seperti kekuatan tinggi, konduktivitas listrik yang baik, dan sifat optik yang istimewa.
- Komputer Kuantum: Komputer kuantum memanfaatkan sifat kuantum dari atom untuk melakukan perhitungan yang jauh lebih cepat daripada komputer klasik. Pemahaman tentang struktur atom penting untuk pengembangan komputer kuantum.
- Energi Terbarukan: Pengembangan teknologi energi terbarukan, seperti sel surya dan baterai, didasarkan pada pemahaman tentang struktur atom dan bagaimana atom-atom tersebut berinteraksi dengan cahaya dan energi.
Implikasi Pemahaman Struktur Atom terhadap Perkembangan Ilmu Pengetahuan dan Teknologi
Pemahaman tentang struktur atom telah memicu kemajuan luar biasa dalam berbagai bidang ilmu pengetahuan dan teknologi. Berikut adalah beberapa implikasi penting:
- Pengembangan Material Baru: Pengetahuan tentang struktur atom memungkinkan kita untuk merancang material baru dengan sifat yang lebih unggul, seperti kekuatan tinggi, tahan panas, dan konduktivitas listrik yang baik.
- Pengembangan Teknologi Baru: Pemahaman tentang struktur atom telah memungkinkan pengembangan teknologi baru, seperti komputer kuantum, sel surya, dan baterai yang lebih efisien.
- Pemahaman yang Lebih Mendalam tentang Alam Semesta: Pemahaman tentang struktur atom memungkinkan kita untuk memahami proses-proses fundamental di alam semesta, seperti pembentukan bintang, galaksi, dan elemen-elemen kimia.
Simpulan Akhir
Memahami struktur atom adalah kunci untuk membuka rahasia dunia materi. Dengan memahami konsep dasar tentang atom, kita dapat memahami sifat dan perilaku berbagai zat di sekitar kita, menjelajahi dunia kimia dan fisika, dan mengembangkan teknologi baru yang bermanfaat bagi kehidupan manusia. Melalui contoh soal dan pembahasan yang disajikan, semoga Anda dapat lebih memahami dunia atom yang penuh keajaiban ini.





