Contoh soal konfigurasi elektron bohr – Pernahkah Anda bertanya-tanya bagaimana elektron tersusun dalam atom? Model atom Bohr, yang menggambarkan elektron mengitari inti atom dalam orbit-orbit tertentu, memberikan gambaran sederhana namun efektif tentang tata letak elektron. Konsep ini menjadi dasar pemahaman sifat kimia suatu unsur, dan tentu saja, akan lebih mudah dipahami dengan latihan soal.
Dalam artikel ini, kita akan menjelajahi contoh soal konfigurasi elektron atom berdasarkan model Bohr. Kita akan melihat bagaimana menentukan konfigurasi elektron untuk berbagai unsur, dan bagaimana model ini membantu kita memahami sifat kimia suatu unsur.
Perbedaan Konfigurasi Elektron Atom Berdasarkan Model Bohr dan Model Mekanika Kuantum
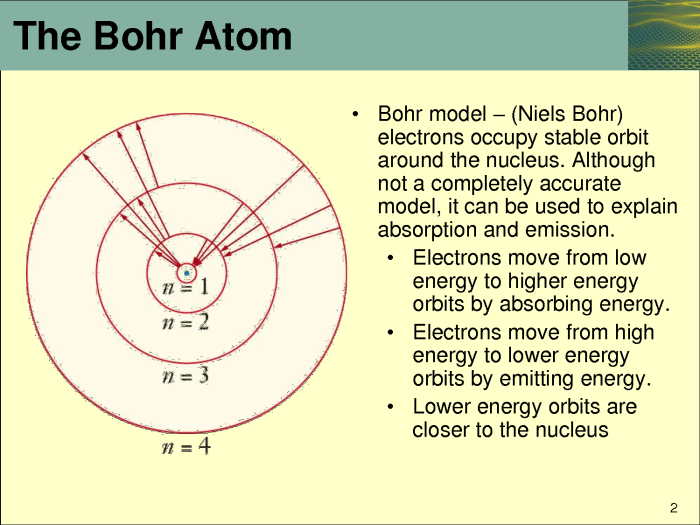
Model atom Bohr dan model mekanika kuantum merupakan dua model atom yang berbeda dalam menjelaskan konfigurasi elektron atom. Meskipun keduanya berusaha untuk menggambarkan struktur atom, terdapat perbedaan mendasar dalam cara mereka memandang posisi dan energi elektron.
Perbedaan Utama Model Atom Bohr dan Model Mekanika Kuantum
Model atom Bohr, yang diusulkan oleh Niels Bohr pada tahun 1913, menggambarkan elektron sebagai partikel yang bergerak dalam orbit melingkar mengelilingi inti atom. Orbit-orbit ini memiliki tingkat energi yang terkuantisasi, artinya elektron hanya dapat menempati tingkat energi tertentu. Model ini berhasil menjelaskan spektrum atom hidrogen, tetapi gagal untuk menjelaskan spektrum atom yang lebih kompleks.
Model mekanika kuantum, yang dikembangkan pada awal abad ke-20, memberikan deskripsi yang lebih akurat tentang perilaku elektron dalam atom. Model ini menganggap elektron sebagai gelombang dan menggunakan persamaan matematika untuk memprediksi probabilitas menemukan elektron di suatu titik dalam ruang. Model ini juga memperkenalkan konsep orbital atom, yang merupakan wilayah tiga dimensi di sekitar inti atom di mana kemungkinan menemukan elektron paling tinggi.
Keunggulan Model Mekanika Kuantum
- Deskripsi yang lebih akurat: Model mekanika kuantum memberikan deskripsi yang lebih akurat tentang konfigurasi elektron atom dibandingkan dengan model Bohr. Model ini dapat menjelaskan spektrum atom yang lebih kompleks, termasuk atom multi-elektron.
- Konsep orbital atom: Model mekanika kuantum memperkenalkan konsep orbital atom, yang merupakan wilayah tiga dimensi di sekitar inti atom di mana kemungkinan menemukan elektron paling tinggi. Orbital atom memiliki bentuk dan orientasi ruang yang berbeda, yang menjelaskan sifat kimia dan fisik atom.
- Pertimbangan kuantum: Model mekanika kuantum mempertimbangkan sifat kuantum elektron, seperti dualitas gelombang-partikel dan prinsip ketidakpastian Heisenberg. Hal ini memungkinkan untuk memahami perilaku elektron dengan lebih baik.
Contoh Perbedaan Konfigurasi Elektron Atom
Perbedaan antara kedua model ini dapat dilihat pada contoh atom karbon. Menurut model Bohr, atom karbon memiliki konfigurasi elektron 2,4, yang berarti bahwa dua elektron berada di kulit pertama dan empat elektron berada di kulit kedua. Namun, model mekanika kuantum menunjukkan bahwa konfigurasi elektron atom karbon adalah 1s22s22p2. Konfigurasi ini menunjukkan bahwa dua elektron berada di orbital 1s, dua elektron berada di orbital 2s, dan dua elektron berada di orbital 2p.
Contoh soal konfigurasi elektron bohr biasanya membahas tentang susunan elektron pada atom. Misalnya, soal bisa meminta kita untuk menentukan konfigurasi elektron atom karbon. Nah, mencari jawabannya membutuhkan pemahaman yang baik tentang aturan-aturan konfigurasi elektron. Begitu juga dengan contoh soal ekonomi kelas 11, contoh soal ekonomi kelas 11 yang berfokus pada konsep-konsep ekonomi seperti permintaan dan penawaran, mengharuskan kita untuk memahami hubungan antara berbagai faktor yang berpengaruh pada ekonomi.
Sama seperti mencari konfigurasi elektron, memahami prinsip-prinsip ekonomi akan membantu kita dalam menjawab soal-soal yang diberikan.
Perbedaan utama antara kedua model ini terletak pada cara mereka menggambarkan posisi dan energi elektron. Model Bohr menggambarkan elektron sebagai partikel yang bergerak dalam orbit melingkar, sementara model mekanika kuantum menggambarkan elektron sebagai gelombang yang berada dalam orbital atom. Model mekanika kuantum memberikan deskripsi yang lebih akurat tentang perilaku elektron dalam atom dan dapat menjelaskan spektrum atom yang lebih kompleks.
Contoh Soal Konfigurasi Elektron Atom dengan Penjelasan Lengkap
Konfigurasi elektron atom adalah susunan elektron dalam berbagai tingkat energi dan sub tingkat energi di dalam atom. Susunan ini sangat penting karena menentukan sifat kimia suatu atom, seperti reaktivitas dan jenis ikatan yang dapat dibentuknya. Dalam contoh soal ini, kita akan mempelajari cara menentukan konfigurasi elektron atom untuk unsur-unsur dengan nomor atom yang lebih besar dan melihat bagaimana konfigurasi elektron atom berubah ketika suatu atom menjadi ion.
Contoh Soal Konfigurasi Elektron Atom, Contoh soal konfigurasi elektron bohr
Misalnya, kita ingin menentukan konfigurasi elektron atom oksigen (O) yang memiliki nomor atom 8. Berikut adalah langkah-langkah yang dapat kita ikuti:
- Tentukan jumlah elektron dalam atom. Karena nomor atom oksigen adalah 8, maka atom oksigen memiliki 8 elektron.
- Susun elektron dalam tingkat energi dan sub tingkat energi. Kita dapat menggunakan diagram orbital untuk membantu kita dalam proses ini. Diagram orbital adalah representasi visual dari susunan elektron dalam atom.
- Isi orbital dengan elektron, dimulai dari tingkat energi terendah dan bergerak ke tingkat energi yang lebih tinggi. Ingat bahwa setiap orbital dapat menampung maksimal 2 elektron, dan elektron harus memiliki spin yang berlawanan.
Berikut adalah konfigurasi elektron atom oksigen:
1s2 2s2 2p4
Konfigurasi elektron ini menunjukkan bahwa 2 elektron pertama oksigen berada di tingkat energi pertama (1s), 2 elektron berikutnya berada di tingkat energi kedua (2s), dan 4 elektron terakhir berada di sub tingkat energi p (2p).
Menentukan Konfigurasi Elektron Atom untuk Unsur-unsur dengan Nomor Atom yang Lebih Besar
Untuk unsur-unsur dengan nomor atom yang lebih besar, kita dapat menggunakan aturan Aufbau dan prinsip Hund untuk menentukan konfigurasi elektron atom. Aturan Aufbau menyatakan bahwa elektron harus mengisi orbital dengan tingkat energi terendah terlebih dahulu. Prinsip Hund menyatakan bahwa elektron harus mengisi orbital dalam sub tingkat energi yang sama secara individual sebelum berpasangan.
Sebagai contoh, mari kita perhatikan konfigurasi elektron atom besi (Fe) yang memiliki nomor atom 26. Berikut adalah langkah-langkah yang dapat kita ikuti:
- Tentukan jumlah elektron dalam atom. Karena nomor atom besi adalah 26, maka atom besi memiliki 26 elektron.
- Susun elektron dalam tingkat energi dan sub tingkat energi menggunakan aturan Aufbau dan prinsip Hund.
Berikut adalah konfigurasi elektron atom besi:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Konfigurasi elektron ini menunjukkan bahwa 2 elektron pertama besi berada di tingkat energi pertama (1s), 2 elektron berikutnya berada di tingkat energi kedua (2s), dan seterusnya. Penting untuk dicatat bahwa sub tingkat energi 3d diisi setelah sub tingkat energi 4s karena tingkat energi 4s lebih rendah daripada 3d.
Contoh Soal Konfigurasi Elektron Atom untuk Ion
Konfigurasi elektron atom berubah ketika suatu atom menjadi ion. Ion adalah atom yang telah kehilangan atau memperoleh elektron. Ketika suatu atom kehilangan elektron, ia menjadi ion positif (kation). Ketika suatu atom memperoleh elektron, ia menjadi ion negatif (anion).
Sebagai contoh, mari kita perhatikan konfigurasi elektron atom natrium (Na) yang memiliki nomor atom 11. Konfigurasi elektron atom natrium adalah:
1s2 2s2 2p6 3s1
Ketika natrium kehilangan satu elektron, ia menjadi ion positif (Na+). Konfigurasi elektron ion natrium adalah:
1s2 2s2 2p6
Konfigurasi elektron ion natrium sama dengan konfigurasi elektron gas mulia neon (Ne) yang memiliki nomor atom 10. Ion natrium memiliki konfigurasi elektron yang stabil karena memiliki kulit elektron terluar yang penuh.
Sebagai contoh lain, mari kita perhatikan konfigurasi elektron atom klorin (Cl) yang memiliki nomor atom 17. Konfigurasi elektron atom klorin adalah:
1s2 2s2 2p6 3s2 3p5
Ketika klorin memperoleh satu elektron, ia menjadi ion negatif (Cl–). Konfigurasi elektron ion klorin adalah:
1s2 2s2 2p6 3s2 3p6
Konfigurasi elektron ion klorin sama dengan konfigurasi elektron gas mulia argon (Ar) yang memiliki nomor atom 18. Ion klorin memiliki konfigurasi elektron yang stabil karena memiliki kulit elektron terluar yang penuh.
Konsep Orbital Atom dan Konfigurasi Elektron: Contoh Soal Konfigurasi Elektron Bohr
Konsep orbital atom merupakan pengembangan dari teori atom Bohr yang menjelaskan tentang lokasi elektron dalam atom. Model atom Bohr menggambarkan elektron mengelilingi inti atom pada lintasan tertentu yang disebut kulit elektron. Namun, teori mekanika kuantum menunjukkan bahwa elektron tidak bergerak pada lintasan tertentu, melainkan berada di daerah tertentu di sekitar inti atom yang disebut orbital atom.
Hubungan Orbital Atom dan Konfigurasi Elektron
Orbital atom merupakan daerah ruang di sekitar inti atom tempat ditemukannya elektron dengan probabilitas tertinggi. Setiap orbital atom memiliki bentuk dan energi yang spesifik, dan hanya dapat menampung maksimal dua elektron. Konfigurasi elektron atom menggambarkan bagaimana elektron-elektron terdistribusi dalam orbital atom. Setiap orbital atom memiliki bentuk dan energi yang spesifik, dan hanya dapat menampung maksimal dua elektron. Konfigurasi elektron atom menggambarkan bagaimana elektron-elektron terdistribusi dalam orbital atom.
Jenis-jenis Orbital Atom
Terdapat empat jenis orbital atom utama, yaitu orbital s, p, d, dan f. Setiap jenis orbital memiliki bentuk dan energi yang berbeda, dan masing-masing dapat menampung jumlah elektron tertentu.
- Orbital s: Bentuknya bulat dan simetris terhadap inti atom. Orbital s memiliki energi terendah dan hanya dapat menampung maksimal dua elektron. Contohnya, orbital 1s dan 2s.
- Orbital p: Bentuknya seperti halter atau dumbbel, memiliki dua lobus yang saling berlawanan. Orbital p memiliki energi lebih tinggi daripada orbital s, dan dapat menampung maksimal enam elektron (tiga orbital p). Contohnya, orbital 2p dan 3p.
- Orbital d: Bentuknya lebih kompleks, memiliki empat lobus dan satu lobus cincin. Orbital d memiliki energi lebih tinggi daripada orbital p, dan dapat menampung maksimal sepuluh elektron (lima orbital d). Contohnya, orbital 3d dan 4d.
- Orbital f: Bentuknya sangat kompleks dan memiliki tujuh lobus. Orbital f memiliki energi tertinggi dan dapat menampung maksimal empat belas elektron (tujuh orbital f). Contohnya, orbital 4f dan 5f.
Hubungan Konfigurasi Elektron dengan Bentuk Orbital Atom
Konfigurasi elektron atom menentukan bentuk orbital atom yang dihuni oleh elektron-elektron. Contohnya, atom nitrogen (N) memiliki konfigurasi elektron 1s22s22p3. Konfigurasi ini menunjukkan bahwa dua elektron menempati orbital 1s, dua elektron menempati orbital 2s, dan tiga elektron menempati tiga orbital 2p. Tiga elektron pada orbital 2p menyebabkan atom nitrogen memiliki tiga orbital p yang terisi sebagian. Bentuk orbital p yang terisi sebagian ini menyebabkan atom nitrogen memiliki bentuk yang khas.
Konfigurasi Elektron Atom dan Tabel Periodik
Konfigurasi elektron atom adalah susunan elektron-elektron dalam kulit dan subkulit atom. Konfigurasi elektron ini sangat penting karena dapat digunakan untuk menjelaskan sifat kimia suatu unsur dan posisinya dalam tabel periodik. Dalam tabel periodik, unsur-unsur disusun berdasarkan kesamaan sifat kimia mereka.
Hubungan Konfigurasi Elektron Atom dan Posisi Unsur dalam Tabel Periodik
Konfigurasi elektron atom berhubungan erat dengan posisi suatu unsur dalam tabel periodik.
- Periode: Periode dalam tabel periodik menunjukkan jumlah kulit elektron yang dimiliki oleh atom suatu unsur. Misalnya, unsur-unsur pada periode 1 memiliki 1 kulit elektron, periode 2 memiliki 2 kulit elektron, dan seterusnya.
- Golongan: Golongan dalam tabel periodik menunjukkan jumlah elektron valensi, yaitu elektron pada kulit terluar atom. Misalnya, unsur-unsur pada golongan 1 memiliki 1 elektron valensi, golongan 2 memiliki 2 elektron valensi, dan seterusnya.
Menentukan Golongan dan Periode Suatu Unsur Berdasarkan Konfigurasi Elektron
Konfigurasi elektron atom dapat digunakan untuk menentukan golongan dan periode suatu unsur dalam tabel periodik.
- Periode: Jumlah kulit elektron dalam konfigurasi elektron atom menunjukkan periode unsur tersebut. Misalnya, konfigurasi elektron atom natrium (Na) adalah 2, 8, 1, yang berarti natrium memiliki 3 kulit elektron dan terletak pada periode 3.
- Golongan: Jumlah elektron valensi dalam konfigurasi elektron atom menunjukkan golongan unsur tersebut. Misalnya, konfigurasi elektron atom natrium (Na) adalah 2, 8, 1, yang berarti natrium memiliki 1 elektron valensi dan terletak pada golongan 1.
Memprediksi Sifat Kimia Suatu Unsur Berdasarkan Posisinya dalam Tabel Periodik
Konfigurasi elektron atom dapat digunakan untuk memprediksi sifat kimia suatu unsur berdasarkan posisinya dalam tabel periodik.
- Sifat logam: Unsur-unsur pada golongan 1 dan 2 umumnya bersifat logam, karena memiliki sedikit elektron valensi yang mudah dilepaskan untuk membentuk ion positif. Semakin ke kanan tabel periodik, sifat logam semakin berkurang, dan sifat non-logam semakin meningkat.
- Elektronegativitas: Elektronegativitas adalah kemampuan suatu atom untuk menarik elektron dalam ikatan kimia. Semakin ke kanan dan atas tabel periodik, elektronegativitas semakin meningkat. Misalnya, fluor (F) memiliki elektronegativitas tertinggi dalam tabel periodik.
- Keelektronegatifan: Keelektronegatifan adalah kemampuan suatu atom untuk melepas elektron dalam ikatan kimia. Semakin ke kiri dan bawah tabel periodik, keelektronegatifan semakin meningkat. Misalnya, cesium (Cs) memiliki keelektronegatifan terendah dalam tabel periodik.
Ulasan Penutup
Memahami konfigurasi elektron atom merupakan langkah penting dalam memahami kimia. Model atom Bohr, meskipun memiliki keterbatasan, memberikan dasar yang kuat untuk mempelajari tata letak elektron dalam atom. Dengan memahami model ini dan latihan soal yang diberikan, kita dapat memprediksi sifat kimia suatu unsur dan memahami bagaimana atom saling berinteraksi untuk membentuk ikatan kimia.




