Contoh soal konfigurasi elektron aufbau – Pernahkah kamu bertanya-tanya bagaimana elektron-elektron tersusun dalam sebuah atom? Konfigurasi elektron merupakan jawabannya! Bayangkan atom sebagai sebuah bangunan dengan berbagai lantai dan ruangan. Elektron-elektron, seperti penghuni bangunan, menempati lantai dan ruangan tertentu sesuai dengan aturan yang telah ditetapkan. Salah satu aturan penting yang mengatur penempatan elektron dalam atom adalah prinsip Aufbau. Prinsip Aufbau, seperti seorang arsitek, menentukan urutan pengisian elektron pada tingkat energi yang berbeda. Dengan memahami prinsip ini, kita dapat menentukan konfigurasi elektron suatu atom, yang merupakan peta jalan bagi perilaku kimia suatu unsur.
Dalam artikel ini, kita akan menjelajahi prinsip Aufbau dan bagaimana prinsip ini diterapkan untuk menentukan konfigurasi elektron suatu atom. Kita akan mempelajari contoh soal konfigurasi elektron untuk berbagai unsur, termasuk unsur-unsur periode pertama hingga ketiga dalam tabel periodik. Selain itu, kita akan membahas aturan Hund, sebuah aturan tambahan yang membantu kita menentukan penempatan elektron pada orbital yang memiliki tingkat energi yang sama. Dengan memahami konsep-konsep ini, kita akan dapat memahami bagaimana konfigurasi elektron menentukan sifat kimia dan fisika suatu unsur.
Konfigurasi Elektron Aufbau
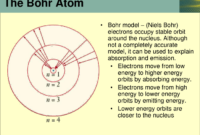
Konfigurasi elektron menggambarkan bagaimana elektron tersusun dalam atom. Prinsip Aufbau adalah aturan yang membantu kita memahami cara menentukan konfigurasi elektron atom. Prinsip ini membantu kita memprediksi bagaimana elektron menempati orbital atom dalam suatu atom, berdasarkan tingkat energi orbital dan aturan Hund.
Prinsip Aufbau
Prinsip Aufbau menyatakan bahwa elektron dalam atom akan mengisi orbital dengan tingkat energi terendah terlebih dahulu. Orbital atom disusun berdasarkan tingkat energinya, dengan orbital yang memiliki tingkat energi lebih rendah diisi terlebih dahulu. Urutan pengisian orbital ini dapat divisualisasikan dengan diagram Aufbau.
Berikut adalah langkah-langkah yang dapat Anda ikuti untuk menentukan konfigurasi elektron suatu atom menggunakan prinsip Aufbau:
- Tentukan nomor atom unsur tersebut.
- Tentukan jumlah elektron yang ada di atom tersebut. Nomor atom sama dengan jumlah elektron dalam atom netral.
- Ikuti diagram Aufbau untuk menentukan urutan pengisian orbital.
- Isi orbital dengan elektron, dimulai dari orbital dengan tingkat energi terendah.
- Ingatlah bahwa setiap orbital hanya dapat menampung maksimal dua elektron, dan elektron-elektron tersebut harus memiliki spin yang berlawanan (aturan Pauli).
- Jika ada beberapa orbital dengan tingkat energi yang sama, elektron akan mengisi orbital tersebut secara terpisah sebelum berpasangan (aturan Hund).
Contoh Konfigurasi Elektron
Mari kita lihat beberapa contoh konfigurasi elektron atom berdasarkan prinsip Aufbau:
- Hidrogen (H): Nomor atom hidrogen adalah 1, artinya atom hidrogen memiliki satu elektron. Konfigurasi elektronnya adalah 1s1. Elektron tunggal hidrogen menempati orbital 1s.
- Helium (He): Helium memiliki nomor atom 2, sehingga memiliki dua elektron. Konfigurasi elektronnya adalah 1s2. Kedua elektron helium menempati orbital 1s.
- Karbon (C): Karbon memiliki nomor atom 6, artinya memiliki enam elektron. Konfigurasi elektronnya adalah 1s22s22p2. Dua elektron pertama mengisi orbital 1s, dua elektron berikutnya mengisi orbital 2s, dan dua elektron terakhir mengisi dua dari tiga orbital 2p.
- Nitrogen (N): Nitrogen memiliki nomor atom 7, artinya memiliki tujuh elektron. Konfigurasi elektronnya adalah 1s22s22p3. Tiga elektron terakhir nitrogen menempati tiga orbital 2p secara terpisah, sesuai dengan aturan Hund.
- Oksigen (O): Oksigen memiliki nomor atom 8, artinya memiliki delapan elektron. Konfigurasi elektronnya adalah 1s22s22p4. Dua dari tiga orbital 2p diisi dengan dua elektron, dan satu orbital 2p lainnya diisi dengan satu elektron.
Tabel Konfigurasi Elektron
Tabel berikut menunjukkan konfigurasi elektron atom dari unsur-unsur periode pertama hingga periode ketiga dalam tabel periodik.
| Unsur | Nomor Atom | Konfigurasi Elektron |
|---|---|---|
| Hidrogen (H) | 1 | 1s1 |
| Helium (He) | 2 | 1s2 |
| Litium (Li) | 3 | 1s22s1 |
| Berilium (Be) | 4 | 1s22s2 |
| Boron (B) | 5 | 1s22s22p1 |
| Karbon (C) | 6 | 1s22s22p2 |
| Nitrogen (N) | 7 | 1s22s22p3 |
| Oksigen (O) | 8 | 1s22s22p4 |
| Fluor (F) | 9 | 1s22s22p5 |
| Neon (Ne) | 10 | 1s22s22p6 |
| Natrium (Na) | 11 | 1s22s22p63s1 |
| Magnesium (Mg) | 12 | 1s22s22p63s2 |
| Aluminium (Al) | 13 | 1s22s22p63s23p1 |
| Silikon (Si) | 14 | 1s22s22p63s23p2 |
| Fosfor (P) | 15 | 1s22s22p63s23p3 |
| Sulfur (S) | 16 | 1s22s22p63s23p4 |
| Klorin (Cl) | 17 | 1s22s22p63s23p5 |
| Argon (Ar) | 18 | 1s22s22p63s23p6 |
Hubungan Konfigurasi Elektron dengan Sifat Unsur
Konfigurasi elektron, yang menggambarkan bagaimana elektron tersusun dalam atom, memainkan peran penting dalam menentukan sifat-sifat kimia dan fisika suatu unsur. Dengan memahami konfigurasi elektron, kita dapat menjelaskan mengapa unsur-unsur tertentu memiliki sifat-sifat yang khas, seperti keelektronegatifan, jari-jari atom, dan energi ionisasi. Sifat-sifat ini memengaruhi bagaimana unsur-unsur berinteraksi dengan unsur lain dan membentuk senyawa.
Keelektronegatifan
Keelektronegatifan adalah ukuran kemampuan suatu atom untuk menarik elektron dalam ikatan kimia. Semakin tinggi keelektronegatifan suatu atom, semakin kuat ia menarik elektron. Konfigurasi elektron dapat membantu kita memahami keelektronegatifan. Atom-atom dengan konfigurasi elektron yang hampir lengkap di kulit terluarnya cenderung memiliki keelektronegatifan yang tinggi karena mereka “ingin” mendapatkan elektron untuk mencapai konfigurasi elektron stabil seperti gas mulia.
- Misalnya, fluor (F) memiliki konfigurasi elektron 2, 7, sehingga hanya membutuhkan satu elektron lagi untuk mencapai konfigurasi elektron gas mulia neon (Ne) dengan 2, 8. Hal ini menjadikan fluor sebagai unsur yang sangat elektronegatif.
- Sebaliknya, atom-atom dengan hanya beberapa elektron di kulit terluarnya cenderung memiliki keelektronegatifan yang rendah. Mereka cenderung kehilangan elektron untuk mencapai konfigurasi elektron stabil.
Jari-jari Atom
Jari-jari atom adalah jarak antara inti atom dan elektron terluar. Konfigurasi elektron dapat membantu kita memahami jari-jari atom. Semakin banyak kulit elektron dalam suatu atom, semakin besar jari-jari atomnya. Hal ini karena elektron terluar berada lebih jauh dari inti. Selain itu, semakin banyak proton dalam inti atom, semakin kuat tarikan inti terhadap elektron, sehingga jari-jari atom menjadi lebih kecil.
- Misalnya, lithium (Li) memiliki konfigurasi elektron 2, 1 dan memiliki jari-jari atom yang lebih besar daripada berilium (Be) yang memiliki konfigurasi elektron 2, 2. Hal ini karena lithium memiliki satu kulit elektron, sedangkan berilium memiliki dua kulit elektron.
- Dalam satu periode, jari-jari atom cenderung menurun dari kiri ke kanan karena tarikan inti terhadap elektron terluar meningkat.
Energi Ionisasi
Energi ionisasi adalah energi minimum yang dibutuhkan untuk melepaskan satu elektron dari atom netral dalam keadaan gas. Konfigurasi elektron dapat membantu kita memahami energi ionisasi. Semakin mudah suatu atom melepaskan elektron, semakin rendah energi ionisasinya. Atom-atom dengan konfigurasi elektron yang hampir lengkap di kulit terluarnya cenderung memiliki energi ionisasi yang tinggi karena mereka “ingin” mempertahankan elektron untuk mencapai konfigurasi elektron stabil.
- Misalnya, helium (He) memiliki konfigurasi elektron 2 dan memiliki energi ionisasi yang sangat tinggi karena konfigurasi elektronnya sudah stabil.
- Sebaliknya, atom-atom dengan hanya beberapa elektron di kulit terluarnya cenderung memiliki energi ionisasi yang rendah. Mereka cenderung kehilangan elektron untuk mencapai konfigurasi elektron stabil.
Hubungan Konfigurasi Elektron dengan Sifat-sifat Unsur Golongan Utama
| Golongan | Konfigurasi Elektron | Keelektronegatifan | Jari-jari Atom | Energi Ionisasi |
|---|---|---|---|---|
| Golongan 1 (Logam Alkali) | ns1 | Rendah | Besar | Rendah |
| Golongan 2 (Logam Alkali Tanah) | ns2 | Rendah | Sedang | Sedang |
| Golongan 13 (Boron) | ns2np1 | Sedang | Sedang | Sedang |
| Golongan 14 (Karbon) | ns2np2 | Sedang | Sedang | Sedang |
| Golongan 15 (Nitrogen) | ns2np3 | Sedang | Sedang | Tinggi |
| Golongan 16 (Oksigen) | ns2np4 | Tinggi | Sedang | Tinggi |
| Golongan 17 (Halogen) | ns2np5 | Tinggi | Kecil | Tinggi |
| Golongan 18 (Gas Mulia) | ns2np6 | Sangat rendah | Kecil | Sangat tinggi |
Tabel di atas menunjukkan hubungan antara konfigurasi elektron dengan sifat-sifat unsur golongan utama. Kita dapat melihat bahwa unsur-unsur dalam golongan yang sama memiliki konfigurasi elektron yang serupa, sehingga mereka memiliki sifat-sifat kimia yang mirip. Misalnya, logam alkali (golongan 1) memiliki konfigurasi elektron ns1 dan memiliki keelektronegatifan yang rendah, jari-jari atom yang besar, dan energi ionisasi yang rendah.
Aplikasi Konfigurasi Elektron: Contoh Soal Konfigurasi Elektron Aufbau
Konfigurasi elektron tidak hanya membantu kita memahami bagaimana elektron tersusun dalam atom, tetapi juga memberikan pemahaman mendalam tentang bagaimana atom berinteraksi satu sama lain, membentuk ikatan kimia, dan menghasilkan reaksi kimia. Dengan memahami konfigurasi elektron, kita dapat memprediksi sifat kimia suatu unsur, memahami bagaimana unsur-unsur membentuk senyawa, dan bahkan menjelaskan bagaimana reaksi kimia berlangsung.
Penjelasan Reaksi Kimia dan Pembentukan Ikatan Kimia
Konfigurasi elektron membantu kita memahami bagaimana atom berinteraksi satu sama lain dalam reaksi kimia. Atom cenderung mencapai konfigurasi elektron yang stabil, mirip dengan gas mulia, dengan kulit terluar penuh. Untuk mencapai stabilitas ini, atom dapat berbagi, kehilangan, atau mendapatkan elektron, membentuk ikatan kimia.
- Ikatan ionik terbentuk ketika satu atom kehilangan elektron dan atom lainnya mendapatkan elektron, membentuk ion bermuatan berlawanan yang saling tarik menarik. Misalnya, natrium (Na) memiliki konfigurasi elektron 2, 8, 1, dan cenderung kehilangan satu elektron untuk mencapai konfigurasi elektron yang stabil seperti neon (Ne), 2, 8. Klorin (Cl) memiliki konfigurasi elektron 2, 8, 7, dan cenderung mendapatkan satu elektron untuk mencapai konfigurasi elektron yang stabil seperti argon (Ar), 2, 8, 8. Reaksi antara natrium dan klorin menghasilkan natrium klorida (NaCl), garam dapur, dengan ikatan ionik.
- Ikatan kovalen terbentuk ketika dua atom berbagi elektron untuk mencapai konfigurasi elektron yang stabil. Misalnya, atom hidrogen (H) memiliki konfigurasi elektron 1, dan cenderung berbagi satu elektron dengan atom hidrogen lainnya untuk membentuk molekul hidrogen (H2), dengan konfigurasi elektron stabil 2.
Aplikasi Konfigurasi Elektron dalam Bidang Kimia
Konfigurasi elektron memiliki berbagai aplikasi penting dalam bidang kimia, membantu kita memahami berbagai fenomena kimia.
- Struktur Lewis: Konfigurasi elektron membantu kita menggambarkan struktur Lewis suatu molekul, yang menunjukkan bagaimana atom-atom terhubung dalam molekul dan pasangan elektron bebas yang ada. Misalnya, struktur Lewis untuk air (H2O) menunjukkan bahwa atom oksigen (O) berbagi dua elektron dengan dua atom hidrogen (H), membentuk dua ikatan kovalen, dan memiliki dua pasangan elektron bebas.
- Jenis Ikatan: Konfigurasi elektron membantu kita menentukan jenis ikatan yang terbentuk antara atom-atom. Dengan menganalisis jumlah elektron valensi dan konfigurasi elektron atom-atom yang terlibat, kita dapat menentukan apakah ikatan yang terbentuk adalah ikatan ionik, kovalen, atau logam.
- Reaksi Redoks: Konfigurasi elektron membantu kita memahami reaksi redoks, di mana terjadi transfer elektron antara atom-atom. Dalam reaksi redoks, satu atom kehilangan elektron (teroksidasi) dan atom lainnya mendapatkan elektron (tereduksi). Konfigurasi elektron membantu kita mengidentifikasi atom mana yang akan teroksidasi dan atom mana yang akan tereduksi dalam suatu reaksi redoks.
Contoh Soal
Berikut contoh soal yang membahas aplikasi konfigurasi elektron dalam reaksi kimia:
| Soal | Pembahasan |
|---|---|
| Tentukan jenis ikatan yang terbentuk dalam molekul karbon dioksida (CO2). | Karbon (C) memiliki konfigurasi elektron 2, 4, dan oksigen (O) memiliki konfigurasi elektron 2, 6. Karbon membutuhkan 4 elektron untuk mencapai konfigurasi elektron stabil seperti neon (Ne), 2, 8, sedangkan oksigen membutuhkan 2 elektron untuk mencapai konfigurasi elektron stabil seperti neon (Ne), 2, 8. Dalam CO2, atom karbon berbagi dua elektron dengan masing-masing atom oksigen, membentuk dua ikatan kovalen rangkap. Oleh karena itu, ikatan yang terbentuk dalam CO2 adalah ikatan kovalen. |
Pengecualian pada Prinsip Aufbau

Prinsip Aufbau, yang menyatakan bahwa elektron mengisi orbital dengan energi terendah terlebih dahulu, merupakan aturan dasar dalam menentukan konfigurasi elektron suatu atom. Namun, terdapat beberapa pengecualian pada prinsip ini. Pengecualian ini terjadi karena faktor stabilitas elektron, di mana atom berusaha mencapai konfigurasi elektron yang lebih stabil dengan mengisi orbital yang setengah penuh atau penuh.
Alasan Terjadinya Pengecualian
Pengecualian pada prinsip Aufbau terjadi karena beberapa faktor, termasuk:
- Stabilitas Orbital Setengah Penuh dan Penuh: Orbital yang setengah penuh atau penuh memiliki stabilitas yang lebih tinggi dibandingkan dengan orbital yang hanya terisi sebagian. Hal ini karena elektron-elektron dalam orbital yang setengah penuh atau penuh memiliki interaksi antar elektron yang lebih kuat, sehingga menghasilkan energi yang lebih rendah.
- Penurunan Energi Orbital: Dalam beberapa kasus, orbital dengan energi yang lebih tinggi dapat memiliki energi yang lebih rendah dibandingkan dengan orbital dengan energi yang lebih rendah. Hal ini terjadi karena interaksi antar elektron dalam orbital yang lebih tinggi.
Contoh Unsur yang Menunjukkan Pengecualian, Contoh soal konfigurasi elektron aufbau
Beberapa contoh unsur yang menunjukkan pengecualian pada prinsip Aufbau adalah kromium (Cr) dan tembaga (Cu).
Konfigurasi Elektron Kromium (Cr)
Konfigurasi elektron kromium (Cr) yang diharapkan berdasarkan prinsip Aufbau adalah [Ar] 3d4 4s2. Namun, konfigurasi elektron yang sebenarnya adalah [Ar] 3d5 4s1.
Pengecualian ini terjadi karena orbital 3d yang setengah penuh pada kromium lebih stabil dibandingkan dengan orbital 3d yang terisi sebagian.
Diagram Orbital Kromium (Cr)
Berikut adalah diagram orbital yang menunjukkan konfigurasi elektron atom kromium (Cr):

Contoh soal konfigurasi elektron aufbau biasanya melibatkan penentuan letak elektron pada kulit dan subkulit suatu atom. Untuk memudahkan visualisasi, kamu bisa menggunakan diagram batang. Nah, kalau kamu ingin latihan soal diagram batang, bisa cek contoh soal diagram batang dan jawabannya di link ini.
Dengan memahami diagram batang, kamu akan lebih mudah memahami konsep konfigurasi elektron dan menentukan posisi elektron dalam atom.
Konfigurasi Elektron Tembaga (Cu)
Konfigurasi elektron tembaga (Cu) yang diharapkan berdasarkan prinsip Aufbau adalah [Ar] 3d9 4s2. Namun, konfigurasi elektron yang sebenarnya adalah [Ar] 3d10 4s1.
Pengecualian ini terjadi karena orbital 3d yang penuh pada tembaga lebih stabil dibandingkan dengan orbital 3d yang terisi sebagian.
Diagram Orbital Tembaga (Cu)
Berikut adalah diagram orbital yang menunjukkan konfigurasi elektron atom tembaga (Cu):

Konfigurasi Elektron dan Tabel Periodik
Konfigurasi elektron, yang menggambarkan bagaimana elektron tersusun dalam atom, memiliki hubungan erat dengan posisi unsur dalam tabel periodik. Tabel periodik adalah peta yang mengatur unsur-unsur berdasarkan sifat kimia dan fisik mereka. Dengan memahami hubungan ini, kita dapat memprediksi sifat unsur dan memahami bagaimana sifat tersebut berubah seiring pergerakan dalam tabel periodik.
Hubungan Konfigurasi Elektron dengan Posisi Unsur dalam Tabel Periodik
Konfigurasi elektron suatu unsur menentukan bagaimana unsur tersebut bereaksi dengan unsur lainnya. Posisi suatu unsur dalam tabel periodik menunjukkan konfigurasi elektron terluarnya, yang dikenal sebagai elektron valensi. Elektron valensi bertanggung jawab untuk ikatan kimia dan menentukan sifat kimia suatu unsur.
- Golongan: Unsur-unsur dalam satu golongan memiliki jumlah elektron valensi yang sama. Misalnya, semua unsur dalam golongan 1 (alkali) memiliki satu elektron valensi dalam kulit terluar mereka. Ini berarti bahwa unsur-unsur dalam golongan yang sama memiliki sifat kimia yang serupa.
- Periode: Unsur-unsur dalam satu periode memiliki jumlah kulit elektron yang sama. Misalnya, semua unsur dalam periode 2 memiliki dua kulit elektron. Jumlah elektron valensi dalam periode berbeda, yang menghasilkan variasi sifat kimia.
Tren Konfigurasi Elektron dalam Tabel Periodik
Ada tren yang dapat diamati dalam konfigurasi elektron unsur-unsur dalam tabel periodik.
- Jumlah Kulit Elektron: Seiring pergerakan ke bawah tabel periodik, jumlah kulit elektron dalam atom meningkat. Ini berarti bahwa unsur-unsur dalam periode yang lebih tinggi memiliki elektron valensi yang lebih jauh dari inti atom.
- Jumlah Elektron Valensi: Seiring pergerakan ke kanan dalam tabel periodik, jumlah elektron valensi meningkat. Misalnya, golongan 1 memiliki satu elektron valensi, golongan 2 memiliki dua elektron valensi, dan seterusnya. Peningkatan jumlah elektron valensi menyebabkan perubahan sifat kimia, seperti keelektronegatifan dan ukuran atom.
Diagram Tabel Periodik yang Menunjukkan Konfigurasi Elektron
Diagram tabel periodik yang menunjukkan konfigurasi elektron dapat membantu kita memahami hubungan antara konfigurasi elektron dan posisi unsur dalam tabel periodik. Diagram ini biasanya menunjukkan konfigurasi elektron terluar untuk setiap unsur.
| Golongan | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|
| Periode | ||||||||
| 1 | H: 1s1 | He: 1s2 | ||||||
| 2 | Li: 2s1 | Be: 2s2 | B: 2s22p1 | C: 2s22p2 | N: 2s22p3 | O: 2s22p4 | F: 2s22p5 | Ne: 2s22p6 |
| 3 | Na: 3s1 | Mg: 3s2 | Al: 3s23p1 | Si: 3s23p2 | P: 3s23p3 | S: 3s23p4 | Cl: 3s23p5 | Ar: 3s23p6 |
Diagram ini menunjukkan bahwa unsur-unsur dalam golongan yang sama memiliki konfigurasi elektron valensi yang sama, seperti Li dan Na yang sama-sama memiliki satu elektron valensi dalam kulit terluar mereka. Diagram ini juga menunjukkan bahwa unsur-unsur dalam periode yang sama memiliki jumlah kulit elektron yang sama, seperti Li dan Be yang sama-sama memiliki dua kulit elektron.
Penutupan Akhir
Konfigurasi elektron merupakan konsep fundamental dalam kimia yang membantu kita memahami sifat-sifat atom dan molekul. Dengan memahami prinsip Aufbau, aturan Hund, dan bagaimana konfigurasi elektron memengaruhi sifat-sifat kimia dan fisika, kita dapat memprediksi dan menjelaskan perilaku kimia berbagai zat. Jadi, mari kita selami dunia konfigurasi elektron dan temukan keajaiban yang tersembunyi di balik susunan elektron dalam atom!