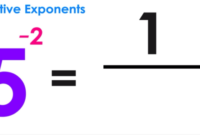Cara menghitung ion dalam senyawa kimia mungkin terdengar rumit, tetapi sebenarnya tidak sesulit yang dibayangkan. Dengan memahami konsep dasar ion dan aturan sederhana, Anda dapat menghitung jumlah ion dalam senyawa kimia dengan mudah. Bayangkan seperti memecahkan teka-teki kimia, di mana setiap ion memiliki peran penting dalam membentuk struktur dan sifat suatu senyawa.
Ion adalah atom atau kelompok atom yang memiliki muatan listrik. Mereka terbentuk ketika atom kehilangan atau mendapatkan elektron. Ion positif, atau kation, terbentuk ketika atom kehilangan elektron, sedangkan ion negatif, atau anion, terbentuk ketika atom mendapatkan elektron. Senyawa ionik terbentuk dari ikatan antara ion positif dan ion negatif. Contoh senyawa ionik yang umum adalah garam dapur (NaCl), yang terdiri dari ion natrium positif (Na+) dan ion klorida negatif (Cl-).
Pengertian Ion: Cara Menghitung Ion
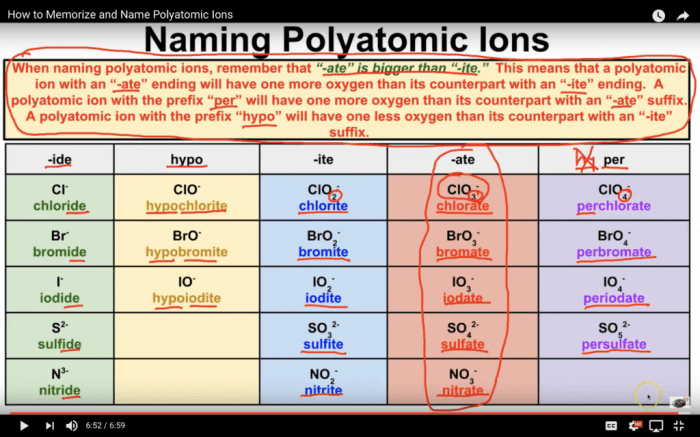
Ion adalah atom atau molekul yang memiliki muatan listrik karena jumlah elektronnya tidak sama dengan jumlah protonnya. Ion terbentuk ketika atom atau molekul kehilangan atau mendapatkan elektron.
Contoh Senyawa Ionik
Senyawa ionik adalah senyawa yang terbentuk dari ikatan ion, yaitu ikatan yang terjadi antara ion positif dan ion negatif. Contoh senyawa ionik adalah garam dapur (NaCl). Garam dapur terbentuk dari ion natrium (Na+) dan ion klorida (Cl-), yang saling tarik-menarik karena muatan yang berlawanan.
Perbedaan Ion Positif dan Ion Negatif
| Sifat | Ion Positif (Kation) | Ion Negatif (Anion) |
|---|---|---|
| Muatan | Positif (+) | Negatif (-) |
| Jumlah Elektron | Lebih sedikit dari jumlah proton | Lebih banyak dari jumlah proton |
| Cara Pembentukan | Kehilangan elektron | Mendapatkan elektron |
| Contoh | Na+, Ca2+, Fe3+ | Cl-, O2-, S2- |
Aplikasi Menghitung Jumlah Ion

Menghitung jumlah ion memiliki aplikasi yang luas di berbagai bidang, terutama dalam ilmu kimia, biologi, dan farmasi. Kemampuan untuk menentukan jumlah ion dalam suatu sampel memungkinkan kita untuk memahami komposisi, sifat, dan perilaku suatu zat atau sistem.
Analisis Air
Salah satu aplikasi penting menghitung jumlah ion adalah dalam analisis air. Air yang kita konsumsi dan gunakan sehari-hari mengandung berbagai macam ion, seperti kalsium (Ca2+), magnesium (Mg2+), natrium (Na+), klorida (Cl–), dan sulfat (SO42-).
- Konsentrasi ion-ion ini dapat memengaruhi kualitas air dan kesehatan manusia. Misalnya, kadar kalsium dan magnesium yang tinggi dapat menyebabkan air keras, yang dapat menyebabkan masalah pada peralatan rumah tangga dan menimbulkan masalah kesehatan.
- Untuk menentukan kualitas air, dilakukan analisis kimia yang meliputi penentuan konsentrasi berbagai ion di dalamnya. Analisis ini biasanya dilakukan dengan menggunakan metode spektrofotometri atau titrasi.
Proses Titrasi, Cara menghitung ion
Titrasi adalah teknik kimia yang digunakan untuk menentukan konsentrasi suatu larutan dengan menggunakan larutan standar dengan konsentrasi yang diketahui. Titrasi sering digunakan untuk menentukan konsentrasi ion dalam suatu sampel.
- Dalam titrasi, larutan standar ditambahkan secara bertahap ke dalam sampel yang tidak diketahui konsentrasinya. Reaksi kimia antara larutan standar dan sampel akan menyebabkan perubahan warna atau pH larutan.
- Dengan mengetahui volume larutan standar yang ditambahkan dan reaksi kimia yang terjadi, kita dapat menghitung konsentrasi ion dalam sampel.
Penutupan Akhir

Memahami cara menghitung jumlah ion dalam suatu senyawa merupakan dasar penting dalam mempelajari kimia. Kemampuan ini memungkinkan kita untuk memahami sifat-sifat senyawa kimia, meramalkan reaksi kimia, dan bahkan mengembangkan teknologi baru. Dengan mempelajari konsep dasar ion dan mengikuti langkah-langkah yang tepat, Anda dapat dengan mudah menghitung jumlah ion dalam berbagai senyawa kimia.