Contoh soal asam karboksilat – Asam karboksilat, senyawa organik yang memiliki gugus karboksil (-COOH), merupakan topik penting dalam kimia organik. Senyawa ini berperan penting dalam kehidupan sehari-hari dan industri. Mulai dari pembuatan sabun, plastik, hingga obat-obatan, asam karboksilat hadir dalam berbagai aplikasi.
Untuk menguji pemahamanmu tentang asam karboksilat, mari kita bahas beberapa contoh soal yang mengulas tentang penamaan, sifat fisika dan kimia, serta kegunaan asam karboksilat. Soal-soal ini dirancang untuk mengasah kemampuanmu dalam memahami konsep dan penerapan asam karboksilat dalam berbagai bidang.
Pengertian Asam Karboksilat
Asam karboksilat merupakan senyawa organik yang memiliki gugus fungsi karboksil (-COOH). Gugus karboksil ini terdiri dari atom karbon yang terikat pada atom oksigen melalui ikatan rangkap dua, dan juga terikat pada gugus hidroksil (-OH). Asam karboksilat memiliki peran penting dalam berbagai bidang, mulai dari industri kimia hingga biologi.
Struktur Asam Karboksilat
Asam karboksilat memiliki struktur dasar yang terdiri dari gugus karboksil (-COOH) yang terikat pada rantai karbon. Contoh struktur asam karboksilat sederhana adalah asam asetat (CH3COOH). Asam asetat memiliki gugus metil (CH3) yang terikat pada gugus karboksil.
Penamaan asam karboksilat umumnya menggunakan akhiran “-oat” untuk nama asamnya. Misalnya, asam asetat (CH3COOH) dinamai berdasarkan gugus metilnya (CH3) dengan penambahan akhiran “-oat”.
Sifat Asam Karboksilat
Asam karboksilat memiliki beberapa sifat umum yang membedakannya dari senyawa organik lainnya.
Titik Didih
Asam karboksilat memiliki titik didih yang relatif tinggi dibandingkan dengan senyawa organik lainnya dengan berat molekul yang sama. Hal ini disebabkan oleh ikatan hidrogen yang kuat antara molekul asam karboksilat. Ikatan hidrogen ini terbentuk antara atom hidrogen pada gugus hidroksil (-OH) dan atom oksigen pada gugus karboksil (-COOH) dari molekul asam karboksilat lainnya.
Kelarutan
Kelarutan asam karboksilat dalam air dipengaruhi oleh panjang rantai karbonnya. Asam karboksilat dengan rantai karbon pendek, seperti asam format (HCOOH) dan asam asetat (CH3COOH), larut dalam air. Namun, asam karboksilat dengan rantai karbon panjang, seperti asam stearat (CH3(CH2)16COOH), tidak larut dalam air. Hal ini karena gugus hidrokarbon pada rantai karbon panjang bersifat nonpolar, sedangkan air bersifat polar.
Keasaman
Asam karboksilat bersifat asam lemah. Hal ini disebabkan oleh gugus karboksil (-COOH) yang dapat melepaskan ion hidrogen (H+) dalam larutan. Keasaman asam karboksilat dipengaruhi oleh gugus substituen yang terikat pada rantai karbon. Gugus substituen yang menarik elektron, seperti gugus halogen (F, Cl, Br, I), akan meningkatkan keasaman asam karboksilat.
Tata Nama Asam Karboksilat
Asam karboksilat merupakan senyawa organik yang memiliki gugus fungsi karboksil (-COOH). Tata nama asam karboksilat memiliki beberapa aturan yang perlu dipahami untuk memudahkan identifikasi dan pembedaannya. Aturan penamaan ini didasarkan pada IUPAC (International Union of Pure and Applied Chemistry) dan juga nama trivial yang telah digunakan secara tradisional.
Penamaan Asam Karboksilat Alifatik dan Siklik
Asam karboksilat alifatik adalah asam karboksilat yang rantai karbonnya tidak membentuk cincin, sedangkan asam karboksilat siklik adalah asam karboksilat yang rantai karbonnya membentuk cincin. Penamaan kedua jenis asam karboksilat ini menggunakan aturan IUPAC dan nama trivial.
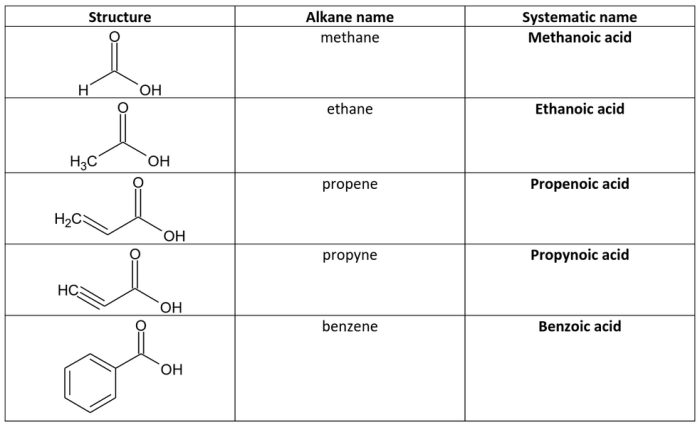
- Aturan IUPAC: Penamaan asam karboksilat alifatik dan siklik berdasarkan aturan IUPAC menggunakan akhiran “-oat” untuk nama asamnya. Nama rantai karbon utama yang terikat pada gugus karboksil ditambah dengan akhiran “-oat” dan diawali dengan kata “asam”. Contohnya, asam metanoat (HCOOH), asam etanoat (CH3COOH), asam propanoat (CH3CH2COOH), dan asam sikloheksanoat (C6H11COOH).
- Nama Trivial: Penamaan asam karboksilat alifatik dan siklik menggunakan nama trivial yang telah digunakan secara tradisional. Nama trivial ini biasanya lebih pendek dan mudah diingat dibandingkan dengan nama IUPAC. Contohnya, asam metanoat disebut juga asam format, asam etanoat disebut juga asam asetat, asam propanoat disebut juga asam propionat, dan asam sikloheksanoat disebut juga asam sikloheksanoat.
Penamaan Asam Karboksilat dengan Gugus Fungsi Lain
Asam karboksilat yang memiliki gugus fungsi lain selain gugus karboksil, penamaannya mengikuti aturan IUPAC. Gugus fungsi lain yang terikat pada rantai karbon utama akan diberi nomor sesuai dengan posisinya relatif terhadap gugus karboksil. Gugus karboksil selalu diberi nomor 1.
Contohnya, asam 2-hidroksipropanoat (CH3CH(OH)COOH) memiliki gugus hidroksil (-OH) yang terikat pada atom karbon nomor 2.
Tabel Nama IUPAC dan Nama Trivial Asam Karboksilat
Berikut adalah tabel yang berisi nama IUPAC dan nama trivial dari 5 asam karboksilat yang berbeda:
| Nama IUPAC | Nama Trivial |
|---|---|
| Asam metanoat | Asam format |
| Asam etanoat | Asam asetat |
| Asam propanoat | Asam propionat |
| Asam butanoat | Asam butirat |
| Asam pentanoat | Asam valerat |
Sifat Fisika Asam Karboksilat: Contoh Soal Asam Karboksilat
Asam karboksilat merupakan senyawa organik yang memiliki gugus fungsi karboksil (-COOH). Gugus karboksil ini memberikan sifat khas pada asam karboksilat, termasuk sifat fisikanya. Salah satu sifat penting yang dipengaruhi oleh gugus karboksil adalah titik didih dan kelarutan asam karboksilat.
Pengaruh Gugus Karboksil terhadap Titik Didih dan Kelarutan Asam Karboksilat, Contoh soal asam karboksilat
Gugus karboksil memiliki pengaruh yang signifikan terhadap titik didih dan kelarutan asam karboksilat. Hal ini disebabkan oleh kemampuan gugus karboksil untuk membentuk ikatan hidrogen. Ikatan hidrogen merupakan ikatan antarmolekul yang kuat, sehingga membutuhkan energi yang lebih besar untuk memisahkan molekul-molekul asam karboksilat. Akibatnya, asam karboksilat memiliki titik didih yang lebih tinggi dibandingkan dengan senyawa organik lain yang memiliki jumlah atom karbon yang sama.
Perbandingan Titik Didih Asam Karboksilat dengan Senyawa Organik Lainnya
Berikut adalah contoh perbandingan titik didih asam karboksilat dengan senyawa organik lain yang memiliki jumlah atom karbon yang sama:
- Asam asetat (CH3COOH) memiliki titik didih 118°C, sedangkan etanol (CH3CH2OH) memiliki titik didih 78°C.
- Asam propionat (CH3CH2COOH) memiliki titik didih 141°C, sedangkan propanol (CH3CH2CH2OH) memiliki titik didih 97°C.
Dari perbandingan di atas, terlihat bahwa asam karboksilat memiliki titik didih yang lebih tinggi dibandingkan dengan alkohol yang memiliki jumlah atom karbon yang sama. Hal ini disebabkan oleh ikatan hidrogen yang lebih kuat pada asam karboksilat.
Hubungan Struktur Asam Karboksilat dengan Kelarutannya dalam Air
Kelarutan asam karboksilat dalam air juga dipengaruhi oleh gugus karboksil. Gugus karboksil dapat membentuk ikatan hidrogen dengan molekul air. Semakin banyak gugus karboksil dalam suatu molekul asam karboksilat, semakin banyak ikatan hidrogen yang dapat dibentuk, sehingga semakin mudah larut dalam air.
Berikut adalah diagram yang menunjukkan hubungan antara struktur asam karboksilat dengan kelarutannya dalam air:
| Struktur Asam Karboksilat | Kelarutan dalam Air |
|---|---|
| Asam format (HCOOH) | Sangat larut |
| Asam asetat (CH3COOH) | Larut |
| Asam propionat (CH3CH2COOH) | Sedikit larut |
| Asam butirat (CH3(CH2)2COOH) | Tidak larut |
Dari diagram di atas, terlihat bahwa asam karboksilat dengan rantai karbon pendek lebih mudah larut dalam air dibandingkan dengan asam karboksilat dengan rantai karbon panjang. Hal ini disebabkan oleh semakin banyaknya gugus hidrokarbon (nonpolar) dalam asam karboksilat dengan rantai karbon panjang, sehingga mengurangi kemampuannya untuk membentuk ikatan hidrogen dengan molekul air.
Sifat Kimia Asam Karboksilat
Asam karboksilat merupakan senyawa organik yang memiliki gugus fungsi karboksil (-COOH). Gugus fungsi ini memberikan sifat-sifat khas yang membedakan asam karboksilat dari senyawa organik lainnya. Salah satu sifat yang paling menonjol adalah kemampuannya untuk bereaksi dengan berbagai senyawa, membentuk berbagai produk penting.
Reaksi dengan Basa
Asam karboksilat bersifat asam lemah, artinya mereka hanya sebagian terionisasi dalam larutan air. Ketika asam karboksilat direaksikan dengan basa, seperti NaOH atau KOH, terjadi reaksi netralisasi yang menghasilkan garam karboksilat dan air. Garam karboksilat lebih mudah larut dalam air dibandingkan dengan asam karboksilat asalnya.
R-COOH + NaOH → R-COO-Na+ + H2O
Contohnya, asam asetat (CH3COOH) bereaksi dengan NaOH membentuk natrium asetat (CH3COONa) dan air.
Contoh soal asam karboksilat biasanya menanyakan tentang penamaan, sifat, dan reaksi senyawa tersebut. Nah, kalau kamu lagi belajar tentang metode numerik, bisa nih cek contoh soal metode numerik dan jawabannya untuk melatih kemampuanmu dalam menyelesaikan soal-soal numerik. Setelah itu, kamu bisa kembali berlatih soal asam karboksilat dengan lebih percaya diri, kan?
Reaksi dengan Alkohol
Asam karboksilat dapat bereaksi dengan alkohol membentuk ester melalui reaksi esterifikasi. Reaksi ini umumnya dikatalisis oleh asam kuat, seperti asam sulfat (H2SO4). Reaksi ini merupakan reaksi kesetimbangan, artinya produk dan reaktan berada dalam kesetimbangan dinamis.
R-COOH + R’-OH ⇌ R-COOR’ + H2O
Contohnya, asam asetat bereaksi dengan etanol membentuk etil asetat dan air.
Reaksi dengan Amina
Asam karboksilat dapat bereaksi dengan amina membentuk amida. Reaksi ini biasanya memerlukan pemanasan dan katalis asam. Amida merupakan senyawa yang memiliki ikatan amida, yaitu ikatan antara atom karbon dan atom nitrogen yang terikat pada gugus karbonil.
R-COOH + R’-NH2 ⇌ R-CONHR’ + H2O
Contohnya, asam asetat bereaksi dengan metilamina membentuk N-metilacetamida dan air.
Mekanisme Reaksi Esterifikasi
Mekanisme reaksi esterifikasi melibatkan serangkaian langkah, yang diawali dengan protonasi gugus karboksil oleh asam kuat. Protonasi ini membuat gugus karboksil lebih elektrofilik, sehingga lebih mudah diserang oleh alkohol. Kemudian, terjadi penambahan alkohol ke gugus karboksil yang terprotonasi, membentuk gugus tetrahedral intermediat. Akhirnya, gugus tetrahedral intermediat terdeprotonasi, menghasilkan ester dan air.
Mekanisme Reaksi Pembentukan Amida
Mekanisme reaksi pembentukan amida mirip dengan reaksi esterifikasi. Reaksi ini diawali dengan protonasi gugus karboksil oleh asam kuat. Protonasi ini membuat gugus karboksil lebih elektrofilik, sehingga lebih mudah diserang oleh amina. Kemudian, terjadi penambahan amina ke gugus karboksil yang terprotonasi, membentuk gugus tetrahedral intermediat. Akhirnya, gugus tetrahedral intermediat terdeprotonasi, menghasilkan amida dan air.
Kegunaan Asam Karboksilat
Asam karboksilat adalah senyawa organik yang memiliki gugus fungsi karboksil (-COOH). Gugus ini terdiri dari atom karbon yang terikat pada atom oksigen dengan ikatan rangkap, dan juga terikat pada gugus hidroksil (-OH). Asam karboksilat memiliki sifat asam lemah dan banyak ditemukan di alam, baik dalam bentuk bebas maupun dalam bentuk ester.
Asam karboksilat memiliki beragam kegunaan dalam kehidupan sehari-hari dan industri. Senyawa ini dapat digunakan sebagai bahan baku pembuatan berbagai produk, mulai dari makanan dan minuman hingga plastik dan obat-obatan.
Kegunaan Asam Karboksilat dalam Kehidupan Sehari-hari
Asam karboksilat banyak digunakan dalam kehidupan sehari-hari. Beberapa contohnya adalah:
- Asam asetat (CH3COOH), yang merupakan asam utama dalam cuka, digunakan sebagai pengawet makanan dan bumbu masak.
- Asam sitrat (C6H8O7), yang ditemukan dalam buah jeruk, digunakan sebagai asam dalam minuman dan makanan, serta sebagai bahan pengawet.
- Asam laktat (C3H6O3), yang diproduksi oleh bakteri dalam fermentasi susu, digunakan dalam pembuatan yogurt dan keju.
Kegunaan Asam Karboksilat dalam Industri
Asam karboksilat juga memiliki peran penting dalam industri. Beberapa contohnya adalah:
- Asam stearat (C18H36O2), yang merupakan asam lemak jenuh, digunakan dalam pembuatan sabun, lilin, dan kosmetik.
- Asam benzoat (C7H6O2), digunakan sebagai pengawet makanan dan minuman.
- Asam format (HCOOH), digunakan dalam industri tekstil dan kulit.
Asam Karboksilat sebagai Bahan Baku Pembuatan Plastik
Asam karboksilat digunakan sebagai bahan baku pembuatan berbagai jenis plastik. Contohnya adalah:
- Asam tereftalat (C8H6O4), digunakan dalam pembuatan plastik PET (polietilen tereftalat), yang banyak digunakan untuk botol minuman, pakaian, dan karpet.
- Asam akrilat (C3H4O2), digunakan dalam pembuatan plastik PMMA (polimetil metakrilat), yang dikenal sebagai akrilik, digunakan untuk kaca jendela, lampu, dan gigi palsu.
Asam Karboksilat sebagai Bahan Baku Pembuatan Sabun
Asam karboksilat merupakan bahan utama dalam pembuatan sabun. Sabun dibuat dengan mereaksikan asam lemak dengan basa kuat, seperti natrium hidroksida (NaOH) atau kalium hidroksida (KOH). Reaksi ini disebut dengan saponifikasi. Asam lemak yang umum digunakan dalam pembuatan sabun adalah asam stearat, asam palmitat, dan asam oleat.
Asam Karboksilat sebagai Bahan Baku Pembuatan Obat-obatan
Asam karboksilat juga digunakan sebagai bahan baku pembuatan berbagai jenis obat-obatan. Contohnya adalah:
- Asam asetilsalisilat (C9H8O4), yang lebih dikenal sebagai aspirin, digunakan sebagai obat penghilang rasa sakit dan pereda demam.
- Asam valproat (C8H16O2), digunakan sebagai obat antiepilepsi.
- Asam ibuprofen (C13H18O2), digunakan sebagai obat penghilang rasa sakit dan pereda demam.
Tabel Kegunaan Asam Karboksilat
| Nama Asam Karboksilat | Rumus Molekul | Kegunaan |
|---|---|---|
| Asam asetat | CH3COOH | Pengawet makanan, bumbu masak |
| Asam sitrat | C6H8O7 | Asam dalam minuman dan makanan, pengawet |
| Asam laktat | C3H6O3 | Pembuatan yogurt dan keju |
| Asam stearat | C18H36O2 | Pembuatan sabun, lilin, kosmetik |
| Asam benzoat | C7H6O2 | Pengawet makanan dan minuman |
| Asam format | HCOOH | Industri tekstil dan kulit |
| Asam tereftalat | C8H6O4 | Pembuatan plastik PET |
| Asam akrilat | C3H4O2 | Pembuatan plastik PMMA (akrilik) |
| Asam asetilsalisilat (Aspirin) | C9H8O4 | Obat penghilang rasa sakit dan pereda demam |
| Asam valproat | C8H16O2 | Obat antiepilepsi |
| Asam ibuprofen | C13H18O2 | Obat penghilang rasa sakit dan pereda demam |
Contoh Soal Asam Karboksilat
Asam karboksilat merupakan senyawa organik yang memiliki gugus fungsi karboksil (-COOH). Gugus fungsi ini memberikan sifat-sifat khas pada asam karboksilat, seperti keasaman dan kemampuan untuk bereaksi dengan berbagai senyawa lainnya.
Penamaan Asam Karboksilat
Penamaan asam karboksilat dapat dilakukan dengan menggunakan sistem IUPAC atau nama trivial. Sistem IUPAC menggunakan aturan penamaan yang baku, sedangkan nama trivial merupakan nama yang sudah umum digunakan.
- Penamaan IUPAC: Asam karboksilat diberi nama dengan mengganti akhiran -e pada nama alkana dengan -oat, dan kemudian ditambah kata “asam”. Contohnya, asam metanoat (HCOOH) berasal dari metana, asam etanoat (CH3COOH) berasal dari etana, dan asam propanoat (CH3CH2COOH) berasal dari propana.
- Nama Trivial: Asam karboksilat juga memiliki nama trivial yang sudah umum digunakan. Contohnya, asam metanoat dikenal sebagai asam format, asam etanoat dikenal sebagai asam asetat, dan asam propanoat dikenal sebagai asam propionat.
Sifat Fisika dan Kimia Asam Karboksilat
Asam karboksilat memiliki sifat fisika dan kimia yang khas, seperti titik didih, kelarutan, dan reaksi dengan basa.
- Titik Didih: Asam karboksilat memiliki titik didih yang relatif tinggi dibandingkan dengan senyawa organik lainnya dengan jumlah atom karbon yang sama. Hal ini disebabkan oleh ikatan hidrogen yang kuat antara molekul-molekul asam karboksilat.
- Kelarutan: Asam karboksilat dengan rantai karbon pendek (C1-C4) larut dalam air karena dapat membentuk ikatan hidrogen dengan molekul air. Namun, kelarutan asam karboksilat menurun seiring dengan meningkatnya panjang rantai karbon.
- Reaksi dengan Basa: Asam karboksilat bersifat asam dan dapat bereaksi dengan basa membentuk garam karboksilat dan air. Contohnya, reaksi asam asetat (CH3COOH) dengan natrium hidroksida (NaOH) menghasilkan natrium asetat (CH3COONa) dan air (H2O).
Kegunaan Asam Karboksilat
Asam karboksilat memiliki berbagai kegunaan dalam kehidupan sehari-hari dan industri.
- Asam asetat (CH3COOH) digunakan sebagai bahan baku dalam pembuatan cuka, plastik, dan serat sintetis.
- Asam sitrat (C6H8O7) merupakan asam organik yang terdapat dalam buah jeruk dan digunakan sebagai bahan pengawet makanan dan minuman.
- Asam benzoat (C7H6O2) digunakan sebagai bahan pengawet makanan dan minuman, serta sebagai bahan baku dalam pembuatan obat-obatan.
- Asam stearat (C18H36O2) merupakan asam lemak yang digunakan dalam pembuatan sabun, kosmetik, dan lilin.
Pembuatan Asam Karboksilat
Asam karboksilat merupakan senyawa organik yang memiliki gugus fungsi karboksil (-COOH). Gugus ini terdiri dari atom karbon yang terikat pada atom oksigen melalui ikatan rangkap dan atom hidroksil (-OH). Asam karboksilat memiliki sifat asam karena gugus karboksil dapat melepaskan ion hidrogen (H+) dalam larutan.
Pembuatan asam karboksilat dapat dilakukan melalui berbagai metode, seperti oksidasi aldehida, oksidasi alkana, dan hidrolisis ester. Berikut ini akan dibahas lebih lanjut mengenai metode-metode pembuatan asam karboksilat.
Oksidasi Aldehida
Oksidasi aldehida merupakan metode yang umum digunakan untuk menghasilkan asam karboksilat. Dalam reaksi ini, aldehida dioksidasi dengan menggunakan oksidator seperti kalium permanganat (KMnO4) atau kalium dikromat (K2Cr2O7) dalam suasana asam. Reaksi oksidasi ini akan memecah ikatan rangkap C=O pada aldehida dan menggantinya dengan gugus karboksil (-COOH).
Sebagai contoh, oksidasi etanal (CH3CHO) dengan menggunakan kalium permanganat (KMnO4) dalam suasana asam akan menghasilkan asam asetat (CH3COOH). Reaksi ini dapat digambarkan sebagai berikut:
CH3CHO + [O] → CH3COOH
Oksidasi Alkana
Oksidasi alkana merupakan metode yang lebih kompleks dibandingkan dengan oksidasi aldehida. Dalam reaksi ini, alkana dioksidasi dengan menggunakan oksidator kuat seperti kalium permanganat (KMnO4) atau asam kromat (H2CrO4) pada suhu dan tekanan tinggi. Reaksi ini akan memecah ikatan C-H pada alkana dan menggantinya dengan gugus karboksil (-COOH).
Sebagai contoh, oksidasi propana (CH3CH2CH3) dengan menggunakan kalium permanganat (KMnO4) pada suhu dan tekanan tinggi akan menghasilkan asam propanoat (CH3CH2COOH). Reaksi ini dapat digambarkan sebagai berikut:
CH3CH2CH3 + [O] → CH3CH2COOH
Hidrolisis Ester
Hidrolisis ester merupakan metode yang umum digunakan untuk menghasilkan asam karboksilat dan alkohol. Dalam reaksi ini, ester direaksikan dengan air (H2O) dalam suasana asam atau basa. Reaksi ini akan memecah ikatan ester dan menghasilkan asam karboksilat dan alkohol.
Sebagai contoh, hidrolisis metil asetat (CH3COOCH3) dengan menggunakan asam sulfat (H2SO4) akan menghasilkan asam asetat (CH3COOH) dan metanol (CH3OH). Reaksi ini dapat digambarkan sebagai berikut:
CH3COOCH3 + H2O → CH3COOH + CH3OH
Skema Reaksi Pembuatan Asam Karboksilat
Berikut adalah skema reaksi yang menunjukkan tahapan pembuatan asam karboksilat dari berbagai bahan baku:
- Dari Aldehida
- Aldehida + Oksidator (KMnO4, K2Cr2O7) → Asam Karboksilat
- Dari Alkana
- Alkana + Oksidator Kuat (KMnO4, H2CrO4) → Asam Karboksilat
- Dari Ester
- Ester + H2O (asam atau basa) → Asam Karboksilat + Alkohol
Asam Karboksilat dalam Industri
Asam karboksilat merupakan senyawa organik yang memiliki gugus fungsi karboksil (-COOH). Senyawa ini memiliki peran penting dalam berbagai industri, mulai dari pembuatan plastik dan sabun hingga obat-obatan. Keberadaan gugus karboksil yang bersifat polar membuat asam karboksilat memiliki sifat-sifat unik yang membuatnya sangat berguna dalam berbagai aplikasi.
Aplikasi Asam Karboksilat dalam Industri
Asam karboksilat memiliki berbagai aplikasi dalam industri, antara lain:
- Pembuatan Plastik: Asam karboksilat seperti asam asetat (CH3COOH) dan asam benzoat (C6H5COOH) digunakan dalam pembuatan plastik. Asam asetat digunakan dalam pembuatan plastik polivinil asetat (PVA), sedangkan asam benzoat digunakan dalam pembuatan plastik poliester. Plastik ini memiliki berbagai kegunaan, seperti pembuatan botol, film, dan serat sintetis.
- Pembuatan Sabun: Asam karboksilat merupakan bahan utama dalam pembuatan sabun. Asam lemak seperti asam stearat (C17H35COOH) dan asam palmitat (C15H31COOH) direaksikan dengan basa seperti natrium hidroksida (NaOH) untuk menghasilkan sabun. Sabun merupakan surfaktan yang berfungsi untuk membersihkan kotoran dan lemak.
- Pembuatan Obat-obatan: Asam karboksilat digunakan dalam pembuatan berbagai jenis obat-obatan. Contohnya, asam asetilsalisilat (aspirin) merupakan asam karboksilat yang digunakan sebagai obat pereda nyeri dan penurun panas. Asam karboksilat lainnya seperti asam sitrat (C6H8O7) digunakan dalam pembuatan obat-obatan dan suplemen makanan.
Proses Industri yang Melibatkan Asam Karboksilat
Berikut ini beberapa contoh proses industri yang menggunakan asam karboksilat sebagai bahan baku atau katalis:
- Sintesis Asam Asetat: Asam asetat merupakan asam karboksilat yang paling banyak diproduksi di dunia. Proses sintesisnya melibatkan reaksi karbon monoksida (CO) dengan metanol (CH3OH) dengan katalis logam seperti rodium atau iridium. Asam asetat digunakan dalam berbagai industri, seperti pembuatan plastik, serat sintetis, dan perekat.
- Pembuatan Polimer: Asam karboksilat digunakan dalam pembuatan berbagai jenis polimer, seperti poliester, nilon, dan polivinil asetat. Proses pembuatan polimer melibatkan reaksi polimerisasi yang melibatkan monomer-monomer asam karboksilat.
- Sintesis Ester: Asam karboksilat dapat direaksikan dengan alkohol untuk menghasilkan ester. Reaksi ini disebut esterifikasi. Ester merupakan senyawa organik yang memiliki aroma khas dan digunakan dalam berbagai aplikasi, seperti parfum, pelarut, dan plasticizer.
Diagram Alir Pembuatan Produk Industri yang Melibatkan Asam Karboksilat
Berikut adalah diagram alir yang menunjukkan proses pembuatan asam asetat melalui proses Monsanto:
| Tahap | Proses | Persamaan Reaksi |
|---|---|---|
| 1. Pembuatan Metanol | Sintesis metanol dari gas alam atau batubara | CO + 2H2 → CH3OH |
| 2. Reaksi Karbonilasi | Reaksi metanol dengan karbon monoksida dengan katalis rodium | CH3OH + CO → CH3COOH |
| 3. Pemisahan dan Pemurnian | Pemisahan asam asetat dari produk sampingan | – |
| 4. Produk Akhir | Asam asetat murni | – |
Asam asetat yang dihasilkan dapat digunakan dalam berbagai aplikasi industri, seperti pembuatan plastik, serat sintetis, dan perekat.
Ringkasan Terakhir
Dengan memahami konsep asam karboksilat, kamu akan mampu memahami berbagai reaksi kimia yang melibatkan senyawa ini. Selain itu, pengetahuan tentang asam karboksilat juga dapat membantumu dalam memahami berbagai proses biologis dan industri yang melibatkan senyawa ini. Jadi, teruslah belajar dan berlatih untuk meningkatkan pemahamanmu tentang asam karboksilat!