Contoh soal avogadro – Pernahkah Anda bertanya-tanya bagaimana ilmuwan menghitung jumlah atom atau molekul dalam suatu zat? Konstanta Avogadro adalah kunci untuk menjawab pertanyaan ini! Konstanta Avogadro, yang bernilai sekitar 6,022 x 10^23, merupakan jumlah partikel (atom, molekul, ion) dalam satu mol zat. Dengan memahami konsep ini, kita dapat membuka pintu menuju dunia mikroskopis dan mempelajari berbagai fenomena kimia secara lebih mendalam.
Dalam artikel ini, kita akan menjelajahi berbagai contoh soal yang melibatkan Konstanta Avogadro. Mulai dari menghitung jumlah partikel dalam suatu zat hingga menentukan massa molekul relatif, kita akan melihat bagaimana Konstanta Avogadro menjadi alat yang ampuh dalam kimia.
Pengertian Konstanta Avogadro
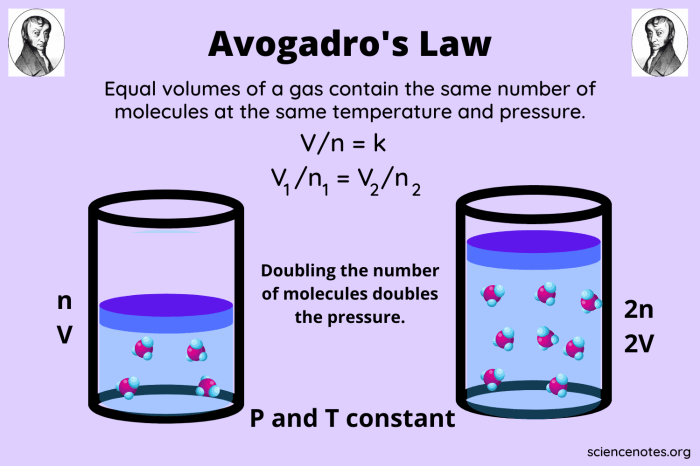
Konstanta Avogadro merupakan salah satu konsep penting dalam kimia yang menghubungkan jumlah partikel dengan jumlah mol. Konstanta Avogadro sendiri didefinisikan sebagai jumlah partikel (atom, molekul, ion, atau entitas lainnya) yang terdapat dalam satu mol zat.
Pengertian Konstanta Avogadro
Konstanta Avogadro, yang dilambangkan dengan simbol “NA” atau “L”, merupakan jumlah tepat partikel (atom, molekul, ion, atau entitas lainnya) yang terdapat dalam satu mol zat. Nilai konstanta ini adalah 6,022 × 1023 partikel per mol.
Analogi Konstanta Avogadro
Bayangkan sebuah kotak yang berisi 1 mol kelereng. Jumlah kelereng dalam kotak itu adalah 6,022 × 1023 buah. Jika kita memiliki 2 mol kelereng, maka jumlah kelereng yang kita miliki adalah 2 × 6,022 × 1023 buah kelereng.
Hubungan Konstanta Avogadro dengan Mol dan Jumlah Partikel
Konstanta Avogadro menghubungkan jumlah mol dengan jumlah partikel melalui persamaan berikut:
Jumlah partikel = Jumlah mol × Konstanta Avogadro
Contohnya, jika kita memiliki 0,5 mol atom karbon, maka jumlah atom karbon yang kita miliki adalah 0,5 mol × 6,022 × 1023 atom/mol = 3,011 × 1023 atom karbon.
Penerapan Konstanta Avogadro dalam Menghitung Jumlah Partikel: Contoh Soal Avogadro
Konstanta Avogadro, yang bernilai 6,022 x 1023, merupakan jumlah partikel (atom, molekul, ion) yang terdapat dalam satu mol zat. Penerapan konstanta ini sangat penting dalam kimia, khususnya dalam menghitung jumlah partikel dalam suatu zat.
Dengan menggunakan Konstanta Avogadro, kita dapat mengetahui berapa banyak partikel yang terkandung dalam sejumlah tertentu zat. Hal ini sangat bermanfaat dalam berbagai bidang seperti sintesis kimia, analisis kimia, dan pengembangan obat-obatan.
Contoh Soal Perhitungan Jumlah Partikel
Berikut contoh soal tentang perhitungan jumlah partikel dalam suatu zat dengan menggunakan Konstanta Avogadro:
Berapa banyak molekul air (H2O) yang terdapat dalam 2 mol air?
Untuk menyelesaikan soal ini, kita dapat menggunakan rumus berikut:
Jumlah partikel = Jumlah mol x Konstanta Avogadro
Langkah-langkah penyelesaiannya:
- Tentukan jumlah mol zat. Dalam soal ini, jumlah mol air adalah 2 mol.
- Tentukan Konstanta Avogadro, yaitu 6,022 x 1023 partikel/mol.
- Gunakan rumus yang telah disebutkan di atas untuk menghitung jumlah partikel.
Maka, jumlah molekul air yang terdapat dalam 2 mol air adalah:
Jumlah molekul air = 2 mol x 6,022 x 1023 molekul/mol = 1,2044 x 1024 molekul
Jadi, terdapat 1,2044 x 1024 molekul air dalam 2 mol air.
Hubungan Jumlah Mol, Jumlah Partikel, dan Massa Zat
Berikut tabel yang menunjukkan hubungan antara jumlah mol, jumlah partikel, dan massa zat:
| Besaran | Rumus | Satuan |
|---|---|---|
| Jumlah mol | n = m/M | mol |
| Jumlah partikel | N = n x NA | partikel |
| Massa zat | m = n x M | gram |
Keterangan:
- n = jumlah mol
- m = massa zat
- M = massa molar
- N = jumlah partikel
- NA = Konstanta Avogadro
Penerapan Konstanta Avogadro dalam Menghitung Massa Molekul Relatif
Konstanta Avogadro, yang menyatakan jumlah partikel (atom, molekul, ion) dalam satu mol zat, memainkan peran penting dalam memahami hubungan antara massa atom relatif (Ar) dan massa molekul relatif (Mr). Melalui Konstanta Avogadro, kita dapat menghubungkan massa molekul relatif dengan massa molar suatu senyawa, yang memungkinkan kita untuk menghitung massa molekul relatif dengan presisi yang lebih tinggi.
Menghitung Massa Molekul Relatif dengan Menggunakan Konstanta Avogadro
Konstanta Avogadro memungkinkan kita untuk menghubungkan massa molekul relatif (Mr) dengan massa molar (Mm) suatu senyawa. Massa molar adalah massa satu mol zat, yang setara dengan massa molekul relatif dalam satuan gram per mol (g/mol). Dengan menggunakan Konstanta Avogadro (NA), kita dapat menghubungkan massa molekul relatif dengan massa molar melalui persamaan berikut:
Mm = Mr x NA
Dengan demikian, massa molekul relatif dapat dihitung dengan menggunakan persamaan berikut:
Mr = Mm / NA
Contohnya, untuk menghitung massa molekul relatif air (H2O), kita dapat menggunakan massa molar air (18 g/mol) dan Konstanta Avogadro (6,022 x 10^23 mol^-1).
- Mr (H2O) = Mm (H2O) / NA
- Mr (H2O) = 18 g/mol / 6,022 x 10^23 mol^-1
- Mr (H2O) = 2,99 x 10^-23 g
Hasil ini menunjukkan bahwa massa molekul relatif air adalah 2,99 x 10^-23 g. Ini adalah massa satu molekul air.
Menghitung Massa Molekul Relatif dari Suatu Senyawa dengan Menggunakan Data Massa Atom Relatif
Massa molekul relatif (Mr) suatu senyawa dapat dihitung dengan menjumlahkan massa atom relatif (Ar) dari semua atom yang menyusun senyawa tersebut. Misalnya, untuk menghitung massa molekul relatif air (H2O), kita perlu menjumlahkan massa atom relatif hidrogen (Ar H = 1) dan oksigen (Ar O = 16).
- Mr (H2O) = 2 x Ar (H) + Ar (O)
- Mr (H2O) = 2 x 1 + 16
- Mr (H2O) = 18
Hasil ini menunjukkan bahwa massa molekul relatif air adalah 18. Ini berarti bahwa satu molekul air memiliki massa 18 kali lebih berat daripada 1/12 massa atom karbon-12.
Penerapan Konstanta Avogadro dalam Menghitung Volume Molar Gas
Konstanta Avogadro merupakan besaran yang menghubungkan jumlah partikel dalam suatu zat dengan jumlah mol zat tersebut. Konstanta ini sangat penting dalam kimia, terutama dalam menghitung volume molar gas pada kondisi standar (STP).
Hubungan Konstanta Avogadro dan Volume Molar Gas pada STP
Pada kondisi standar (STP), yaitu suhu 0°C (273 K) dan tekanan 1 atm, satu mol gas memiliki volume yang sama, yaitu 22,4 L. Volume molar gas ini berkaitan erat dengan Konstanta Avogadro. Hal ini karena pada STP, satu mol gas mengandung jumlah partikel yang sama, yaitu 6,022 x 1023 partikel. Oleh karena itu, volume molar gas pada STP dapat dihitung dengan menggunakan Konstanta Avogadro.
Contoh Soal Perhitungan Volume Molar Gas
Misalkan kita ingin menghitung volume molar gas nitrogen (N2) pada STP. Kita tahu bahwa satu mol gas nitrogen mengandung 6,022 x 1023 molekul nitrogen. Dengan menggunakan Konstanta Avogadro, kita dapat menghitung volume molar gas nitrogen sebagai berikut:
Volume molar gas nitrogen = (6,022 x 1023 molekul nitrogen) / (1 mol nitrogen) x (22,4 L/mol) = 22,4 L/mol
Jadi, volume molar gas nitrogen pada STP adalah 22,4 L/mol.
Langkah-Langkah dalam Menyelesaikan Soal Perhitungan Volume Molar Gas
- Tentukan jumlah mol gas yang ingin dihitung volume molarnya.
- Gunakan Konstanta Avogadro untuk menghitung jumlah partikel gas dalam jumlah mol tersebut.
- Gunakan persamaan volume molar gas pada STP, yaitu 22,4 L/mol, untuk menghitung volume molar gas.
Penerapan Konstanta Avogadro dalam Menghitung Konsentrasi Larutan
Konstanta Avogadro merupakan konsep penting dalam kimia yang menghubungkan jumlah partikel dengan mol. Penerapannya tidak hanya terbatas pada perhitungan jumlah partikel, tetapi juga meluas dalam menentukan konsentrasi larutan.
Hubungan Konstanta Avogadro dengan Konsentrasi Larutan
Konsentrasi larutan menggambarkan jumlah zat terlarut yang terkandung dalam suatu volume tertentu. Dalam perhitungan konsentrasi, Konstanta Avogadro berperan penting untuk menghubungkan jumlah partikel zat terlarut dengan mol zat terlarut.
Contoh soal Avogadro biasanya melibatkan perhitungan jumlah partikel, massa, atau volume suatu zat. Konsep ini juga berhubungan erat dengan konsep mol, yang merupakan satuan dasar dalam kimia. Nah, untuk mengasah kemampuan berpikir logis dan analitis dalam menyelesaikan soal Avogadro, kamu bisa berlatih dengan contoh soal matematika nalar seperti yang ada di situs ini.
Melalui latihan soal matematika nalar, kamu akan terbiasa dengan berbagai macam strategi dan pendekatan untuk memecahkan masalah, yang berguna juga dalam memahami konsep Avogadro secara lebih mendalam.
Secara sederhana, Konstanta Avogadro menunjukkan bahwa satu mol zat terlarut mengandung 6,022 x 1023 partikel zat terlarut. Dengan mengetahui jumlah partikel zat terlarut dalam suatu volume larutan, kita dapat menentukan konsentrasinya.
Contoh Soal Perhitungan Konsentrasi Larutan, Contoh soal avogadro
Misalnya, kita ingin menghitung konsentrasi larutan glukosa (C6H12O6) yang mengandung 1,2044 x 1024 molekul glukosa dalam 500 mL larutan. Berikut langkah-langkahnya:
- Hitung mol glukosa:
Jumlah molekul glukosa / Konstanta Avogadro = (1,2044 x 1024 molekul) / (6,022 x 1023 molekul/mol) = 2 mol
- Hitung konsentrasi larutan:
Mol glukosa / Volume larutan (dalam liter) = 2 mol / 0,5 L = 4 M
Jadi, konsentrasi larutan glukosa tersebut adalah 4 M (molar).
Penerapan Konstanta Avogadro dalam Menghitung Massa Jenis
Konstanta Avogadro, yang menyatakan jumlah partikel dalam satu mol zat, ternyata memiliki keterkaitan erat dengan massa jenis. Keduanya saling melengkapi dalam menggambarkan sifat fisik suatu zat. Konstanta Avogadro membantu kita memahami hubungan antara jumlah partikel dan massa suatu zat, sedangkan massa jenis menghubungkan massa dan volume. Dengan menggabungkan kedua konsep ini, kita dapat menghitung massa jenis suatu zat dengan lebih mendalam.
Hubungan Konstanta Avogadro dan Massa Jenis Zat
Massa jenis suatu zat didefinisikan sebagai massa per satuan volume. Rumusnya adalah:
ρ = m/V
Dimana:
- ρ adalah massa jenis (kg/m3)
- m adalah massa (kg)
- V adalah volume (m3)
Konstanta Avogadro (NA) berperan dalam menghubungkan jumlah partikel dengan massa. Jumlah partikel dalam satu mol zat sama dengan NA, yaitu 6,022 x 1023 partikel. Dengan demikian, massa satu mol zat (massa molar, M) dapat dihubungkan dengan massa satu partikel (mp) melalui persamaan:
M = NA x mp
Dengan menggunakan persamaan ini, kita dapat menghubungkan massa jenis dengan Konstanta Avogadro. Misalnya, jika kita ingin menghitung massa jenis suatu zat padat, kita dapat menggunakan rumus berikut:
ρ = (NA x mp) / V
Dimana:
- ρ adalah massa jenis (kg/m3)
- NA adalah Konstanta Avogadro (6,022 x 1023 partikel/mol)
- mp adalah massa satu partikel (kg)
- V adalah volume (m3)
Contoh Soal Perhitungan Massa Jenis Zat
Hitunglah massa jenis logam tembaga (Cu) jika diketahui massa atom tembaga adalah 63,55 g/mol dan volume satu mol tembaga adalah 7,11 cm3.
Langkah-langkah Penyelesaian:
- Konversi massa atom tembaga dari g/mol ke kg/mol:
- Hitung massa satu atom tembaga:
- Konversi volume satu mol tembaga dari cm3 ke m3:
- Hitung massa jenis tembaga:
- Hitung jumlah mol total dalam campuran gas.
Jumlah mol total = 2 mol N2 + 3 mol O2 = 5 mol
- Hitung fraksi mol masing-masing gas.
Fraksi mol N2 = 2 mol N2 / 5 mol total = 0.4
Fraksi mol O2 = 3 mol O2 / 5 mol total = 0.6
- Hitung tekanan total campuran gas menggunakan hukum gas ideal.
Ptotal = (ntotalRT) / V
Dimana:
- Ptotal adalah tekanan total campuran gas
- ntotal adalah jumlah mol total gas
- R adalah konstanta gas ideal (0.0821 L atm/mol K)
- T adalah suhu dalam Kelvin (25 °C + 273 = 298 K)
- V adalah volume wadah (10 L)
Ptotal = (5 mol * 0.0821 L atm/mol K * 298 K) / 10 L = 12.3 atm
- Hitung tekanan parsial masing-masing gas.
PN2 = Fraksi mol N2 * Ptotal = 0.4 * 12.3 atm = 4.92 atm
PO2 = Fraksi mol O2 * Ptotal = 0.6 * 12.3 atm = 7.38 atm
- Tentukan jumlah mol oksigen yang dibutuhkan untuk membakar 2 mol metana. Berdasarkan persamaan reaksi, 1 mol metana membutuhkan 2 mol oksigen, maka 2 mol metana membutuhkan 4 mol oksigen.
- Hitung perubahan entalpi total reaksi dengan mengalikan entalpi molar metana dengan jumlah mol metana yang dibakar: -890 kJ/mol x 2 mol = -1780 kJ.
- Hitung entropi total produk:
- Hitung entropi total reaktan:
- Hitung perubahan entropi (ΔS):
- ΔG adalah perubahan energi Gibbs
- ΔH adalah perubahan entalpi
- ΔS adalah perubahan entropi
- T adalah suhu dalam Kelvin
- n adalah jumlah mol
- R adalah konstanta gas ideal (8.314 J/mol·K)
- Vf adalah volume akhir
- Vi adalah volume awal
- Cp adalah kapasitas panas molar
- ΔT adalah perubahan suhu
- Hitung perubahan energi Gibbs (ΔG) menggunakan rumus ΔG = ΔH – TΔS.
- Substitusikan nilai ΔH = -571.6 kJ/mol, ΔS = -326.6 J/mol·K, dan T = 298 K ke dalam rumus.
- Perhatikan satuan untuk memastikan konsistensi. Dalam kasus ini, perubahan entropi dalam J/mol·K harus diubah menjadi kJ/mol·K.
- Hitung ΔG.
63,55 g/mol = 63,55 x 10-3 kg/mol
mp = (63,55 x 10-3 kg/mol) / (6,022 x 1023 atom/mol)
7,11 cm3 = 7,11 x 10-6 m3
ρ = (NA x mp) / V = (6,022 x 1023 atom/mol) x [(63,55 x 10-3 kg/mol) / (6,022 x 1023 atom/mol)] / (7,11 x 10-6 m3) = 8,94 x 103 kg/m3
Jadi, massa jenis tembaga adalah 8,94 x 103 kg/m3.
Penerapan Konstanta Avogadro dalam Menghitung Tekanan Parsial Gas
Konstanta Avogadro merupakan konsep fundamental dalam kimia yang menghubungkan jumlah partikel (atom atau molekul) dalam suatu zat dengan jumlah mol zat tersebut. Penerapannya meluas, salah satunya dalam perhitungan tekanan parsial gas dalam campuran gas.
Tekanan Parsial Gas dalam Campuran Gas
Tekanan parsial gas dalam campuran gas merujuk pada tekanan yang akan diberikan oleh gas tersebut jika gas itu menempati seluruh volume wadah sendirian pada suhu yang sama. Konstanta Avogadro membantu dalam menghitung tekanan parsial gas dengan memanfaatkan hubungan antara jumlah mol gas dan tekanan parsialnya.
Contoh Soal Perhitungan Tekanan Parsial Gas
Misalkan kita memiliki campuran gas yang terdiri dari 2 mol gas nitrogen (N2) dan 3 mol gas oksigen (O2) dalam wadah dengan volume 10 liter pada suhu 25 °C. Berapakah tekanan parsial gas nitrogen dan gas oksigen dalam campuran tersebut?
Jadi, tekanan parsial gas nitrogen dalam campuran tersebut adalah 4.92 atm dan tekanan parsial gas oksigen adalah 7.38 atm.
Penerapan Konstanta Avogadro dalam Menghitung Entalpi Reaksi
Konstanta Avogadro, yang menyatakan jumlah partikel dalam satu mol zat, merupakan konsep fundamental dalam kimia. Konstanta ini memainkan peran penting dalam perhitungan berbagai besaran kimia, termasuk entalpi reaksi. Entalpi reaksi adalah perubahan energi yang terjadi selama reaksi kimia, yang dapat berupa pelepasan atau penyerapan energi.
Hubungan Konstanta Avogadro dan Entalpi Reaksi
Konstanta Avogadro membantu menghubungkan jumlah mol reaktan dan produk dengan perubahan entalpi reaksi. Dalam perhitungan entalpi reaksi, kita sering menggunakan nilai entalpi molar, yaitu perubahan entalpi yang terjadi ketika satu mol zat bereaksi. Nilai entalpi molar ini kemudian dapat dikalikan dengan jumlah mol reaktan atau produk untuk memperoleh perubahan entalpi total reaksi.
Contoh Soal Perhitungan Entalpi Reaksi
Sebagai contoh, perhatikan reaksi pembakaran metana (CH4) berikut:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
Entalpi reaksi untuk pembakaran 1 mol metana adalah -890 kJ/mol. Jika kita ingin mengetahui perubahan entalpi ketika 2 mol metana dibakar, kita dapat menggunakan Konstanta Avogadro untuk menghitung jumlah mol oksigen yang dibutuhkan dan jumlah mol karbon dioksida dan air yang dihasilkan.
Langkah-Langkah Penyelesaian Soal
Jadi, perubahan entalpi total ketika 2 mol metana dibakar adalah -1780 kJ, yang berarti reaksi ini melepaskan energi sebesar 1780 kJ.
Penerapan Konstanta Avogadro dalam Menghitung Entropi Reaksi
Konstanta Avogadro, yang menyatakan jumlah partikel dalam satu mol zat, memainkan peran penting dalam menghitung entropi reaksi. Entropi adalah ukuran ketidakteraturan atau kekacauan dalam suatu sistem. Semakin besar entropi suatu sistem, semakin besar ketidakteraturannya.
Hubungan Konstanta Avogadro dan Entropi Reaksi
Konstanta Avogadro membantu dalam menghitung entropi reaksi dengan menghubungkan jumlah mol reaktan dan produk dengan jumlah partikel yang terlibat dalam reaksi. Entropi reaksi dihitung dengan menggunakan rumus:
ΔS = ΣSproduk – ΣSreaktan
di mana ΔS adalah perubahan entropi, Sproduk adalah entropi produk, dan Sreaktan adalah entropi reaktan. Entropi suatu zat biasanya dinyatakan dalam satuan J/mol·K. Dalam perhitungan entropi reaksi, Konstanta Avogadro tidak secara langsung digunakan dalam rumus, tetapi berperan dalam menentukan jumlah mol reaktan dan produk yang terlibat dalam reaksi, yang selanjutnya memengaruhi nilai entropi.
Contoh Soal Perhitungan Entropi Reaksi
Sebagai contoh, perhatikan reaksi pembakaran metana (CH4) berikut:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Diketahui entropi standar (S°) untuk setiap zat:
| Zat | S° (J/mol·K) |
|---|---|
| CH4(g) | 186.3 |
| O2(g) | 205.2 |
| CO2(g) | 213.8 |
| H2O(g) | 188.8 |
Hitunglah perubahan entropi (ΔS) untuk reaksi ini.
Langkah-langkah Penyelesaian Soal
ΣSproduk = (1 mol CO2 × 213.8 J/mol·K) + (2 mol H2O × 188.8 J/mol·K) = 591.4 J/K
ΣSreaktan = (1 mol CH4 × 186.3 J/mol·K) + (2 mol O2 × 205.2 J/mol·K) = 596.7 J/K
ΔS = ΣSproduk – ΣSreaktan = 591.4 J/K – 596.7 J/K = -5.3 J/K
Hasilnya, perubahan entropi untuk reaksi pembakaran metana adalah -5.3 J/K. Nilai negatif menunjukkan bahwa entropi sistem berkurang selama reaksi, yang berarti bahwa ketidakteraturan sistem berkurang. Hal ini disebabkan karena jumlah mol gas produk lebih sedikit daripada jumlah mol gas reaktan.
Penerapan Konstanta Avogadro dalam Menghitung Energi Gibbs Reaksi
Konstanta Avogadro, yang menyatakan jumlah partikel dalam satu mol zat, memainkan peran penting dalam perhitungan termodinamika, termasuk energi Gibbs reaksi. Energi Gibbs merupakan besaran yang menunjukkan spontanitas reaksi kimia, di mana nilai negatif menandakan reaksi spontan dan nilai positif menunjukkan reaksi nonspontan. Dengan menggunakan Konstanta Avogadro, kita dapat menghubungkan jumlah mol zat dengan jumlah partikel, yang memungkinkan kita untuk menghitung perubahan energi Gibbs dalam skala molekuler.
Konstanta Avogadro dalam Perhitungan Energi Gibbs
Konstanta Avogadro (NA) digunakan dalam perhitungan energi Gibbs reaksi melalui hubungannya dengan entropi (S) dan entalpi (H) reaksi. Entropi adalah ukuran ketidakteraturan atau kekacauan dalam sistem, sedangkan entalpi adalah jumlah total energi dalam sistem. Perubahan entropi dan entalpi reaksi dapat dihubungkan dengan jumlah mol zat yang terlibat, dan Konstanta Avogadro memungkinkan kita untuk mengonversi jumlah mol menjadi jumlah partikel, sehingga memungkinkan kita untuk menghitung perubahan energi Gibbs pada skala molekuler.
Rumus energi Gibbs adalah:
ΔG = ΔH – TΔS
di mana:
Perubahan entropi dan entalpi dapat dihitung menggunakan Konstanta Avogadro dengan persamaan berikut:
ΔS = nRln(Vf/Vi)
ΔH = nCpΔT
di mana:
Contoh Soal
Perhatikan reaksi berikut:
2H2(g) + O2(g) → 2H2O(l)
Hitung perubahan energi Gibbs reaksi pada suhu 298 K jika diketahui bahwa perubahan entalpi reaksi adalah -571.6 kJ/mol dan perubahan entropi reaksi adalah -326.6 J/mol·K.
Langkah-langkah Penyelesaian
Hasil perhitungan menunjukkan bahwa perubahan energi Gibbs reaksi adalah negatif, yang mengindikasikan bahwa reaksi tersebut spontan pada suhu 298 K.
Ringkasan Penutup
Konstanta Avogadro membuka jalan bagi kita untuk memahami dunia atom dan molekul. Dengan memahami konsep ini, kita dapat menghitung jumlah partikel, massa molekul relatif, volume molar gas, dan berbagai besaran kimia lainnya. Konsep Konstanta Avogadro merupakan fondasi penting dalam kimia, dan pemahamannya akan membantu kita dalam mempelajari dan memahami berbagai reaksi kimia yang terjadi di sekitar kita.