Contoh soal bentuk molekul dan pembahasannya – Pernahkah kamu bertanya-tanya bagaimana bentuk molekul air yang kita minum setiap hari? Atau bagaimana bentuk molekul obat yang kita konsumsi? Ternyata, bentuk molekul sangat berpengaruh terhadap sifat dan fungsi suatu senyawa. Dalam artikel ini, kita akan menjelajahi dunia molekul dan membahas contoh soal bentuk molekul beserta pembahasannya. Siap untuk mempelajari bagaimana bentuk molekul menentukan sifat-sifat senyawa dan bagaimana hal ini diterapkan dalam kehidupan sehari-hari?
Bentuk molekul merupakan susunan atom-atom dalam suatu molekul yang menentukan sifat-sifatnya. Bentuk molekul dapat diprediksi dengan menggunakan teori VSEPR (Valence Shell Electron Pair Repulsion) yang menyatakan bahwa pasangan elektron di kulit valensi atom pusat akan tolak-menolak satu sama lain, sehingga menentukan bentuk molekul yang paling stabil. Bentuk molekul memengaruhi sifat-sifat senyawa seperti titik didih, titik leleh, kelarutan, dan reaktivitas. Mari kita bahas contoh soal bentuk molekul dan pembahasannya untuk memahami konsep ini lebih lanjut.
Pengertian Bentuk Molekul: Contoh Soal Bentuk Molekul Dan Pembahasannya
Bentuk molekul merupakan susunan tiga dimensi atom-atom dalam sebuah molekul. Bentuk molekul ini penting karena menentukan sifat-sifat kimia dan fisik suatu molekul, seperti titik didih, titik leleh, dan reaktivitasnya.
Bentuk molekul ditentukan oleh gaya tolak-menolak antara pasangan elektron ikatan dan pasangan elektron bebas di sekitar atom pusat. Pasangan elektron saling tolak-menolak, sehingga mereka akan mengatur diri sedemikian rupa sehingga jarak antar mereka maksimal.
Bentuk Molekul Sederhana
Berikut adalah beberapa bentuk molekul sederhana yang sering dijumpai:
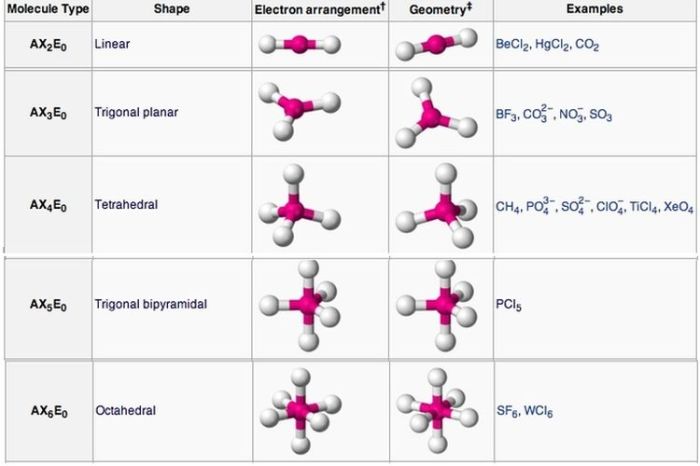
- Linear: Molekul dengan bentuk linear memiliki dua atom yang terikat pada atom pusat dengan sudut ikatan 180°. Contohnya adalah molekul CO2 (karbon dioksida). Ilustrasi bentuk linear: [Gambar menunjukkan dua atom yang terikat pada atom pusat dengan sudut 180°].
- Trigonal Planar: Molekul dengan bentuk trigonal planar memiliki tiga atom yang terikat pada atom pusat dengan sudut ikatan 120°. Contohnya adalah molekul BF3 (boron trifluorida). Ilustrasi bentuk trigonal planar: [Gambar menunjukkan tiga atom yang terikat pada atom pusat dengan sudut 120°].
- Tetrahedral: Molekul dengan bentuk tetrahedral memiliki empat atom yang terikat pada atom pusat dengan sudut ikatan 109,5°. Contohnya adalah molekul CH4 (metana). Ilustrasi bentuk tetrahedral: [Gambar menunjukkan empat atom yang terikat pada atom pusat dengan sudut 109,5°].
Tabel Bentuk Molekul
Berikut adalah tabel yang berisi nama bentuk molekul, contoh molekul, dan gambar ilustrasi:
| Nama Bentuk Molekul | Contoh Molekul | Gambar Ilustrasi |
|---|---|---|
| Linear | CO2 | [Gambar menunjukkan dua atom yang terikat pada atom pusat dengan sudut 180°] |
| Trigonal Planar | BF3 | [Gambar menunjukkan tiga atom yang terikat pada atom pusat dengan sudut 120°] |
| Tetrahedral | CH4 | [Gambar menunjukkan empat atom yang terikat pada atom pusat dengan sudut 109,5°] |
Teori VSEPR
Teori VSEPR (Valence Shell Electron Pair Repulsion) merupakan model yang digunakan untuk memprediksi bentuk molekul berdasarkan tolakan antara pasangan elektron di kulit valensi atom pusat. Teori ini mengasumsikan bahwa pasangan elektron, baik yang terlibat dalam ikatan maupun yang tidak (pasangan elektron bebas), saling tolak-menolak dan akan menempatkan diri sedemikian rupa sehingga tolakan antarpasangan elektron tersebut diminimalkan.
Pasangan Elektron Ikatan dan Pasangan Elektron Bebas
Dalam teori VSEPR, pasangan elektron di kulit valensi atom pusat dibagi menjadi dua kategori:
- Pasangan elektron ikatan: Pasangan elektron yang terlibat dalam pembentukan ikatan kovalen dengan atom lain. Misalnya, dalam molekul air (H2O), terdapat dua pasangan elektron ikatan yang menghubungkan atom oksigen dengan dua atom hidrogen.
- Pasangan elektron bebas: Pasangan elektron yang tidak terlibat dalam pembentukan ikatan kovalen. Misalnya, dalam molekul air (H2O), terdapat dua pasangan elektron bebas pada atom oksigen.
Tolakan antara pasangan elektron bebas lebih kuat dibandingkan dengan tolakan antara pasangan elektron ikatan. Hal ini karena pasangan elektron bebas terlokalisasi pada atom pusat, sedangkan pasangan elektron ikatan terdistribusi di antara dua atom.
Contoh Penerapan Teori VSEPR
Berikut contoh penerapan teori VSEPR untuk menentukan bentuk molekul:
Molekul Air (H2O)
- Atom pusat: Oksigen (O)
- Jumlah pasangan elektron ikatan: 2 (ikatan O-H)
- Jumlah pasangan elektron bebas: 2
Berdasarkan teori VSEPR, molekul H2O memiliki geometri tetrahedral, namun karena adanya dua pasangan elektron bebas, bentuk molekulnya menjadi bengkok (bent).
Molekul Amonia (NH3)
- Atom pusat: Nitrogen (N)
- Jumlah pasangan elektron ikatan: 3 (ikatan N-H)
- Jumlah pasangan elektron bebas: 1
Berdasarkan teori VSEPR, molekul NH3 memiliki geometri tetrahedral, namun karena adanya satu pasangan elektron bebas, bentuk molekulnya menjadi piramida trigonal.
Kesimpulan
Teori VSEPR merupakan model yang sederhana namun efektif untuk memprediksi bentuk molekul. Teori ini membantu kita memahami bagaimana tolakan antarpasangan elektron di kulit valensi atom pusat mempengaruhi geometri molekul.
Pengaruh Bentuk Molekul terhadap Sifat Senyawa
Bentuk molekul merupakan faktor penting yang memengaruhi sifat-sifat senyawa. Bentuk molekul dapat menentukan bagaimana molekul berinteraksi satu sama lain, yang selanjutnya memengaruhi sifat-sifat fisik seperti titik didih, titik leleh, dan kelarutan.
Pengaruh Bentuk Molekul terhadap Titik Didih dan Titik Leleh
Titik didih dan titik leleh suatu senyawa ditentukan oleh kekuatan interaksi antarmolekul. Semakin kuat interaksi antarmolekul, semakin tinggi titik didih dan titik lelehnya. Bentuk molekul dapat memengaruhi kekuatan interaksi antarmolekul dengan menentukan seberapa dekat molekul dapat saling mendekat dan seberapa besar luas permukaan yang dapat berinteraksi.
Contohnya, air (H2O) memiliki bentuk molekul bengkok, yang memungkinkan molekul air untuk membentuk ikatan hidrogen yang kuat satu sama lain. Ikatan hidrogen merupakan interaksi antarmolekul yang kuat, sehingga air memiliki titik didih dan titik leleh yang relatif tinggi dibandingkan dengan senyawa lain dengan massa molekul yang sama. Sementara itu, metana (CH4) memiliki bentuk molekul tetrahedral, yang menyebabkan interaksi antarmolekul yang lemah, sehingga metana memiliki titik didih dan titik leleh yang rendah.
Contoh Soal Bentuk Molekul
Bentuk molekul merupakan salah satu konsep penting dalam kimia yang menjelaskan bagaimana atom-atom dalam suatu molekul tersusun dalam ruang tiga dimensi. Pengetahuan tentang bentuk molekul membantu kita memahami sifat fisik dan kimia suatu zat, seperti titik didih, kelarutan, dan reaktivitasnya. Untuk mempelajari konsep ini, kita dapat menggunakan berbagai contoh soal dan pembahasannya.
Contoh Soal dan Pembahasan Bentuk Molekul
Berikut ini adalah beberapa contoh soal bentuk molekul dan pembahasannya:
-
Tentukan bentuk molekul dari molekul air (H2O) berdasarkan struktur Lewis-nya.
-
Tentukan bentuk molekul dari molekul metana (CH4) berdasarkan teori VSEPR.
-
Tentukan bentuk molekul dari molekul amonia (NH3) berdasarkan teori VSEPR.
Menentukan Bentuk Molekul Berdasarkan Struktur Lewis
Struktur Lewis merupakan representasi sederhana dari ikatan kimia dalam suatu molekul. Struktur Lewis menunjukkan bagaimana atom-atom dalam suatu molekul terhubung melalui ikatan kovalen, dan pasangan elektron bebas pada setiap atom.
-
Langkah pertama untuk menentukan bentuk molekul berdasarkan struktur Lewis adalah dengan menggambar struktur Lewis molekul tersebut.
-
Setelah struktur Lewis digambar, hitung jumlah elektron domain (pasangan elektron ikatan dan pasangan elektron bebas) di sekitar atom pusat.
-
Jumlah elektron domain menentukan bentuk molekul.
Menentukan Bentuk Molekul Berdasarkan Teori VSEPR
Teori VSEPR (Valence Shell Electron Pair Repulsion) adalah model yang digunakan untuk memprediksi bentuk molekul berdasarkan tolakan antara pasangan elektron valensi di sekitar atom pusat. Teori ini menyatakan bahwa pasangan elektron valensi di sekitar atom pusat akan saling tolak menolak dan akan menempatkan diri sejauh mungkin satu sama lain untuk meminimalkan tolakan tersebut.
-
Langkah pertama untuk menentukan bentuk molekul berdasarkan teori VSEPR adalah dengan menggambar struktur Lewis molekul tersebut.
-
Setelah struktur Lewis digambar, hitung jumlah elektron domain (pasangan elektron ikatan dan pasangan elektron bebas) di sekitar atom pusat.
-
Jumlah elektron domain menentukan bentuk molekul.
Hibridisasi Orbital
Hibridisasi orbital adalah konsep yang menjelaskan bagaimana orbital atom bergabung dan membentuk orbital hibrida baru yang memiliki bentuk dan energi yang berbeda dari orbital atom asalnya. Konsep ini sangat penting dalam kimia karena dapat menjelaskan bentuk molekul dan sifat-sifat senyawa.
Hibridisasi Orbital pada Molekul CH4, H2O, dan NH3
Hibridisasi orbital dapat diilustrasikan dengan contoh molekul CH4 (metana), H2O (air), dan NH3 (amonia). Ketiga molekul ini memiliki bentuk molekul yang berbeda karena hibridisasi orbital yang berbeda pada atom pusatnya.
- CH4 (metana): Atom karbon dalam CH4 memiliki konfigurasi elektron 1s22s22p2. Dalam pembentukan CH4, orbital 2s dan tiga orbital 2p pada atom karbon mengalami hibridisasi, menghasilkan empat orbital hibrida sp3 yang identik. Orbital hibrida sp3 ini berbentuk tetrahedral dan berorientasi ke arah empat sudut tetrahedron, membentuk ikatan kovalen dengan empat atom hidrogen. Akibatnya, molekul CH4 memiliki bentuk tetrahedral.
- H2O (air): Atom oksigen dalam H2O memiliki konfigurasi elektron 1s22s22p4. Dalam pembentukan H2O, orbital 2s dan dua orbital 2p pada atom oksigen mengalami hibridisasi, menghasilkan dua orbital hibrida sp3 dan dua orbital p murni. Dua orbital hibrida sp3 membentuk ikatan kovalen dengan dua atom hidrogen, sementara dua orbital p murni tidak terlibat dalam pembentukan ikatan. Akibatnya, molekul H2O memiliki bentuk bengkok atau sudut.
- NH3 (amonia): Atom nitrogen dalam NH3 memiliki konfigurasi elektron 1s22s22p3. Dalam pembentukan NH3, orbital 2s dan tiga orbital 2p pada atom nitrogen mengalami hibridisasi, menghasilkan tiga orbital hibrida sp3 dan satu orbital p murni. Tiga orbital hibrida sp3 membentuk ikatan kovalen dengan tiga atom hidrogen, sementara satu orbital p murni berisi pasangan elektron bebas. Akibatnya, molekul NH3 memiliki bentuk piramida trigonal.
Dampak Hibridisasi Orbital terhadap Sifat Senyawa
Hibridisasi orbital dapat memengaruhi sifat-sifat senyawa, seperti bentuk molekul, polaritas, titik didih, dan titik leleh. Sebagai contoh, hibridisasi sp3 pada CH4 menyebabkan molekulnya berbentuk tetrahedral, nonpolar, dan memiliki titik didih yang rendah. Sebaliknya, hibridisasi sp3 pada H2O menyebabkan molekulnya berbentuk bengkok, polar, dan memiliki titik didih yang lebih tinggi dibandingkan dengan CH4.
Contoh Soal Bentuk Molekul dan Hibridisasi Orbital
Bentuk molekul dan hibridisasi orbital merupakan konsep penting dalam kimia yang membantu kita memahami struktur dan sifat molekul. Hibridisasi orbital adalah proses pencampuran orbital atom untuk membentuk orbital hibrida yang memiliki energi dan bentuk yang berbeda dari orbital atom asalnya. Bentuk molekul, di sisi lain, menggambarkan geometri tiga dimensi molekul, yang ditentukan oleh susunan atom di ruang.
Menentukan Bentuk Molekul dan Hibridisasi Orbital
Untuk menentukan bentuk molekul dan hibridisasi orbital, kita dapat menggunakan teori VSEPR (Valence Shell Electron Pair Repulsion). Teori ini menyatakan bahwa pasangan elektron valensi pada atom pusat akan saling tolak menolak dan akan mengatur diri mereka sendiri sedemikian rupa sehingga meminimalkan tolakan antar pasangan elektron. Berikut adalah beberapa contoh soal yang dapat membantu kita memahami konsep ini:
- Tentukan bentuk molekul dan hibridisasi orbital dari molekul metana (CH4).
- Tentukan bentuk molekul dan hibridisasi orbital dari molekul air (H2O).
- Tentukan bentuk molekul dan hibridisasi orbital dari molekul amonia (NH3).
Menentukan Hibridisasi Orbital Berdasarkan Struktur Lewis
Struktur Lewis adalah representasi diagramatik dari ikatan kovalen dalam molekul. Kita dapat menggunakan struktur Lewis untuk menentukan hibridisasi orbital atom pusat dalam molekul. Berikut adalah contoh soal:
- Tentukan hibridisasi orbital atom karbon dalam molekul etana (C2H6) berdasarkan struktur Lewis-nya.
- Tentukan hibridisasi orbital atom nitrogen dalam molekul amonia (NH3) berdasarkan struktur Lewis-nya.
Menentukan Hibridisasi Orbital Berdasarkan Teori VSEPR
Teori VSEPR dapat juga digunakan untuk menentukan hibridisasi orbital atom pusat dalam molekul. Berikut adalah contoh soal:
- Tentukan hibridisasi orbital atom karbon dalam molekul metana (CH4) berdasarkan teori VSEPR.
- Tentukan hibridisasi orbital atom nitrogen dalam molekul amonia (NH3) berdasarkan teori VSEPR.
Bentuk Molekul dan Polaritas
Bentuk molekul dan polaritas molekul merupakan konsep penting dalam kimia. Bentuk molekul merujuk pada susunan tiga dimensi atom-atom dalam sebuah molekul, sedangkan polaritas molekul mengacu pada distribusi muatan listrik dalam molekul. Kedua konsep ini saling berkaitan erat dan memengaruhi sifat-sifat kimia dan fisik suatu zat.
Hubungan Bentuk Molekul dan Polaritas Molekul
Bentuk molekul memengaruhi polaritas molekul karena bentuk molekul menentukan bagaimana momen dipol ikatan antaratom dalam molekul tersebut saling memengaruhi. Momen dipol adalah ukuran pemisahan muatan positif dan negatif dalam sebuah ikatan. Jika momen dipol ikatan saling meniadakan, maka molekul tersebut bersifat nonpolar. Sebaliknya, jika momen dipol ikatan tidak saling meniadakan, maka molekul tersebut bersifat polar.
Contohnya, molekul CO2 memiliki bentuk linear, dengan kedua atom oksigen berada di sisi yang berlawanan dari atom karbon. Momen dipol ikatan C-O saling meniadakan karena arahnya berlawanan. Akibatnya, molekul CO2 bersifat nonpolar.
Berbeda dengan CO2, molekul H2O memiliki bentuk bengkok. Momen dipol ikatan O-H tidak saling meniadakan karena arahnya tidak berlawanan. Akibatnya, molekul H2O bersifat polar.
Contoh Molekul Polar dan Nonpolar
Berikut ini adalah contoh molekul polar dan nonpolar beserta penjelasannya:
-
Molekul Polar:
- Air (H2O): Molekul air memiliki bentuk bengkok dan momen dipol ikatan O-H tidak saling meniadakan. Akibatnya, molekul air bersifat polar.
- Amonia (NH3): Molekul amonia memiliki bentuk piramida trigonal dan momen dipol ikatan N-H tidak saling meniadakan. Akibatnya, molekul amonia bersifat polar.
- Metanol (CH3OH): Molekul metanol memiliki bentuk tetrahedral dan momen dipol ikatan C-O dan O-H tidak saling meniadakan. Akibatnya, molekul metanol bersifat polar.
-
Molekul Nonpolar:
- Karbon dioksida (CO2): Molekul karbon dioksida memiliki bentuk linear dan momen dipol ikatan C-O saling meniadakan. Akibatnya, molekul karbon dioksida bersifat nonpolar.
- Metana (CH4): Molekul metana memiliki bentuk tetrahedral dan momen dipol ikatan C-H saling meniadakan. Akibatnya, molekul metana bersifat nonpolar.
- Etan (C2H6): Molekul etan memiliki bentuk tetrahedral dan momen dipol ikatan C-H saling meniadakan. Akibatnya, molekul etan bersifat nonpolar.
Tabel Bentuk Molekul dan Polaritas
Berikut ini adalah tabel yang berisi nama molekul, bentuk molekul, dan polaritasnya:
| Nama Molekul | Bentuk Molekul | Polaritas |
|---|---|---|
| Air (H2O) | Bengkok | Polar |
| Karbon dioksida (CO2) | Linear | Nonpolar |
| Amonia (NH3) | Piramida trigonal | Polar |
| Metana (CH4) | Tetrahedral | Nonpolar |
| Metanol (CH3OH) | Tetrahedral | Polar |
| Etan (C2H6) | Tetrahedral | Nonpolar |
Contoh Soal Bentuk Molekul dan Polaritas
Dalam kimia, memahami bentuk molekul dan polaritasnya sangat penting untuk memahami sifat-sifat molekul dan bagaimana mereka berinteraksi dengan molekul lain. Polaritas molekul dipengaruhi oleh bentuk molekul dan jenis ikatan yang terbentuk di dalamnya. Berikut adalah contoh soal tentang menentukan polaritas molekul berdasarkan bentuk molekul, menentukan bentuk molekul berdasarkan polaritas molekul, dan menentukan polaritas molekul berdasarkan momen dipol.
Contoh soal bentuk molekul dan pembahasannya bisa jadi cukup menantang, ya. Kamu perlu memahami konsep geometri molekul dan teori ikatan valensi untuk bisa menyelesaikannya. Nah, buat kamu yang lagi belajar tentang susunan kalimat, ada contoh soal kalimat acak yang bisa kamu coba di situs ini.
Setelah mengasah kemampuan dalam menyusun kalimat, kamu bisa kembali ke contoh soal bentuk molekul dan pembahasannya. Dengan latihan yang konsisten, kamu pasti bisa menguasai materi ini!
Menentukan Polaritas Molekul Berdasarkan Bentuk Molekul, Contoh soal bentuk molekul dan pembahasannya
Bentuk molekul dapat ditentukan dengan menggunakan teori VSEPR (Valence Shell Electron Pair Repulsion). Teori ini menyatakan bahwa pasangan elektron valensi pada atom pusat akan saling tolak menolak dan akan menempatkan diri sedemikian rupa sehingga tolakan antarpasangan elektron minimal. Berikut contoh soal:
- Soal: Tentukan polaritas molekul air (H2O) berdasarkan bentuk molekulnya!
- Pembahasan: Atom pusat pada molekul air adalah oksigen (O). Oksigen memiliki 2 pasangan elektron bebas dan 2 ikatan kovalen dengan atom hidrogen (H). Bentuk molekul air adalah bengkok atau V-shaped, dengan sudut ikatan sekitar 104,5 derajat. Karena bentuk molekul air tidak simetris dan memiliki dua pasangan elektron bebas, maka molekul air bersifat polar. Polaritas molekul air ini disebabkan oleh perbedaan elektronegativitas antara atom oksigen dan hidrogen, sehingga terjadi pemisahan muatan positif dan negatif di dalam molekul.
Menentukan Bentuk Molekul Berdasarkan Polaritas Molekul
Polaritas molekul dapat diprediksi berdasarkan jenis ikatan dan bentuk molekulnya. Molekul polar memiliki distribusi muatan yang tidak merata, sementara molekul nonpolar memiliki distribusi muatan yang merata. Berikut contoh soal:
- Soal: Molekul CO2 bersifat nonpolar. Tentukan bentuk molekul CO2!
- Pembahasan: Molekul CO2 memiliki dua ikatan kovalen ganda antara atom karbon (C) dan atom oksigen (O). Karena ikatan C=O bersifat polar, namun molekul CO2 bersifat nonpolar, maka bentuk molekul CO2 haruslah linier. Bentuk linier ini memungkinkan momen dipol dari kedua ikatan C=O saling meniadakan sehingga molekul CO2 menjadi nonpolar.
Menentukan Polaritas Molekul Berdasarkan Momen Dipol
Momen dipol adalah ukuran polaritas ikatan atau molekul. Momen dipol merupakan vektor yang menunjukkan arah dan besarnya pemisahan muatan dalam ikatan atau molekul. Berikut contoh soal:
- Soal: Molekul NH3 memiliki momen dipol yang tidak nol. Tentukan polaritas molekul NH3!
- Pembahasan: Molekul NH3 memiliki tiga ikatan kovalen antara atom nitrogen (N) dan atom hidrogen (H). Atom nitrogen memiliki pasangan elektron bebas, sehingga bentuk molekul NH3 adalah piramida trigonal. Karena bentuk molekul NH3 tidak simetris dan memiliki momen dipol yang tidak nol, maka molekul NH3 bersifat polar.
Bentuk Molekul dan Ikatan Antarmolekul
Bentuk molekul merupakan susunan tiga dimensi dari atom-atom dalam suatu molekul. Bentuk molekul ini ditentukan oleh susunan elektron ikatan dan pasangan elektron bebas di sekitar atom pusat. Bentuk molekul memiliki peran penting dalam menentukan sifat fisik dan kimia suatu zat, termasuk titik leleh, titik didih, dan kelarutan.
Bentuk molekul juga berkaitan erat dengan jenis ikatan antarmolekul yang terjadi antara molekul-molekul. Ikatan antarmolekul adalah gaya tarik-menarik yang terjadi antara molekul-molekul yang berdekatan. Ikatan antarmolekul ini lebih lemah daripada ikatan kovalen atau ikatan ionik yang terjadi di dalam molekul.
Hubungan Bentuk Molekul dan Ikatan Antarmolekul
Bentuk molekul memengaruhi kekuatan dan jenis ikatan antarmolekul yang terjadi. Berikut beberapa hubungannya:
- Molekul polar cenderung memiliki ikatan antarmolekul yang lebih kuat daripada molekul nonpolar karena adanya gaya tarik-menarik dipol-dipol.
- Molekul dengan bentuk yang memungkinkan interaksi dipol-dipol yang kuat, seperti ikatan hidrogen, memiliki titik didih yang lebih tinggi dibandingkan dengan molekul dengan bentuk yang tidak memungkinkan interaksi tersebut.
- Molekul dengan bentuk yang memungkinkan interaksi van der Waals yang kuat memiliki titik didih yang lebih tinggi dibandingkan dengan molekul dengan bentuk yang tidak memungkinkan interaksi tersebut.
Contoh Senyawa dengan Berbagai Jenis Ikatan Antarmolekul
Berikut contoh senyawa dengan berbagai jenis ikatan antarmolekul dan perbedaan sifat-sifatnya:
-
Air (H2O)
Air memiliki bentuk molekul bengkok dengan dua pasangan elektron bebas di sekitar atom oksigen. Bentuk ini memungkinkan terbentuknya ikatan hidrogen yang kuat antara molekul-molekul air. Ikatan hidrogen ini menyebabkan air memiliki titik didih yang tinggi (100 °C) dan merupakan pelarut yang baik.
-
Metana (CH4)
Metana memiliki bentuk molekul tetrahedral dengan empat atom hidrogen yang mengelilingi atom karbon pusat. Bentuk ini tidak memungkinkan terbentuknya ikatan hidrogen. Metana hanya memiliki interaksi van der Waals yang lemah antara molekul-molekulnya. Akibatnya, metana memiliki titik didih yang rendah (-161 °C) dan tidak larut dalam air.
-
Etanol (C2H5OH)
Etanol memiliki bentuk molekul bengkok dengan satu pasangan elektron bebas di sekitar atom oksigen. Bentuk ini memungkinkan terbentuknya ikatan hidrogen antara molekul-molekul etanol. Ikatan hidrogen ini menyebabkan etanol memiliki titik didih yang lebih tinggi dibandingkan dengan metana (78 °C). Etanol juga larut dalam air karena dapat membentuk ikatan hidrogen dengan molekul air.
Tabel Bentuk Molekul, Jenis Ikatan Antarmolekul, dan Sifat-Sifat Senyawa
Berikut tabel yang berisi nama senyawa, bentuk molekul, jenis ikatan antarmolekul, dan sifat-sifatnya:
| Nama Senyawa | Bentuk Molekul | Jenis Ikatan Antarmolekul | Sifat-Sifat |
|---|---|---|---|
| Air (H2O) | Bengkok | Ikatan hidrogen | Titik didih tinggi, pelarut yang baik |
| Metana (CH4) | Tetrahedral | Interaksi van der Waals | Titik didih rendah, tidak larut dalam air |
| Etanol (C2H5OH) | Bengkok | Ikatan hidrogen | Titik didih lebih tinggi dibandingkan dengan metana, larut dalam air |
| Amonia (NH3) | Piramida trigonal | Ikatan hidrogen | Titik didih tinggi, pelarut yang baik |
| Karbon dioksida (CO2) | Linier | Interaksi dipol-dipol | Titik didih rendah, tidak larut dalam air |
Contoh Soal Bentuk Molekul dan Ikatan Antarmolekul
Bentuk molekul dan ikatan antarmolekul adalah konsep penting dalam kimia yang membantu kita memahami sifat-sifat suatu senyawa. Bentuk molekul ditentukan oleh susunan atom-atom dalam suatu molekul, sedangkan ikatan antarmolekul adalah gaya tarik-menarik yang terjadi antara molekul-molekul. Kedua konsep ini saling terkait erat, karena bentuk molekul memengaruhi jenis ikatan antarmolekul yang dapat terbentuk.
Menentukan Jenis Ikatan Antarmolekul Berdasarkan Bentuk Molekul
Untuk menentukan jenis ikatan antarmolekul yang terjadi pada suatu senyawa, kita perlu mengetahui bentuk molekulnya. Bentuk molekul dapat ditentukan dengan menggunakan teori VSEPR (Valence Shell Electron Pair Repulsion). Teori VSEPR menyatakan bahwa pasangan elektron valensi pada atom pusat akan saling tolak menolak dan akan mengatur diri sedemikian rupa sehingga jarak antar pasangan elektron menjadi maksimal.
- Contoh soal: Tentukan jenis ikatan antarmolekul yang terjadi pada molekul air (H2O).
- Pembahasan: Molekul air memiliki bentuk bengkok (V-shaped) karena atom oksigen memiliki dua pasangan elektron bebas. Bentuk bengkok ini menyebabkan molekul air memiliki momen dipol, sehingga ikatan antarmolekul yang terjadi adalah ikatan hidrogen.
Menentukan Bentuk Molekul Berdasarkan Jenis Ikatan Antarmolekul
Sebaliknya, kita juga dapat menentukan bentuk molekul berdasarkan jenis ikatan antarmolekul yang terjadi. Jenis ikatan antarmolekul yang terjadi pada suatu senyawa dapat memberikan petunjuk tentang bentuk molekulnya.
- Contoh soal: Tentukan bentuk molekul senyawa yang memiliki ikatan hidrogen.
- Pembahasan: Ikatan hidrogen terjadi antara atom hidrogen yang terikat pada atom elektronegatif (seperti oksigen, nitrogen, atau fluor) dengan pasangan elektron bebas pada atom elektronegatif lain. Senyawa yang memiliki ikatan hidrogen biasanya memiliki bentuk polar, seperti air (H2O), amonia (NH3), dan metanol (CH3OH).
Menentukan Sifat-Sifat Senyawa Berdasarkan Jenis Ikatan Antarmolekul
Jenis ikatan antarmolekul yang terjadi pada suatu senyawa memengaruhi sifat-sifat fisikanya, seperti titik lebur, titik didih, dan kelarutan. Senyawa dengan ikatan antarmolekul yang kuat cenderung memiliki titik lebur dan titik didih yang tinggi, serta kelarutan yang lebih baik dalam pelarut polar.
- Contoh soal: Jelaskan mengapa air memiliki titik didih yang lebih tinggi dibandingkan dengan metana (CH4).
- Pembahasan: Air memiliki ikatan hidrogen, sedangkan metana hanya memiliki ikatan Van der Waals. Ikatan hidrogen jauh lebih kuat dibandingkan dengan ikatan Van der Waals. Oleh karena itu, dibutuhkan lebih banyak energi untuk memutuskan ikatan hidrogen pada air, sehingga air memiliki titik didih yang lebih tinggi.
Aplikasi Bentuk Molekul dalam Kehidupan Sehari-hari
Bentuk molekul merupakan aspek penting dalam kimia yang memengaruhi sifat dan fungsi senyawa. Bentuk molekul menentukan bagaimana molekul berinteraksi satu sama lain, bagaimana mereka bereaksi dengan molekul lain, dan bagaimana mereka berfungsi dalam sistem biologis. Bentuk molekul dapat diprediksi dengan menggunakan teori VSEPR (Valence Shell Electron Pair Repulsion), yang menyatakan bahwa pasangan elektron valensi pada atom pusat akan saling tolak menolak dan mengatur diri sedemikian rupa sehingga meminimalkan tolakan tersebut.
Bentuk Molekul dan Sifat Senyawa
Bentuk molekul memiliki peran penting dalam menentukan sifat-sifat senyawa. Berikut adalah beberapa contoh:
- Titik Didih dan Titik Leleh: Molekul dengan bentuk simetris dan nonpolar, seperti metana (CH4), memiliki titik didih dan titik leleh yang rendah karena gaya antarmolekulnya lemah. Sebaliknya, molekul dengan bentuk asimetris dan polar, seperti air (H2O), memiliki titik didih dan titik leleh yang tinggi karena gaya antarmolekulnya kuat.
- Kelarutan: Molekul polar cenderung larut dalam pelarut polar, seperti air, sedangkan molekul nonpolar cenderung larut dalam pelarut nonpolar, seperti minyak. Contohnya, gula (C12H22O11) yang bersifat polar larut dalam air, sedangkan minyak yang bersifat nonpolar tidak larut dalam air.
- Aktivitas Biologis: Bentuk molekul sangat penting dalam aktivitas biologis. Misalnya, enzim memiliki bentuk tiga dimensi yang spesifik yang memungkinkan mereka berikatan dengan substrat tertentu dan mengkatalis reaksi kimia tertentu.
Ulasan Penutup
Dengan memahami konsep bentuk molekul, kita dapat memprediksi sifat-sifat senyawa dan mengaplikasikannya dalam berbagai bidang. Misalnya, dalam pengembangan obat, bentuk molekul sangat penting untuk menentukan efektivitas dan keamanan obat. Dalam industri kimia, bentuk molekul memengaruhi sifat-sifat bahan kimia yang digunakan dalam berbagai proses produksi. Melalui pemahaman yang lebih dalam tentang bentuk molekul, kita dapat membuka pintu menuju inovasi dan pengembangan teknologi baru.





