Contoh soal defek massa – Pernahkah kamu bertanya-tanya mengapa inti atom memiliki energi yang sangat besar? Rahasianya terletak pada konsep defek massa, sebuah fenomena fisika yang menarik. Defek massa adalah selisih antara massa inti atom dengan jumlah massa proton dan neutron penyusunnya. Bayangkan sebuah atom seperti kue, di mana massa inti adalah berat kue, dan massa proton dan neutron adalah berat bahan-bahan pembuat kue. Defek massa adalah selisih berat antara kue dan bahan-bahannya. Selisih ini mungkin terlihat kecil, tetapi di dunia atom, selisih ini menyimpan energi yang luar biasa besar!
Contoh soal defek massa akan membantumu memahami konsep ini lebih dalam. Dengan memahami konsep defek massa, kamu akan dapat menghitung energi ikatan inti, yang merupakan energi yang dibutuhkan untuk memisahkan inti atom menjadi proton dan neutron. Energi ini sangat besar, bahkan dapat digunakan untuk menghasilkan energi listrik, seperti di PLTN.
Pengertian Defek Massa
Defek massa adalah fenomena menarik dalam fisika nuklir yang menggambarkan perbedaan antara massa inti atom dengan jumlah massa proton dan neutron penyusunnya. Sederhananya, massa inti atom selalu lebih kecil daripada penjumlahan massa proton dan neutron yang membentuknya. Perbedaan massa ini disebut sebagai defek massa, yang kemudian diubah menjadi energi ikat inti.
Contoh Defek Massa dalam Kehidupan Sehari-hari
Meskipun defek massa terjadi pada skala atom, kita dapat melihat contohnya dalam kehidupan sehari-hari melalui proses pembangkitan energi di matahari. Matahari menghasilkan energi melalui reaksi fusi nuklir, di mana atom hidrogen bergabung membentuk atom helium. Dalam proses ini, terjadi defek massa, yaitu massa atom helium lebih kecil daripada jumlah massa atom hidrogen yang bergabung. Defek massa ini diubah menjadi energi yang luar biasa besar, yang kemudian dipancarkan sebagai cahaya dan panas yang kita rasakan di bumi.
Perbandingan Massa Inti Atom dengan Jumlah Massa Proton dan Neutron
| Nuklida | Massa Inti Atom (amu) | Jumlah Massa Proton dan Neutron (amu) | Defek Massa (amu) |
|---|---|---|---|
| Hidrogen-1 (1H) | 1.007825 | 1.007825 | 0 |
| Helium-4 (4He) | 4.002603 | 4.031883 | 0.029280 |
| Karbon-12 (12C) | 12.000000 | 12.098943 | 0.098943 |
| Oksigen-16 (16O) | 15.994915 | 16.129293 | 0.134378 |
Rumus Defek Massa
Defek massa adalah perbedaan antara massa inti atom dengan jumlah massa proton dan neutron penyusunnya. Fenomena ini menunjukkan bahwa massa inti atom lebih kecil daripada jumlah massa proton dan neutron penyusunnya. Perbedaan massa ini diubah menjadi energi ikat inti yang mengikat proton dan neutron dalam inti atom.
Rumus Defek Massa
Rumus defek massa dapat dirumuskan sebagai berikut:
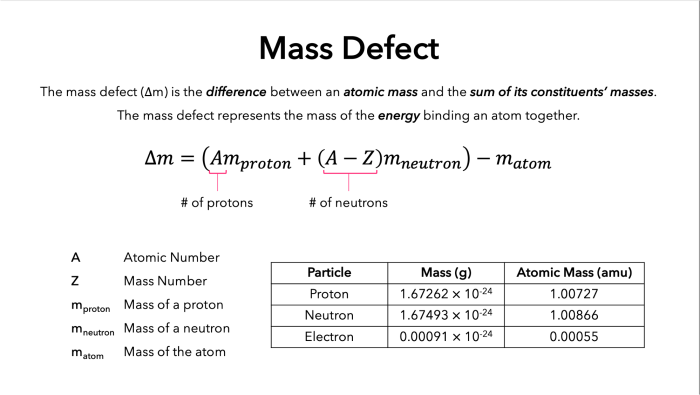
Δm = (Zmp + N mn) – minti
Keterangan:
- Δm = defek massa (satuan massa atom, sma)
- Z = jumlah proton dalam inti atom
- N = jumlah neutron dalam inti atom
- mp = massa proton (1,00728 sma)
- mn = massa neutron (1,00866 sma)
- minti = massa inti atom (satuan massa atom, sma)
Contoh Perhitungan Defek Massa
Sebagai contoh, kita akan menghitung defek massa atom Helium-4 (4He). Atom Helium-4 memiliki 2 proton dan 2 neutron. Massa proton adalah 1,00728 sma, massa neutron adalah 1,00866 sma, dan massa inti Helium-4 adalah 4,00150 sma.
Maka, defek massa Helium-4 dapat dihitung sebagai berikut:
Δm = (2 x 1,00728 sma + 2 x 1,00866 sma) – 4,00150 sma
Δm = 2,01594 sma + 2,01732 sma – 4,00150 sma
Δm = 0,03176 sma
Jadi, defek massa Helium-4 adalah 0,03176 sma.
Flowchart Perhitungan Defek Massa
Berikut flowchart untuk menunjukkan langkah-langkah perhitungan defek massa:
[Ilustrasi flowchart di sini]
Flowchart ini menunjukkan langkah-langkah yang harus diikuti untuk menghitung defek massa. Pertama, kita perlu mengetahui jumlah proton dan neutron dalam inti atom. Kemudian, kita perlu mencari massa proton, massa neutron, dan massa inti atom. Setelah itu, kita dapat menggunakan rumus defek massa untuk menghitung defek massa.
Energi Ikatan Inti
Energi ikatan inti merupakan energi yang diperlukan untuk memisahkan inti atom menjadi nukleon-nukleon penyusunnya. Energi ini berbanding lurus dengan stabilitas inti atom. Semakin besar energi ikatan inti, semakin stabil inti atom tersebut.
Hubungan Defek Massa dan Energi Ikatan Inti
Defek massa dan energi ikatan inti memiliki hubungan yang erat. Defek massa adalah selisih antara massa inti atom dengan jumlah massa nukleon penyusunnya. Selisih massa ini diubah menjadi energi ikatan inti sesuai dengan persamaan Einstein, E=mc2. Semakin besar defek massa, semakin besar pula energi ikatan intinya, yang menunjukkan inti atom tersebut semakin stabil.
Rumus Energi Ikatan Inti
Energi ikatan inti dapat dihitung menggunakan rumus berikut:
Eikatan = Δm c2
Dimana:
- Eikatan adalah energi ikatan inti (dalam Joule)
- Δm adalah defek massa (dalam kg)
- c adalah kecepatan cahaya (3 x 108 m/s)
Contoh Perhitungan Energi Ikatan Inti
Misalnya, inti helium (4He) memiliki defek massa sebesar 0,03038 u. Untuk menghitung energi ikatan intinya, kita dapat menggunakan rumus di atas.
Pertama, ubah defek massa ke dalam satuan kg:
Δm = 0,03038 u x 1,6605 x 10-27 kg/u = 5,044 x 10-29 kg
Kemudian, masukkan nilai defek massa dan kecepatan cahaya ke dalam rumus:
Eikatan = (5,044 x 10-29 kg) x (3 x 108 m/s)2 = 4,54 x 10-12 J
Jadi, energi ikatan inti helium adalah 4,54 x 10-12 J. Energi ikatan inti yang besar ini menunjukkan bahwa inti helium sangat stabil.
Faktor yang Mempengaruhi Defek Massa
Defek massa merupakan selisih antara massa inti atom dengan jumlah massa proton dan neutron penyusunnya. Fenomena ini menunjukkan bahwa massa inti atom selalu lebih kecil dibandingkan dengan jumlah massa proton dan neutron penyusunnya. Nah, ada beberapa faktor yang dapat mempengaruhi besarnya defek massa ini, lho. Yuk, kita bahas satu per satu!
Jumlah Proton dan Neutron
Semakin banyak proton dan neutron dalam inti atom, semakin besar defek massanya. Hal ini karena gaya tarik-menarik antar nukleon (proton dan neutron) semakin kuat, sehingga energi ikat inti juga semakin besar. Ingat, energi ikat inti merupakan energi yang dibutuhkan untuk memisahkan semua nukleon dalam inti atom. Semakin besar energi ikat inti, semakin kecil massa inti atom.
Rasio Proton terhadap Neutron
Stabilitas inti atom dipengaruhi oleh rasio proton terhadap neutron. Untuk inti atom yang ringan, rasio proton terhadap neutron yang ideal adalah 1:1. Namun, untuk inti atom yang lebih berat, rasio ini cenderung lebih besar dari 1:1. Jika rasio proton terhadap neutron terlalu besar atau terlalu kecil, inti atom akan menjadi tidak stabil dan mudah mengalami peluruhan radioaktif.
Energi Ikat Per Nukleon
Energi ikat per nukleon merupakan energi ikat inti dibagi dengan jumlah nukleon dalam inti atom. Semakin besar energi ikat per nukleon, semakin stabil inti atom tersebut. Defek massa juga berpengaruh pada energi ikat per nukleon. Semakin besar defek massa, semakin besar energi ikat per nukleon, dan semakin stabil inti atom.
Struktur Inti Atom
Struktur inti atom juga dapat mempengaruhi defek massa. Misalnya, inti atom dengan konfigurasi nukleon yang lebih stabil cenderung memiliki defek massa yang lebih besar. Ini karena gaya tarik-menarik antar nukleon lebih kuat dalam konfigurasi yang lebih stabil.
Tabel Faktor yang Mempengaruhi Defek Massa
| Faktor | Efek terhadap Defek Massa | Efek terhadap Stabilitas Inti |
|---|---|---|
| Jumlah Proton dan Neutron | Semakin banyak proton dan neutron, semakin besar defek massa. | Semakin besar defek massa, semakin stabil inti atom. |
| Rasio Proton terhadap Neutron | Rasio ideal untuk inti atom ringan adalah 1:1. Untuk inti atom yang lebih berat, rasio ini cenderung lebih besar dari 1:1. | Rasio yang ideal meningkatkan stabilitas inti atom. |
| Energi Ikat Per Nukleon | Semakin besar defek massa, semakin besar energi ikat per nukleon. | Semakin besar energi ikat per nukleon, semakin stabil inti atom. |
| Struktur Inti Atom | Konfigurasi nukleon yang lebih stabil cenderung memiliki defek massa yang lebih besar. | Konfigurasi yang lebih stabil meningkatkan stabilitas inti atom. |
Contoh Soal Defek Massa
Defek massa adalah konsep yang penting dalam fisika nuklir, yang menggambarkan perbedaan antara massa inti atom dan jumlah massa proton dan neutron yang menyusunnya. Konsep ini berhubungan erat dengan energi ikatan inti, yang merupakan energi yang diperlukan untuk memecah inti atom menjadi nukleon-nukleon penyusunnya. Defek massa ini dapat dihitung dengan menggunakan persamaan terkenal Einstein, E=mc2, di mana energi (E) sebanding dengan massa (m) dikali kuadrat kecepatan cahaya (c).
Contoh Soal Defek Massa dan Perhitungan Energi Ikatan Inti
Berikut adalah contoh soal defek massa yang melibatkan perhitungan energi ikatan inti:
- Hitunglah defek massa dan energi ikatan inti dari atom helium-4 (4He), yang memiliki 2 proton dan 2 neutron. Diketahui massa proton = 1,007276 sma, massa neutron = 1,008665 sma, dan massa atom helium-4 = 4,001506 sma. (1 sma = 931,5 MeV/c2).
Langkah-langkah Penyelesaian
Untuk menyelesaikan soal ini, kita dapat mengikuti langkah-langkah berikut:
- Hitung massa total proton dan neutron dalam inti helium-4: (2 proton x 1,007276 sma/proton) + (2 neutron x 1,008665 sma/neutron) = 4,031882 sma.
- Hitung defek massa: Defek massa = (massa total proton dan neutron) – (massa atom helium-4) = 4,031882 sma – 4,001506 sma = 0,030376 sma.
- Hitung energi ikatan inti: Energi ikatan inti = defek massa x (931,5 MeV/c2/sma) = 0,030376 sma x 931,5 MeV/c2/sma = 28,29 MeV.
Konsep Defek Massa dalam Contoh Soal
Dalam contoh soal ini, kita dapat melihat bahwa massa atom helium-4 lebih kecil daripada jumlah massa proton dan neutron yang menyusunnya. Perbedaan massa ini, yang disebut defek massa, diubah menjadi energi ikatan inti. Energi ini merupakan energi yang diperlukan untuk memecah inti helium-4 menjadi nukleon-nukleon penyusunnya. Semakin besar defek massa, semakin besar energi ikatan intinya, yang menunjukkan inti atom tersebut semakin stabil.
Penerapan Defek Massa
Konsep defek massa memiliki peran penting dalam berbagai bidang, terutama dalam energi nuklir dan teknologi medis. Defek massa adalah selisih antara massa inti atom dengan jumlah massa proton dan neutron yang menyusunnya. Selisih ini diubah menjadi energi yang luar biasa besar sesuai dengan persamaan Einstein, E=mc2. Energi ini yang kemudian dimanfaatkan untuk berbagai keperluan.
Energi Nuklir
Penerapan defek massa dalam energi nuklir sangat signifikan, terutama dalam pembangkitan energi listrik. Reaksi nuklir, seperti fisi dan fusi, memanfaatkan konsep defek massa untuk menghasilkan energi yang besar.
- Fisi nuklir melibatkan pembelahan inti atom berat, seperti uranium, menjadi inti atom yang lebih ringan. Proses ini melepaskan sejumlah besar energi yang dapat digunakan untuk menghasilkan energi listrik. Contohnya, pembangkit listrik tenaga nuklir menggunakan reaksi fisi nuklir untuk menghasilkan energi listrik.
- Fusi nuklir melibatkan penggabungan inti atom ringan, seperti hidrogen, menjadi inti atom yang lebih berat. Reaksi ini melepaskan energi yang jauh lebih besar daripada fisi nuklir. Contohnya, matahari memanfaatkan fusi nuklir untuk menghasilkan energi yang luar biasa besar.
Teknologi Medis
Defek massa juga memiliki peran penting dalam teknologi medis, khususnya dalam bidang diagnosis dan terapi.
- Pencitraan medis, seperti PET scan (Positron Emission Tomography), memanfaatkan emisi positron, yaitu partikel antimateri yang dipancarkan dari isotop radioaktif yang digunakan dalam prosedur pencitraan. Positron ini kemudian berinteraksi dengan elektron dalam tubuh dan melepaskan energi berupa sinar gamma yang dapat dideteksi oleh scanner. Proses ini memanfaatkan konsep defek massa karena energi yang dilepaskan dari peluruhan radioaktif berasal dari defek massa inti atom.
- Terapi radiasi menggunakan isotop radioaktif untuk mengobati kanker. Isotop ini memancarkan radiasi yang dapat membunuh sel kanker. Defek massa berperan dalam proses peluruhan radioaktif yang menghasilkan radiasi yang digunakan dalam terapi.
Tabel Penerapan Defek Massa
| Bidang | Penerapan | Dampak |
|---|---|---|
| Energi Nuklir | Fisi nuklir, Fusi nuklir | Pembangkitan energi listrik, pengembangan senjata nuklir |
| Teknologi Medis | Pencitraan medis (PET scan), Terapi radiasi | Diagnosis penyakit, pengobatan kanker |
Defek Massa dan Stabilitas Inti
Defek massa merupakan fenomena yang menarik dalam fisika nuklir. Konsep ini menjelaskan mengapa massa inti atom lebih kecil daripada jumlah massa proton dan neutron yang membentuknya. Defek massa ini ternyata memiliki hubungan erat dengan stabilitas inti atom. Semakin besar defek massa, semakin besar energi ikatan inti, dan semakin stabil inti atom tersebut.
Hubungan Defek Massa dan Stabilitas Inti
Defek massa merupakan selisih antara massa inti atom dengan jumlah massa proton dan neutron yang membentuknya. Selisih massa ini diubah menjadi energi ikatan inti melalui persamaan terkenal Einstein, E=mc2. Energi ikatan inti merupakan energi yang diperlukan untuk memisahkan inti atom menjadi proton dan neutron penyusunnya. Semakin besar energi ikatan inti, semakin sulit untuk memisahkan inti atom menjadi komponen-komponen penyusunnya, sehingga inti atom menjadi lebih stabil.
Secara sederhana, semakin besar defek massa, semakin besar energi ikatan inti, dan semakin stabil inti atom tersebut. Sebaliknya, jika defek massa kecil, maka energi ikatan inti juga kecil, dan inti atom menjadi lebih tidak stabil. Inti atom yang tidak stabil cenderung mengalami peluruhan radioaktif untuk mencapai konfigurasi yang lebih stabil.
Contoh Inti Atom Stabil dan Tidak Stabil
Berikut beberapa contoh inti atom stabil dan tidak stabil berdasarkan defek massanya:
- Inti atom Helium-4 (4He) memiliki defek massa yang besar, sehingga memiliki energi ikatan inti yang tinggi. Inti Helium-4 merupakan inti atom yang sangat stabil. Ini adalah alasan mengapa Helium-4 merupakan inti atom yang sangat melimpah di alam semesta.
- Inti atom Uranium-238 (238U) memiliki defek massa yang relatif kecil, sehingga memiliki energi ikatan inti yang lebih rendah. Inti Uranium-238 merupakan inti atom yang tidak stabil dan mengalami peluruhan radioaktif. Peluruhan radioaktif ini menghasilkan inti atom yang lebih stabil, seperti Thorium-234 (234Th).
Diagram Hubungan Defek Massa, Energi Ikatan Inti, dan Stabilitas Inti, Contoh soal defek massa
Diagram berikut menunjukkan hubungan antara defek massa, energi ikatan inti, dan stabilitas inti atom:
Diagram yang menunjukkan hubungan antara defek massa, energi ikatan inti, dan stabilitas inti atom. Sumbu horizontal menunjukkan nomor massa inti atom. Sumbu vertikal menunjukkan defek massa dan energi ikatan inti. Grafik menunjukkan bahwa defek massa dan energi ikatan inti meningkat seiring dengan meningkatnya nomor massa, hingga mencapai puncaknya di inti atom besi-56 (56Fe). Setelah itu, defek massa dan energi ikatan inti menurun. Inti atom dengan defek massa dan energi ikatan inti yang tinggi lebih stabil. Inti atom dengan defek massa dan energi ikatan inti yang rendah lebih tidak stabil.
Defek Massa dan Reaksi Nuklir
Defek massa adalah fenomena yang terjadi dalam inti atom, di mana massa inti atom lebih kecil daripada jumlah massa proton dan neutron yang menyusunnya. Perbedaan massa ini diubah menjadi energi ikat yang mengikat proton dan neutron bersama-sama dalam inti atom. Konsep defek massa memiliki peran penting dalam memahami reaksi nuklir, khususnya dalam pelepasan energi yang terjadi pada reaksi tersebut.
Bagaimana Defek Massa Berperan dalam Reaksi Nuklir
Dalam reaksi nuklir, inti atom mengalami perubahan susunan proton dan neutronnya. Hal ini dapat menyebabkan perubahan defek massa, yang berdampak pada energi yang dilepaskan atau diserap dalam reaksi.
- Reaksi Fusi: Dalam reaksi fusi, inti atom ringan bergabung membentuk inti atom yang lebih berat. Karena inti atom yang lebih berat memiliki defek massa yang lebih besar, maka reaksi fusi melepaskan energi. Contohnya adalah fusi hidrogen menjadi helium, yang merupakan reaksi yang terjadi di matahari.
- Reaksi Fisi: Dalam reaksi fisi, inti atom berat dipecah menjadi inti atom yang lebih ringan. Karena inti atom yang lebih ringan memiliki defek massa yang lebih kecil, maka reaksi fisi juga melepaskan energi. Contohnya adalah fisi uranium, yang digunakan dalam pembangkit listrik tenaga nuklir.
Contoh Reaksi Nuklir yang Melibatkan Defek Massa
Salah satu contoh reaksi nuklir yang melibatkan konsep defek massa adalah reaksi fusi hidrogen menjadi helium. Reaksi ini dapat dituliskan sebagai berikut:
2H + 3H → 4He + 1n + 17.6 MeV
Dalam reaksi ini, dua inti atom hidrogen, yaitu deuterium (2H) dan tritium (3H), bergabung membentuk inti atom helium (4He) dan sebuah neutron (1n). Reaksi ini melepaskan energi sebesar 17.6 MeV. Energi ini berasal dari defek massa, yaitu perbedaan massa antara inti atom reaktan dan produk. Dalam hal ini, massa inti atom helium dan neutron lebih kecil daripada massa inti atom deuterium dan tritium. Perbedaan massa ini diubah menjadi energi yang dilepaskan dalam reaksi.
Diagram Proses Pelepasan Energi dalam Reaksi Nuklir
Diagram berikut menunjukkan proses pelepasan energi dalam reaksi nuklir berdasarkan konsep defek massa:
[Ilustrasi diagram di sini, yang menunjukkan perbedaan massa antara reaktan dan produk, dan energi yang dilepaskan sebagai hasil dari defek massa]
Diagram ini menunjukkan bahwa defek massa diubah menjadi energi ikat yang mengikat proton dan neutron bersama-sama dalam inti atom. Ketika inti atom mengalami perubahan susunan proton dan neutronnya, seperti dalam reaksi nuklir, defek massa berubah, dan energi dilepaskan atau diserap. Energi yang dilepaskan atau diserap ini sesuai dengan perbedaan defek massa antara reaktan dan produk.
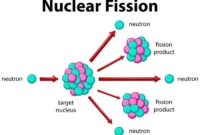
Defek Massa dan Fisi Nuklir
Defek massa merupakan konsep penting dalam fisika nuklir yang menjelaskan perbedaan massa antara inti atom dan jumlah massa proton dan neutron penyusunnya. Defek massa ini berhubungan erat dengan energi ikat inti, yaitu energi yang diperlukan untuk memisahkan inti atom menjadi proton dan neutron penyusunnya. Semakin besar defek massa, semakin besar energi ikat inti, dan semakin stabil inti atom tersebut.
Fisi nuklir merupakan proses pembelahan inti atom berat menjadi dua atau lebih inti atom yang lebih ringan, disertai dengan pelepasan energi yang sangat besar. Proses ini terjadi ketika inti atom berat menyerap neutron, yang menyebabkan inti menjadi tidak stabil dan akhirnya terbelah. Defek massa berperan penting dalam proses fisi nuklir karena pelepasan energi yang terjadi berasal dari konversi defek massa menjadi energi sesuai dengan persamaan E=mc2, di mana E adalah energi, m adalah massa, dan c adalah kecepatan cahaya.
Contoh Reaksi Fisi Nuklir
Salah satu contoh reaksi fisi nuklir adalah pembelahan inti Uranium-235 (235U) oleh neutron. Reaksi ini dapat ditulis sebagai berikut:
235U + 1n → 141Ba + 92Kr + 31n + energi
Dalam reaksi ini, inti Uranium-235 menyerap neutron, menjadi tidak stabil dan terbelah menjadi inti Barium-141 (141Ba) dan Kripton-92 (92Kr), serta melepaskan tiga neutron dan energi. Defek massa dalam reaksi ini adalah perbedaan antara massa inti Uranium-235 dan neutron dengan massa inti Barium-141, Kripton-92, dan neutron yang dihasilkan. Defek massa ini diubah menjadi energi yang dilepaskan dalam reaksi fisi.
Diagram Proses Fisi Nuklir
Berikut diagram yang menunjukkan proses fisi nuklir dan peranan defek massa dalam pelepasan energi:
- Inti atom berat (misalnya, Uranium-235) menyerap neutron, menjadi tidak stabil.
- Inti atom berat terbelah menjadi dua atau lebih inti atom yang lebih ringan (misalnya, Barium-141 dan Kripton-92), disertai dengan pelepasan neutron dan energi.
- Defek massa dalam reaksi ini diubah menjadi energi yang dilepaskan sesuai dengan persamaan E=mc2.
Energi yang dilepaskan dalam reaksi fisi ini sangat besar, jauh lebih besar daripada energi yang dilepaskan dalam reaksi kimia. Energi ini dapat digunakan untuk menghasilkan energi listrik di pembangkit listrik tenaga nuklir atau untuk membuat senjata nuklir.
Contoh soal defek massa biasanya muncul dalam materi fisika, khususnya terkait energi ikatan inti atom. Nah, untuk mempersiapkan diri menghadapi UTBK SBMPTN, kamu bisa berlatih dengan contoh soal-soal tahun sebelumnya. Contoh soal UTBK SBMPTN 2019 Soshum bisa jadi referensi yang bagus untuk memahami pola soal dan tingkat kesulitan.
Latihan soal seperti ini juga bisa membantumu mengasah kemampuan dalam memahami konsep defek massa dan mengaplikasikannya dalam soal-soal ujian.
Defek Massa dan Fusi Nuklir
Defek massa adalah konsep penting dalam fisika nuklir yang menjelaskan mengapa energi dilepaskan selama reaksi nuklir seperti fusi nuklir. Defek massa mengacu pada perbedaan massa antara inti atom dan jumlah massa proton dan neutron yang membentuknya. Perbedaan massa ini, meskipun kecil, diubah menjadi energi yang luar biasa besar sesuai dengan persamaan terkenal Einstein, E=mc2. Dalam fusi nuklir, dua atau lebih inti atom ringan bergabung membentuk inti atom yang lebih berat, dan proses ini menghasilkan energi yang sangat besar.
Peran Defek Massa dalam Fusi Nuklir
Defek massa memainkan peran penting dalam proses fusi nuklir karena merupakan sumber utama energi yang dilepaskan. Ketika inti atom ringan bergabung, massa total inti hasil reaksi lebih kecil daripada massa total inti yang bereaksi. Perbedaan massa ini, yang dikenal sebagai defek massa, diubah menjadi energi yang sangat besar sesuai dengan persamaan E=mc2. Energi ini dilepaskan sebagai energi kinetik partikel yang dihasilkan, seperti foton atau partikel alfa, dan menghasilkan panas yang luar biasa.
Contoh Reaksi Fusi Nuklir
Salah satu contoh reaksi fusi nuklir yang paling terkenal adalah reaksi fusi hidrogen, yang terjadi di matahari dan bintang lainnya. Reaksi ini melibatkan fusi dua inti deuterium (2H) untuk membentuk inti helium (4He) dan melepaskan neutron. Persamaan reaksinya adalah:
2H + 2H → 4He + n
Dalam reaksi ini, defek massa adalah sekitar 0,0283 unit massa atom (amu). Defek massa ini diubah menjadi energi yang sangat besar, sekitar 3,8 x 10-12 joule per reaksi. Energi ini dilepaskan sebagai energi kinetik neutron dan inti helium, serta energi foton gamma. Energi yang dilepaskan dari reaksi fusi hidrogen adalah sumber energi utama matahari dan bintang lainnya.
Diagram Proses Fusi Nuklir dan Peran Defek Massa
Berikut adalah diagram yang menunjukkan proses fusi nuklir dan peranan defek massa dalam pelepasan energi:
[Diagram menunjukkan dua inti deuterium yang mendekat satu sama lain. Ketika mereka bersentuhan, mereka bergabung membentuk inti helium dan melepaskan neutron. Perbedaan massa antara inti deuterium dan inti helium ditunjukkan sebagai defek massa, yang diubah menjadi energi kinetik neutron dan inti helium, serta energi foton gamma.]
Diagram ini menunjukkan bahwa defek massa adalah sumber utama energi yang dilepaskan dalam fusi nuklir. Energi ini dilepaskan sebagai energi kinetik partikel yang dihasilkan, seperti foton atau partikel alfa, dan menghasilkan panas yang luar biasa.
Kesimpulan Akhir: Contoh Soal Defek Massa
Mempelajari defek massa bukan hanya tentang rumus dan perhitungan, tetapi juga tentang memahami kekuatan luar biasa yang tersimpan dalam inti atom. Dengan memahami konsep ini, kita dapat memanfaatkan energi atom secara bertanggung jawab dan membuka jalan menuju teknologi baru yang menakjubkan.