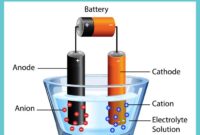
Contoh soal elektrolit – Pernahkah kamu bertanya-tanya mengapa larutan garam dapat menghantarkan listrik, sementara air murni tidak? Rahasianya terletak pada keberadaan elektrolit, zat yang dapat terurai menjadi ion dalam larutan, memungkinkan aliran listrik. Artikel ini akan membahas berbagai contoh soal tentang elektrolit, mulai dari pengertian dasar hingga aplikasi dalam kehidupan sehari-hari.
Melalui contoh soal yang menarik, kita akan menjelajahi konsep elektrolit, mempelajari sifat-sifatnya, dan bagaimana mereka berperan dalam berbagai bidang, seperti industri dan kesehatan. Siap untuk menyelami dunia elektrolit dan menguji pemahamanmu?
Pengertian Elektrolit
Elektrolit adalah zat yang dapat menghantarkan arus listrik ketika dilarutkan dalam air atau dalam keadaan cair. Kemampuannya untuk menghantarkan arus listrik ini disebabkan oleh adanya ion-ion bebas yang bergerak dalam larutan.
Contoh Zat Elektrolit
Banyak zat yang termasuk dalam kategori elektrolit, baik dalam kehidupan sehari-hari maupun dalam dunia kimia. Berikut beberapa contohnya:
- Garam dapur (NaCl): Ketika garam dapur dilarutkan dalam air, akan terurai menjadi ion natrium (Na+) dan ion klorida (Cl-) yang bebas bergerak dan menghantarkan arus listrik.
- Asam cuka (CH3COOH): Asam cuka merupakan asam lemah yang terionisasi sebagian dalam air, menghasilkan ion hidrogen (H+) dan ion asetat (CH3COO-) yang menghantarkan arus listrik.
- Baterai mobil: Baterai mobil mengandung asam sulfat (H2SO4) yang terionisasi dalam air, menghasilkan ion hidrogen (H+) dan ion sulfat (SO42-) yang menghantarkan arus listrik.
- Air laut: Air laut mengandung garam-garam terlarut seperti natrium klorida (NaCl), magnesium klorida (MgCl2), dan kalsium sulfat (CaSO4) yang terionisasi dan menghantarkan arus listrik.
Perbedaan Elektrolit Kuat, Elektrolit Lemah, dan Non-Elektrolit
Elektrolit dapat dikategorikan berdasarkan kemampuannya untuk terionisasi dalam larutan. Ketiga kategori tersebut adalah elektrolit kuat, elektrolit lemah, dan non-elektrolit.
| Kategori | Pengertian | Contoh |
|---|---|---|
| Elektrolit Kuat | Elektrolit kuat adalah zat yang terionisasi sempurna dalam larutan, sehingga menghasilkan banyak ion bebas yang dapat menghantarkan arus listrik dengan baik. | Asam kuat (HCl, HNO3, H2SO4), basa kuat (NaOH, KOH, Ca(OH)2), garam terlarut (NaCl, KNO3) |
| Elektrolit Lemah | Elektrolit lemah adalah zat yang terionisasi sebagian dalam larutan, sehingga menghasilkan sedikit ion bebas yang dapat menghantarkan arus listrik dengan lemah. | Asam lemah (CH3COOH, H2CO3), basa lemah (NH3, NH4OH) |
| Non-Elektrolit | Non-elektrolit adalah zat yang tidak terionisasi dalam larutan, sehingga tidak menghasilkan ion bebas dan tidak dapat menghantarkan arus listrik. | Gula (C12H22O11), alkohol (C2H5OH), air murni (H2O) |
Sifat Elektrolit
Elektrolit adalah zat yang dapat menghantarkan arus listrik ketika dilarutkan dalam air atau dalam keadaan cair. Sifat ini membedakan elektrolit dari non-elektrolit, yang tidak dapat menghantarkan arus listrik dalam keadaan tersebut. Kemampuan elektrolit untuk menghantarkan arus listrik disebabkan oleh adanya ion-ion bebas yang dapat bergerak dan membawa muatan listrik.
Perbedaan Sifat Elektrolit dan Non-elektrolit
Berikut adalah beberapa sifat yang membedakan elektrolit dari non-elektrolit:
- Kemampuan Menghantarkan Arus Listrik: Elektrolit dapat menghantarkan arus listrik, sedangkan non-elektrolit tidak. Hal ini karena elektrolit memiliki ion-ion bebas yang dapat bergerak dan membawa muatan listrik, sedangkan non-elektrolit tidak memiliki ion-ion bebas.
- Tingkat Disosiasi: Elektrolit memiliki tingkat disosiasi yang tinggi, artinya mereka terurai menjadi ion-ion bebas dalam larutan. Non-elektrolit memiliki tingkat disosiasi yang rendah, artinya mereka tidak terurai menjadi ion-ion bebas dalam larutan.
- Titik Didih dan Titik Beku: Elektrolit memiliki titik didih yang lebih tinggi dan titik beku yang lebih rendah dibandingkan dengan non-elektrolit. Hal ini karena ion-ion bebas dalam larutan elektrolit mengganggu ikatan antar molekul pelarut, sehingga membutuhkan lebih banyak energi untuk mendidihkan atau membekukan larutan.
- Konduktivitas: Elektrolit memiliki konduktivitas yang tinggi, artinya mereka dapat menghantarkan arus listrik dengan mudah. Non-elektrolit memiliki konduktivitas yang rendah, artinya mereka tidak dapat menghantarkan arus listrik dengan mudah.
Contoh Elektrolit Menghantarkan Arus Listrik, Contoh soal elektrolit
Elektrolit dapat menghantarkan arus listrik karena adanya ion-ion bebas yang dapat bergerak dan membawa muatan listrik. Misalnya, larutan garam dapur (NaCl) merupakan elektrolit. Ketika garam dapur dilarutkan dalam air, ia akan terurai menjadi ion-ion natrium (Na+) dan ion-ion klorida (Cl-). Ion-ion ini bebas bergerak dalam larutan dan dapat menghantarkan arus listrik jika dihubungkan dengan sumber arus listrik.
Perbedaan Sifat Fisika dan Kimia Elektrolit
| Sifat | Elektrolit Kuat | Elektrolit Lemah | Non-elektrolit |
|---|---|---|---|
| Tingkat Disosiasi | Terdisosiasi sempurna | Terdisosiasi sebagian | Tidak terdisosiasi |
| Konduktivitas | Konduktivitas tinggi | Konduktivitas rendah | Tidak konduktif |
| Titik Didih | Titik didih tinggi | Titik didih sedikit lebih tinggi | Titik didih normal |
| Titik Beku | Titik beku rendah | Titik beku sedikit lebih rendah | Titik beku normal |
Pembentukan Elektrolit
Elektrolit terbentuk melalui proses ionisasi, yaitu proses di mana zat terlarut terurai menjadi ion-ion bermuatan listrik dalam suatu pelarut. Proses ini terjadi ketika molekul zat terlarut berinteraksi dengan molekul pelarut, menyebabkan pemisahan atom-atom dalam molekul zat terlarut menjadi ion positif (kation) dan ion negatif (anion). Proses ini sangat penting dalam berbagai aplikasi, mulai dari baterai hingga tubuh manusia.
Proses Ioniasi
Ioniasi merupakan proses di mana atom atau molekul netral kehilangan atau mendapatkan elektron, sehingga membentuk ion bermuatan listrik. Proses ini dapat terjadi dalam berbagai kondisi, termasuk dalam larutan elektrolit.
- Dalam larutan elektrolit, molekul zat terlarut berinteraksi dengan molekul pelarut, seperti air. Interaksi ini menyebabkan pemisahan atom-atom dalam molekul zat terlarut menjadi ion-ion.
- Contohnya, ketika garam dapur (NaCl) dilarutkan dalam air, molekul air akan menarik ion natrium (Na+) dan ion klorida (Cl-) dari kristal garam. Hal ini menyebabkan garam terurai menjadi ion-ion bermuatan listrik.
- Proses ionisasi ini dapat digambarkan dengan reaksi kimia, di mana zat terlarut (NaCl) terurai menjadi ion-ion (Na+ dan Cl-):
NaCl (s) → Na+ (aq) + Cl- (aq)
Dalam reaksi ini, (s) menunjukkan keadaan padat dan (aq) menunjukkan keadaan larutan. Panah menunjukkan arah reaksi, yang dalam hal ini menunjukkan pemisahan garam menjadi ion-ion dalam larutan.
Contoh Reaksi Ioniasi
Elektrolit Kuat
Elektrolit kuat adalah zat yang terionisasi sepenuhnya dalam larutan. Ini berarti bahwa semua molekul zat terlarut terurai menjadi ion-ion. Contoh reaksi ionisasi untuk elektrolit kuat adalah:
- Asam kuat, seperti asam klorida (HCl):
HCl (aq) → H+ (aq) + Cl- (aq)
- Basa kuat, seperti natrium hidroksida (NaOH):
NaOH (aq) → Na+ (aq) + OH- (aq)
Dalam reaksi ini, semua molekul HCl dan NaOH terionisasi sepenuhnya menjadi ion-ion dalam larutan.
Elektrolit Lemah
Elektrolit lemah adalah zat yang hanya terionisasi sebagian dalam larutan. Ini berarti bahwa hanya sebagian kecil molekul zat terlarut yang terurai menjadi ion-ion. Contoh reaksi ionisasi untuk elektrolit lemah adalah:
- Asam lemah, seperti asam asetat (CH3COOH):
CH3COOH (aq) ⇌ H+ (aq) + CH3COO- (aq)
Dalam reaksi ini, hanya sebagian kecil molekul asam asetat yang terionisasi menjadi ion-ion dalam larutan. Panah bolak-balik menunjukkan bahwa reaksi dapat berlangsung ke kedua arah, yaitu ion-ion dapat bergabung kembali membentuk molekul asam asetat.
Ilustrasi Proses Ioniasi
Ilustrasi proses ionisasi dalam larutan elektrolit dapat digambarkan sebagai berikut:
- Misalnya, ketika garam dapur (NaCl) dilarutkan dalam air, molekul air akan mengelilingi ion natrium (Na+) dan ion klorida (Cl-) dari kristal garam.
- Molekul air memiliki kutub positif dan negatif, yang memungkinkan mereka untuk menarik ion-ion bermuatan listrik. Kutub positif molekul air akan menarik ion klorida (Cl-) yang bermuatan negatif, sementara kutub negatif molekul air akan menarik ion natrium (Na+) yang bermuatan positif.
- Proses ini menyebabkan garam terurai menjadi ion-ion bermuatan listrik yang dikelilingi oleh molekul air. Ion-ion ini kemudian dapat bergerak bebas dalam larutan, memungkinkan larutan tersebut untuk menghantarkan arus listrik.
Aplikasi Elektrolit
Elektrolit memiliki peran penting dalam berbagai aspek kehidupan sehari-hari, dari baterai yang memberi daya pada perangkat elektronik hingga proses industri yang kompleks. Elektrolit adalah zat yang dapat menghantarkan arus listrik karena mengandung ion yang bergerak bebas. Kemampuan ini membuat elektrolit menjadi komponen penting dalam berbagai aplikasi, mulai dari sumber energi hingga proses kimia.
Aplikasi Elektrolit dalam Kehidupan Sehari-hari
Elektrolit hadir dalam berbagai produk dan proses yang kita gunakan setiap hari. Berikut adalah beberapa contohnya:
- Baterai: Baterai, baik itu baterai kering untuk perangkat elektronik atau baterai isi ulang untuk kendaraan, menggunakan elektrolit untuk memungkinkan aliran arus listrik. Elektrolit dalam baterai biasanya berupa larutan asam, basa, atau garam. Contohnya, baterai asam timbal menggunakan asam sulfat sebagai elektrolit, sementara baterai alkali menggunakan larutan kalium hidroksida.
- Aki: Aki mobil merupakan jenis baterai yang menggunakan elektrolit asam sulfat untuk menyimpan energi dan menghidupkan mesin. Aki bekerja berdasarkan reaksi kimia yang melibatkan pertukaran ion dalam elektrolit.
- Minuman Isotonik: Minuman isotonik, seperti minuman olahraga, mengandung elektrolit seperti natrium, kalium, dan magnesium. Elektrolit ini membantu mengganti cairan dan elektrolit yang hilang melalui keringat selama aktivitas fisik yang berat.
- Makanan: Elektrolit juga ditemukan dalam makanan seperti buah-buahan, sayuran, dan produk susu. Natrium, kalium, dan kalsium adalah elektrolit penting yang berperan dalam fungsi tubuh, seperti kontraksi otot dan keseimbangan cairan.
- Obat-obatan: Beberapa obat-obatan, seperti obat pencahar, mengandung elektrolit untuk membantu proses pencernaan dan penyerapan nutrisi.
Elektrolit dalam Baterai, Aki, dan Sel Elektrokimia
Baterai, aki, dan sel elektrokimia memanfaatkan sifat konduktif elektrolit untuk menghasilkan arus listrik. Proses ini melibatkan reaksi kimia yang terjadi antara elektroda dan elektrolit. Berikut adalah penjelasan singkat tentang bagaimana elektrolit berperan dalam ketiga jenis sistem tersebut:
- Baterai: Baterai menggunakan reaksi redoks (reduksi-oksidasi) untuk menghasilkan arus listrik. Elektrolit memungkinkan pergerakan ion antara elektroda positif dan negatif, sehingga reaksi redoks dapat berlangsung. Aliran ion ini menghasilkan arus listrik yang dapat digunakan untuk memberi daya pada perangkat elektronik.
- Aki: Aki bekerja berdasarkan prinsip yang sama dengan baterai, tetapi dirancang untuk menghasilkan arus listrik yang lebih besar dan tahan lama. Elektrolit dalam aki, biasanya asam sulfat, memungkinkan pertukaran ion antara elektroda timbal dan timbal dioksida, menghasilkan arus listrik yang digunakan untuk menghidupkan mesin kendaraan.
- Sel Elektrokimia: Sel elektrokimia adalah perangkat yang mengubah energi kimia menjadi energi listrik atau sebaliknya. Elektrolit dalam sel elektrokimia memfasilitasi pergerakan ion antara elektroda, memungkinkan reaksi kimia yang menghasilkan arus listrik atau menyimpan energi kimia.
Jenis Elektrolit dan Penggunaannya dalam Industri
| Jenis Elektrolit | Contoh | Penggunaan dalam Industri |
|---|---|---|
| Asam | Asam sulfat, asam klorida, asam nitrat | Baterai, aki, produksi pupuk, pembuatan logam |
| Basa | Natrium hidroksida, kalium hidroksida, kalsium hidroksida | Pembuatan sabun, kertas, tekstil, produksi baterai alkali |
| Garam | Natrium klorida, kalium klorida, magnesium sulfat | Elektrolisis air, produksi logam, industri makanan |
| Larutan Organik | Litium ion, natrium ion | Baterai lithium-ion, perangkat elektronik portabel |
Jenis-jenis Elektrolit
Elektrolit merupakan zat yang dapat menghantarkan arus listrik ketika dilarutkan dalam air atau dalam keadaan cair. Kemampuan menghantarkan arus listrik ini disebabkan oleh adanya ion-ion bebas yang bergerak dalam larutan. Berdasarkan kemampuannya menghantarkan arus listrik, elektrolit dibagi menjadi tiga jenis, yaitu elektrolit kuat, elektrolit lemah, dan non-elektrolit.
Elektrolit Kuat
Elektrolit kuat adalah zat yang terionisasi sempurna dalam larutan, sehingga menghasilkan ion-ion bebas dalam jumlah yang banyak. Hal ini menyebabkan larutan elektrolit kuat memiliki daya hantar listrik yang tinggi. Contohnya adalah asam kuat (seperti HCl, HNO3, H2SO4), basa kuat (seperti NaOH, KOH, Ca(OH)2), dan garam-garam yang mudah larut (seperti NaCl, KNO3, MgCl2).
Sebagai contoh, asam klorida (HCl) ketika dilarutkan dalam air akan terionisasi sempurna menjadi ion hidrogen (H+) dan ion klorida (Cl–).
HCl(aq) → H+(aq) + Cl–(aq)
Keberadaan ion-ion bebas ini dalam jumlah yang banyak menyebabkan larutan HCl dapat menghantarkan arus listrik dengan baik, sehingga dikategorikan sebagai elektrolit kuat.
Elektrolit Lemah
Elektrolit lemah adalah zat yang hanya terionisasi sebagian dalam larutan, sehingga menghasilkan ion-ion bebas dalam jumlah yang sedikit. Hal ini menyebabkan larutan elektrolit lemah memiliki daya hantar listrik yang rendah. Contohnya adalah asam lemah (seperti CH3COOH, H2CO3, H3PO4), basa lemah (seperti NH3, NH4OH), dan garam-garam yang sukar larut (seperti AgCl, BaSO4).
Sebagai contoh, asam asetat (CH3COOH) ketika dilarutkan dalam air hanya terionisasi sebagian menjadi ion hidrogen (H+) dan ion asetat (CH3COO–).
CH3COOH(aq) ⇌ H+(aq) + CH3COO–(aq)
Reaksi ionisasi asam asetat bersifat setimbang, artinya ion-ion yang terbentuk dapat kembali bereaksi membentuk asam asetat. Hal ini menyebabkan konsentrasi ion-ion bebas dalam larutan asam asetat lebih rendah dibandingkan dengan larutan asam klorida. Akibatnya, larutan asam asetat memiliki daya hantar listrik yang lebih rendah dan dikategorikan sebagai elektrolit lemah.
Non-Elektrolit
Non-elektrolit adalah zat yang tidak terionisasi dalam larutan, sehingga tidak menghasilkan ion-ion bebas. Hal ini menyebabkan larutan non-elektrolit tidak dapat menghantarkan arus listrik. Contohnya adalah gula (C12H22O11), alkohol (C2H5OH), dan urea (CO(NH2)2).
Sebagai contoh, gula (C12H22O11) ketika dilarutkan dalam air tidak terionisasi. Molekul gula tetap utuh dan tidak menghasilkan ion-ion bebas. Akibatnya, larutan gula tidak dapat menghantarkan arus listrik dan dikategorikan sebagai non-elektrolit.
Contoh soal elektrolit biasanya menguji pemahaman kita tentang kemampuan suatu zat untuk menghantarkan arus listrik. Misalnya, larutan garam merupakan elektrolit kuat karena dapat menghantarkan arus listrik dengan baik. Berbeda dengan larutan gula yang merupakan non-elektrolit karena tidak menghantarkan arus listrik.
Untuk latihan soal, kamu bisa coba cari contoh soal al kitabah di sini. Kembali ke contoh soal elektrolit, soal-soal biasanya menyajikan berbagai jenis larutan dan menanyakan sifat elektrolitnya.
Tabel Perbedaan Elektrolit
| Jenis Elektrolit | Ionisasi | Daya Hantar Listrik | Contoh |
|---|---|---|---|
| Elektrolit Kuat | Terionisasi sempurna | Tinggi | HCl, NaOH, NaCl |
| Elektrolit Lemah | Terionisasi sebagian | Rendah | CH3COOH, NH3, AgCl |
| Non-Elektrolit | Tidak terionisasi | Tidak dapat menghantarkan arus listrik | C12H22O11, C2H5OH, CO(NH2)2 |
Faktor yang Mempengaruhi Daya Hantar Elektrolit
Daya hantar listrik suatu larutan elektrolit merupakan kemampuannya untuk menghantarkan arus listrik. Semakin tinggi daya hantarnya, semakin mudah larutan tersebut menghantarkan arus listrik. Ada beberapa faktor yang dapat mempengaruhi daya hantar elektrolit, yang akan dibahas lebih lanjut dalam artikel ini.
Konsentrasi Elektrolit
Konsentrasi elektrolit adalah jumlah ion yang terkandung dalam suatu larutan. Semakin tinggi konsentrasi elektrolit, semakin banyak ion yang tersedia untuk menghantarkan arus listrik, sehingga daya hantarnya juga semakin tinggi. Hal ini karena semakin banyak ion yang ada, semakin banyak jalur konduksi yang tersedia untuk arus listrik mengalir.
- Misalnya, larutan NaCl dengan konsentrasi 1 M akan memiliki daya hantar yang lebih tinggi dibandingkan dengan larutan NaCl dengan konsentrasi 0,1 M. Ini karena larutan 1 M memiliki jumlah ion Na+ dan Cl- yang lebih banyak dibandingkan dengan larutan 0,1 M.
Suhu
Suhu juga berpengaruh terhadap daya hantar elektrolit. Semakin tinggi suhu, semakin tinggi daya hantarnya. Hal ini karena pada suhu yang lebih tinggi, ion-ion dalam larutan bergerak lebih cepat dan lebih mudah untuk bertabrakan dan menghantarkan arus listrik.
- Contohnya, larutan asam cuka (CH3COOH) akan memiliki daya hantar yang lebih tinggi pada suhu 50 derajat Celcius dibandingkan dengan suhu 25 derajat Celcius. Hal ini karena pada suhu yang lebih tinggi, ion-ion H+ dan CH3COO- dalam larutan bergerak lebih cepat dan lebih mudah untuk bertabrakan dan menghantarkan arus listrik.
Jenis Pelarut
Jenis pelarut juga dapat mempengaruhi daya hantar elektrolit. Pelarut polar, seperti air, dapat melarutkan elektrolit dan menghasilkan ion-ion yang dapat menghantarkan arus listrik. Pelarut nonpolar, seperti bensin, tidak dapat melarutkan elektrolit dan tidak menghasilkan ion-ion, sehingga daya hantarnya rendah.
- Sebagai contoh, garam dapur (NaCl) akan larut dalam air dan menghasilkan ion-ion Na+ dan Cl- yang dapat menghantarkan arus listrik. Namun, NaCl tidak akan larut dalam bensin dan tidak akan menghasilkan ion-ion, sehingga daya hantarnya rendah.
Diagram Hubungan Konsentrasi Elektrolit dan Daya Hantar
Hubungan antara konsentrasi elektrolit dan daya hantar dapat digambarkan dalam diagram berikut:
| Konsentrasi Elektrolit | Daya Hantar |
|---|---|
| Rendah | Rendah |
| Sedang | Sedang |
| Tinggi | Tinggi |
Diagram ini menunjukkan bahwa semakin tinggi konsentrasi elektrolit, semakin tinggi daya hantarnya. Hal ini karena semakin banyak ion yang tersedia untuk menghantarkan arus listrik.
Contoh Soal Elektrolit
Elektrolit merupakan zat yang dapat menghantarkan arus listrik dalam bentuk larutan atau lelehannya. Kemampuan elektrolit dalam menghantarkan arus listrik disebabkan oleh adanya ion-ion bebas yang dapat bergerak dan membawa muatan listrik. Artikel ini akan membahas contoh soal tentang konsep elektrolit yang melibatkan pengertian, sifat, dan pembentukannya, serta langkah-langkah penyelesaiannya.
Pengertian Elektrolit
Elektrolit adalah zat yang dapat menghantarkan arus listrik ketika dilarutkan dalam air atau dilelehkan. Hal ini terjadi karena elektrolit mengandung ion-ion bebas yang dapat bergerak dan membawa muatan listrik. Contohnya, garam dapur (NaCl) ketika dilarutkan dalam air akan terurai menjadi ion natrium (Na+) dan ion klorida (Cl-) yang bebas bergerak dan dapat menghantarkan arus listrik.
Sifat Elektrolit
Elektrolit memiliki beberapa sifat khas, antara lain:
- Dapat menghantarkan arus listrik dalam bentuk larutan atau lelehan.
- Terurai menjadi ion-ion ketika dilarutkan dalam air atau dilelehkan.
- Memiliki titik didih dan titik beku yang lebih tinggi dibandingkan dengan zat non-elektrolit.
- Memiliki tekanan uap yang lebih rendah dibandingkan dengan zat non-elektrolit.
Pembentukan Elektrolit
Elektrolit dapat terbentuk melalui beberapa cara, antara lain:
- Reaksi ionisasi: Zat yang mengandung ion-ion akan terurai menjadi ion-ion bebas ketika dilarutkan dalam air atau dilelehkan. Contohnya, asam kuat seperti HCl akan terurai menjadi ion hidrogen (H+) dan ion klorida (Cl-) ketika dilarutkan dalam air.
- Reaksi disosiasi: Zat yang tidak mengandung ion-ion akan terurai menjadi ion-ion ketika dilarutkan dalam air. Contohnya, garam dapur (NaCl) akan terurai menjadi ion natrium (Na+) dan ion klorida (Cl-) ketika dilarutkan dalam air.
Contoh Soal dan Penyelesaian
Berikut adalah contoh soal tentang konsep elektrolit:
Manakah dari zat berikut yang merupakan elektrolit?
a. Gula
b. Air murni
c. Asam cuka
d. Alkohol
Langkah-langkah penyelesaian soal:
| Langkah | Penjelasan | Jawaban |
|---|---|---|
| 1. Memahami pengertian elektrolit | Elektrolit adalah zat yang dapat menghantarkan arus listrik ketika dilarutkan dalam air atau dilelehkan. | – |
| 2. Menentukan zat yang dapat terurai menjadi ion-ion | Zat yang dapat terurai menjadi ion-ion ketika dilarutkan dalam air atau dilelehkan merupakan elektrolit. | – |
| 3. Menganalisis pilihan jawaban | a. Gula tidak terurai menjadi ion-ion ketika dilarutkan dalam air. b. Air murni tidak terurai menjadi ion-ion. c. Asam cuka terurai menjadi ion-ion ketika dilarutkan dalam air. d. Alkohol tidak terurai menjadi ion-ion ketika dilarutkan dalam air. |
– |
| 4. Menyimpulkan jawaban | Berdasarkan analisis, asam cuka (c) merupakan elektrolit karena dapat terurai menjadi ion-ion ketika dilarutkan dalam air. | c. Asam cuka |
Contoh Soal HOTS Elektrolit
Soal HOTS (Higher Order Thinking Skills) dalam konteks elektrolit dirancang untuk menguji kemampuan Anda dalam menganalisis, menginterpretasi, dan menerapkan konsep elektrolit dalam berbagai situasi. Soal-soal ini biasanya lebih kompleks daripada soal-soal dasar dan membutuhkan pemahaman yang lebih mendalam tentang topik tersebut.
Contoh Soal HOTS Elektrolit
Berikut adalah contoh soal HOTS elektrolit yang melibatkan analisis, interpretasi, dan aplikasi:
Sebuah larutan elektrolit digunakan dalam baterai mobil. Larutan tersebut terdiri dari asam sulfat (H2SO4) yang terlarut dalam air. Ketika baterai digunakan, asam sulfat bereaksi dengan pelat timbal (Pb) dan timbal dioksida (PbO2) untuk menghasilkan energi listrik. Reaksi ini menghasilkan air dan timbal sulfat (PbSO4).
Jelaskan bagaimana perubahan konsentrasi asam sulfat dalam larutan baterai mempengaruhi daya yang dihasilkan oleh baterai. Jelaskan juga mengapa baterai mobil perlu diisi ulang secara berkala.
Langkah-Langkah Penyelesaian Soal
| Langkah | Penjelasan |
|---|---|
| 1. Analisis Reaksi Kimia | Reaksi kimia yang terjadi dalam baterai mobil melibatkan asam sulfat, pelat timbal, dan timbal dioksida. Reaksi ini menghasilkan energi listrik, air, dan timbal sulfat. |
| 2. Hubungan Konsentrasi Asam Sulfat dengan Daya Baterai | Konsentrasi asam sulfat dalam larutan baterai menentukan jumlah ion yang tersedia untuk menghantarkan arus listrik. Semakin tinggi konsentrasi asam sulfat, semakin banyak ion yang tersedia, dan semakin besar daya yang dihasilkan oleh baterai. |
| 3. Penurunan Konsentrasi Asam Sulfat | Saat baterai digunakan, asam sulfat bereaksi dengan pelat timbal dan timbal dioksida, menghasilkan timbal sulfat. Proses ini mengurangi konsentrasi asam sulfat dalam larutan baterai. |
| 4. Pengaruh Penurunan Konsentrasi terhadap Daya Baterai | Penurunan konsentrasi asam sulfat menyebabkan penurunan jumlah ion yang tersedia untuk menghantarkan arus listrik. Akibatnya, daya yang dihasilkan oleh baterai menurun. |
| 5. Pentingnya Pengisian Ulang Baterai | Pengisian ulang baterai mobil mengembalikan konsentrasi asam sulfat ke tingkat awal dengan mengubah kembali timbal sulfat menjadi asam sulfat, pelat timbal, dan timbal dioksida. Proses ini memungkinkan baterai untuk menghasilkan daya kembali. |
Pentingnya Elektrolit

Elektrolit adalah mineral yang membawa muatan listrik ketika dilarutkan dalam air. Mereka sangat penting bagi tubuh manusia karena mereka memainkan peran penting dalam berbagai fungsi tubuh, mulai dari menjaga keseimbangan cairan hingga membantu saraf dan otot bekerja dengan baik.
Peran Elektrolit dalam Tubuh
Elektrolit penting untuk menjaga keseimbangan cairan tubuh. Air merupakan komponen utama tubuh manusia, dan elektrolit membantu mengatur pergerakan air masuk dan keluar dari sel-sel tubuh. Keseimbangan cairan yang tepat sangat penting untuk menjaga fungsi organ tubuh yang optimal.
- Natrium (Na+): Natrium membantu mengatur volume darah dan tekanan darah. Ia juga berperan dalam transmisi saraf dan kontraksi otot.
- Kalium (K+): Kalium membantu mengatur detak jantung dan kontraksi otot. Ia juga berperan dalam fungsi saraf dan keseimbangan cairan.
- Kalsium (Ca2+): Kalsium penting untuk kesehatan tulang dan gigi, kontraksi otot, pembekuan darah, dan transmisi saraf.
- Magnesium (Mg2+): Magnesium membantu lebih dari 300 reaksi enzimatik dalam tubuh. Ia juga berperan dalam kontraksi otot, fungsi saraf, dan menjaga tekanan darah.
- Fosfor (P): Fosfor penting untuk kesehatan tulang dan gigi, produksi energi, dan fungsi sel.
Elektrolit dan Keseimbangan Cairan
Elektrolit membantu mengatur pergerakan air masuk dan keluar dari sel-sel tubuh melalui proses yang disebut osmosis. Ketika konsentrasi elektrolit di dalam sel berbeda dengan di luar sel, air akan bergerak untuk menyeimbangkan konsentrasi tersebut. Proses ini sangat penting untuk menjaga volume darah, tekanan darah, dan fungsi organ tubuh yang optimal.
Elektrolit dan Fungsi Organ
Elektrolit memainkan peran penting dalam fungsi organ tubuh. Misalnya, natrium dan kalium sangat penting untuk fungsi jantung, sementara kalsium penting untuk kontraksi otot dan pembekuan darah. Magnesium membantu dalam fungsi saraf dan otot, sementara fosfor penting untuk produksi energi dan fungsi sel.
Diagram Peran Elektrolit dalam Tubuh Manusia
Berikut adalah diagram sederhana yang menunjukkan peran elektrolit dalam tubuh manusia:
| Elektrolit | Fungsi Utama | Organ yang Dipengaruhi |
|---|---|---|
| Natrium (Na+) | Mengatur volume darah dan tekanan darah, transmisi saraf, kontraksi otot | Jantung, saraf, otot |
| Kalium (K+) | Mengatur detak jantung, kontraksi otot, fungsi saraf, keseimbangan cairan | Jantung, saraf, otot |
| Kalsium (Ca2+) | Kesehatan tulang dan gigi, kontraksi otot, pembekuan darah, transmisi saraf | Tulang, otot, darah, saraf |
| Magnesium (Mg2+) | Fungsi enzimatik, kontraksi otot, fungsi saraf, tekanan darah | Otot, saraf, jantung |
| Fosfor (P) | Kesehatan tulang dan gigi, produksi energi, fungsi sel | Tulang, sel |
Aplikasi Elektrolit dalam Industri: Contoh Soal Elektrolit
Elektrolit, zat yang dapat menghantarkan arus listrik ketika dilarutkan dalam air, memainkan peran penting dalam berbagai industri. Kemampuan elektrolit untuk menghasilkan ion-ion bermuatan membuat mereka sangat berguna dalam proses produksi dan manufaktur. Mari kita telusuri beberapa aplikasi penting elektrolit dalam berbagai sektor industri.
Industri Kimia
Elektrolit merupakan bahan baku penting dalam industri kimia. Mereka digunakan dalam proses elektrokimia seperti elektrolisis, elektroplating, dan produksi baterai. Contohnya, elektrolisis air dengan menggunakan elektrolit seperti asam sulfat menghasilkan hidrogen dan oksigen. Proses ini merupakan langkah penting dalam produksi berbagai bahan kimia, termasuk pupuk, plastik, dan bahan bakar.
Industri Farmasi
Elektrolit berperan penting dalam industri farmasi. Mereka digunakan dalam pembuatan obat-obatan, suplemen, dan produk perawatan kesehatan lainnya. Elektrolit seperti natrium klorida (NaCl) digunakan dalam larutan infus untuk mengganti cairan tubuh yang hilang. Magnesium sulfat digunakan sebagai pencahar, sedangkan kalium klorida digunakan untuk mengobati kekurangan kalium.
Industri Makanan
Elektrolit juga memiliki aplikasi yang luas dalam industri makanan. Mereka digunakan sebagai bahan pengawet, pengatur keasaman, dan penambah rasa. Natrium klorida (NaCl) digunakan sebagai garam dapur untuk menambah rasa dan mengawetkan makanan. Asam sitrat, yang merupakan elektrolit alami, digunakan sebagai pengatur keasaman dan penambah rasa dalam minuman dan makanan.
Tabel Aplikasi Elektrolit
| Jenis Elektrolit | Aplikasi dalam Industri |
|---|---|
| Asam Sulfat (H2SO4) | Produksi baterai, pupuk, dan bahan kimia lainnya. |
| Natrium Klorida (NaCl) | Industri makanan, pembuatan obat-obatan, dan elektroplating. |
| Kalium Hidroksida (KOH) | Produksi baterai, sabun, dan deterjen. |
| Asam Sitrat (C6H8O7) | Industri makanan, minuman, dan farmasi. |
| Magnesium Sulfat (MgSO4) | Industri farmasi, pertanian, dan manufaktur. |
Kesimpulan
Memahami konsep elektrolit merupakan kunci untuk memahami berbagai fenomena kimia dan fisika. Dari baterai yang menghidupkan perangkat elektronik hingga proses biologis dalam tubuh kita, elektrolit memainkan peran penting. Melalui contoh soal yang telah kita bahas, diharapkan kamu dapat mengasah kemampuan berpikir kritis dan menerapkan konsep elektrolit dalam berbagai situasi.