Contoh soal halogen – Halogen, kelompok unsur yang sangat reaktif, memegang peranan penting dalam berbagai bidang, mulai dari kehidupan sehari-hari hingga industri. Kamu mungkin sudah mengenal beberapa contohnya, seperti klorin dalam pemutih atau yodium dalam obat gosok. Namun, seberapa dalam pemahamanmu tentang sifat dan kegunaan halogen? Mari kita uji kemampuanmu melalui serangkaian contoh soal menarik yang akan mengantarkanmu pada pemahaman yang lebih mendalam tentang dunia halogen.
Dalam contoh soal ini, kamu akan diajak untuk menjelajahi berbagai aspek halogen, mulai dari sifat kimia dan fisiknya, hingga aplikasi dan dampaknya terhadap lingkungan. Soal-soal ini dirancang untuk mengasah kemampuan berpikir kritis dan analitis, sehingga kamu dapat memahami konsep halogen secara lebih komprehensif.
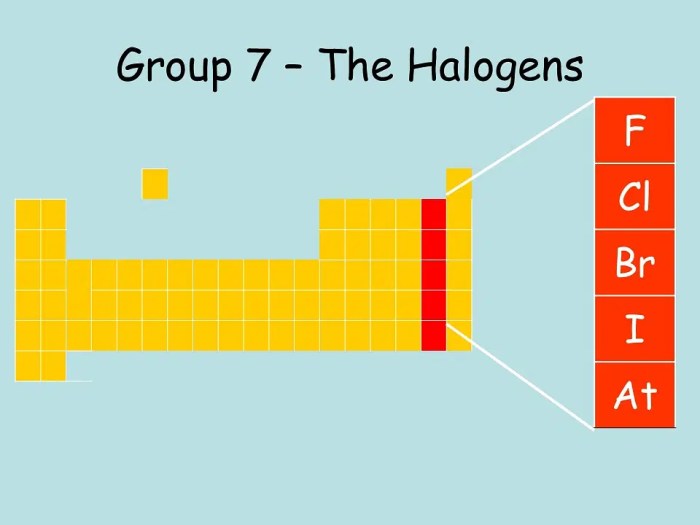
Pengertian Halogen
Halogen adalah kelompok unsur kimia yang terletak di golongan VIIA atau 17 dalam tabel periodik. Unsur-unsur ini memiliki sifat kimia yang serupa dan seringkali ditemukan dalam bentuk senyawa di alam. Halogen berasal dari bahasa Yunani “hals” yang berarti “garam” dan “gen” yang berarti “pembentuk”, sehingga halogen dapat diartikan sebagai “pembentuk garam”.
Contoh Halogen
Contoh halogen yang umum dijumpai antara lain:
- Fluor (F)
- Klorin (Cl)
- Brom (Br)
- Iodin (I)
- Astatin (At)
Sifat Umum Halogen
Halogen memiliki sifat-sifat umum yang membedakannya dari unsur-unsur lainnya. Berikut adalah beberapa sifat umum halogen:
- Berwujud gas atau cair pada suhu kamar: Fluor dan klorin berwujud gas, brom berwujud cair, dan iodin berwujud padat namun mudah menyublim menjadi gas.
- Sangat reaktif: Halogen merupakan unsur yang sangat reaktif dan mudah bereaksi dengan unsur-unsur lain, terutama logam, membentuk senyawa ionik. Halogen juga dapat bereaksi dengan non-logam membentuk senyawa kovalen.
- Memiliki elektronegativitas tinggi: Halogen memiliki elektronegativitas tinggi, artinya mereka cenderung menarik elektron dari atom lain dalam ikatan kimia.
- Memiliki sifat oksidator kuat: Halogen dapat bertindak sebagai oksidator kuat, yaitu menerima elektron dari atom lain.
- Memiliki warna yang khas: Halogen memiliki warna yang khas, seperti fluor (kuning pucat), klorin (hijau kekuningan), brom (merah kecoklatan), dan iodin (ungu tua).
Perbandingan Sifat Fisik dan Kimia Halogen
Tabel berikut membandingkan sifat fisik dan kimia halogen:
| Sifat | Fluor (F) | Klorin (Cl) | Brom (Br) | Iodin (I) |
|---|---|---|---|---|
| Wujud | Gas | Gas | Cair | Padat |
| Warna | Kuning pucat | Hijau kekuningan | Merah kecoklatan | Ungu tua |
| Titik lebur (°C) | -220 | -101 | -7 | 114 |
| Titik didih (°C) | -188 | -34 | 59 | 184 |
| Elektronegativitas | 4.0 | 3.0 | 2.8 | 2.5 |
| Keelektronegatifan | Sangat tinggi | Tinggi | Sedang | Rendah |
Sifat Kimia Halogen
Halogen merupakan kelompok unsur non-logam yang sangat reaktif dalam tabel periodik. Sifat kimia halogen sangat dipengaruhi oleh elektronegativitasnya yang tinggi. Halogen memiliki kecenderungan kuat untuk menarik elektron dari atom lain, membentuk ikatan ionik atau kovalen. Sifat reaktif ini membuat halogen berperan penting dalam berbagai reaksi kimia, baik dalam kehidupan sehari-hari maupun dalam industri.
Reaksi Halogen dengan Logam
Halogen bereaksi dengan logam membentuk garam halida. Reaksi ini merupakan reaksi redoks, di mana halogen bertindak sebagai oksidator dan logam bertindak sebagai reduktor. Dalam reaksi ini, halogen menerima elektron dari logam, membentuk ion negatif (anion) halida. Contohnya, natrium (Na) bereaksi dengan klorin (Cl) membentuk natrium klorida (NaCl):
2Na(s) + Cl2(g) → 2NaCl(s)
Reaksi halogen dengan logam semakin mudah terjadi jika logam semakin reaktif. Contohnya, logam alkali seperti natrium dan kalium bereaksi dengan halogen secara cepat dan hebat. Sementara logam transisi seperti tembaga dan perak bereaksi lebih lambat dan memerlukan kondisi tertentu untuk bereaksi.
Reaksi Halogen dengan Non-logam
Halogen juga dapat bereaksi dengan non-logam membentuk senyawa kovalen. Reaksi ini umumnya melibatkan pembagian elektron antara atom halogen dan atom non-logam. Contohnya, klorin bereaksi dengan hidrogen membentuk asam klorida (HCl):
H2(g) + Cl2(g) → 2HCl(g)
Reaksi halogen dengan non-logam menghasilkan berbagai macam senyawa, seperti halida hidrogen (HCl, HBr, HI), halida oksigen (Cl2O, Br2O), dan halida nitrogen (NCl3, NBr3). Reaksi ini biasanya membutuhkan kondisi tertentu, seperti pemanasan atau pencahayaan.
Reaksi Halogen dengan Senyawa Organik
Halogen bereaksi dengan senyawa organik membentuk senyawa haloalkana. Reaksi ini biasanya melibatkan substitusi atom hidrogen dalam senyawa organik dengan atom halogen. Contohnya, metana (CH4) bereaksi dengan klorin membentuk klorometana (CH3Cl):
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
Reaksi halogen dengan senyawa organik dapat menghasilkan berbagai macam senyawa haloalkana, yang memiliki sifat dan kegunaan yang berbeda-beda. Senyawa haloalkana sering digunakan sebagai pelarut, pestisida, dan bahan baku dalam industri kimia.
| Senyawa Organik | Reaksi dengan Halogen | Produk |
|---|---|---|
| Metana (CH4) | Klorinasi | Klorometana (CH3Cl), Diklorometana (CH2Cl2), Kloroform (CHCl3), Tetraklorometana (CCl4) |
| Etena (C2H4) | Brominasi | 1,2-Dibromoetana (C2H4Br2) |
| Benzena (C6H6) | Klorinasi | Klorobenzena (C6H5Cl) |
Dampak Halogen terhadap Lingkungan
Halogen merupakan kelompok unsur kimia yang memiliki sifat reaktif tinggi dan dapat ditemukan dalam berbagai bentuk, mulai dari gas hingga padat. Keberadaan halogen dalam lingkungan dapat menimbulkan dampak negatif yang signifikan, baik bagi manusia maupun ekosistem.
Dampak Negatif Halogen terhadap Lingkungan
Dampak negatif halogen terhadap lingkungan dapat dibedakan menjadi beberapa aspek, antara lain:
- Pencemaran Udara: Halogen seperti klorin dan bromin dapat terbebas ke udara dalam bentuk gas atau partikel, yang dapat menyebabkan gangguan pernapasan dan penyakit pernapasan. Selain itu, gas halogen juga dapat bereaksi dengan senyawa organik di udara dan membentuk polutan udara berbahaya seperti ozon.
- Pencemaran Air: Halogen seperti klorin dan bromin dapat mencemari air tanah dan permukaan, yang dapat membahayakan kesehatan manusia dan hewan. Halogen juga dapat mengganggu keseimbangan ekosistem air, seperti membunuh ikan dan tumbuhan air.
- Pencemaran Tanah: Halogen dapat mencemari tanah melalui berbagai cara, seperti penggunaan pestisida dan pupuk kimia. Pencemaran tanah dapat mengganggu pertumbuhan tanaman dan menyebabkan kerusakan tanah.
- Penipisan Lapisan Ozon: Beberapa halogen, seperti klorin dan bromin, dapat menyebabkan penipisan lapisan ozon. Penipisan lapisan ozon dapat meningkatkan radiasi ultraviolet yang mencapai permukaan bumi, yang dapat menyebabkan kanker kulit, katarak, dan kerusakan tanaman.
- Efek Rumah Kaca: Beberapa halogen, seperti fluorin dan bromin, dapat berkontribusi pada efek rumah kaca. Gas halogen dapat memerangkap panas di atmosfer, yang dapat menyebabkan pemanasan global.
Cara Meminimalkan Dampak Negatif Halogen
Untuk meminimalkan dampak negatif halogen terhadap lingkungan, dapat dilakukan beberapa upaya, antara lain:
- Mengurangi Penggunaan Halogen: Penggunaan halogen dapat dikurangi dengan mengganti produk yang mengandung halogen dengan produk alternatif yang lebih ramah lingkungan.
- Pengolahan Limbah: Limbah yang mengandung halogen perlu diolah dengan baik untuk mencegah pencemaran lingkungan.
- Penggunaan Teknologi Ramah Lingkungan: Penggunaan teknologi yang ramah lingkungan dapat membantu mengurangi emisi halogen ke lingkungan.
- Peningkatan Kesadaran: Peningkatan kesadaran masyarakat tentang dampak negatif halogen dapat mendorong perubahan perilaku dan penggunaan produk yang lebih ramah lingkungan.
Dampak Negatif Halogen terhadap Kesehatan Manusia
| Halogen | Dampak Negatif terhadap Kesehatan Manusia |
|---|---|
| Klorin | Iritasi mata, kulit, dan saluran pernapasan. Dapat menyebabkan kerusakan paru-paru jika terhirup dalam jumlah besar. |
| Bromin | Iritasi mata, kulit, dan saluran pernapasan. Dapat menyebabkan kerusakan paru-paru jika terhirup dalam jumlah besar. |
| Fluor | Kerusakan gigi, tulang, dan sistem saraf. Dapat menyebabkan gangguan pertumbuhan dan perkembangan. |
| Iodin | Gangguan tiroid, penyakit kulit, dan gangguan reproduksi. |
Contoh Soal Halogen
Halogen merupakan golongan unsur-unsur non-logam yang terdapat pada golongan VIIA atau 17 dalam tabel periodik. Golongan ini terdiri dari fluor (F), klorin (Cl), brom (Br), iodin (I), dan astatin (At). Halogen memiliki sifat-sifat yang khas, seperti reaktivitas tinggi, kemampuan membentuk ion negatif, dan membentuk senyawa dengan unsur-unsur lain. Dalam artikel ini, kita akan membahas beberapa contoh soal tentang halogen yang dapat membantu kamu memahami lebih dalam tentang unsur-unsur ini.
Soal Pilihan Ganda
Soal pilihan ganda merupakan jenis soal yang umum digunakan untuk menguji pemahaman dasar tentang suatu topik. Berikut adalah 5 contoh soal pilihan ganda tentang halogen:
- Halogen yang paling reaktif adalah…
- Fluor (F)
- Klorin (Cl)
- Brom (Br)
- Iodin (I)
- Senyawa halogen yang digunakan sebagai pemutih adalah…
- Natrium klorida (NaCl)
- Kalsium klorida (CaCl2)
- Natrium hipoklorit (NaClO)
- Kalium iodida (KI)
- Halogen yang digunakan dalam pembuatan garam dapur adalah…
- Fluor (F)
- Klorin (Cl)
- Brom (Br)
- Iodin (I)
- Senyawa halogen yang digunakan dalam pembuatan lampu pijar adalah…
- Natrium bromida (NaBr)
- Kalium iodida (KI)
- Silikon (Si)
- Tungsten (W)
- Halogen yang digunakan dalam pembuatan obat-obatan adalah…
- Fluor (F)
- Klorin (Cl)
- Brom (Br)
- Iodin (I)
Soal Essay
Soal essay digunakan untuk menguji pemahaman konseptual dan kemampuan berpikir kritis. Berikut adalah 3 contoh soal essay tentang halogen dengan tingkat kesulitan sedang:
- Jelaskan mengapa halogen memiliki reaktivitas tinggi dan bagaimana reaktivitas tersebut berubah seiring dengan naiknya nomor atom halogen.
- Tuliskan 3 contoh senyawa halogen dan jelaskan kegunaan masing-masing senyawa tersebut dalam kehidupan sehari-hari.
- Jelaskan bagaimana halogen dapat digunakan dalam industri kimia dan berikan contoh reaksi kimia yang melibatkan halogen.
Soal Uraian
Soal uraian merupakan jenis soal yang menuntut kamu untuk menjelaskan suatu konsep atau proses secara detail. Berikut adalah contoh soal uraian tentang halogen yang melibatkan reaksi kimia:
Reaksi antara logam natrium (Na) dengan gas klorin (Cl2) menghasilkan natrium klorida (NaCl). Tuliskan persamaan reaksi setara untuk reaksi ini dan jelaskan bagaimana reaksi ini menunjukkan sifat khas halogen.
Contoh soal halogen seringkali muncul dalam ujian kimia, yang menuntut pemahaman mendalam tentang sifat dan reaksi unsur-unsur golongan VIIA. Nah, mengingat struktur soal kimia sering menyerupai pola bahasa Arab, terutama dalam bentuk kalimat tanya, kamu bisa mencari referensi contoh soal fiil madhi untuk membantu memahami pola kalimat tanya yang sering muncul dalam soal kimia.
Dengan latihan yang cukup, kamu akan lebih mudah menjawab soal halogen yang menguji kemampuan menganalisis reaksi kimia dan menentukan produk yang terbentuk.
Senyawa Halogen
Senyawa halogen adalah senyawa yang mengandung unsur halogen (golongan VIIA atau 17 pada tabel periodik). Senyawa halogen sangat beragam dan memiliki sifat serta kegunaan yang luas.
Jenis-Jenis Senyawa Halogen
Senyawa halogen dapat diklasifikasikan berdasarkan jenis ikatan kimia yang terbentuk. Ada dua jenis utama senyawa halogen, yaitu senyawa halogen anorganik dan senyawa halogen organik.
- Senyawa Halogen Anorganik: Senyawa ini terbentuk antara halogen dengan unsur lain, seperti logam atau non-logam. Contohnya:
- Natrium klorida (NaCl) – garam dapur
- Kalsium klorida (CaCl2) – zat pengering
- Asam klorida (HCl) – asam kuat
- Kalium bromida (KBr) – obat penenang
- Fluorida (F–) – dalam pasta gigi untuk mencegah gigi berlubang
- Senyawa Halogen Organik: Senyawa ini mengandung halogen yang terikat pada atom karbon dalam molekul organik. Contohnya:
- Kloroform (CHCl3) – pelarut organik
- Tetrakloroetana (C2H2Cl4) – pelarut dan zat pembersih
- Polietilena klorida (PVC) – plastik yang banyak digunakan
- Difluorometana (CH2F2) – refrigeran
Sifat Senyawa Halogen, Contoh soal halogen
Sifat senyawa halogen sangat beragam, tergantung pada jenis halogen dan unsur lain yang terikat padanya. Namun, beberapa sifat umum senyawa halogen meliputi:
- Reaktfitas: Senyawa halogen umumnya reaktif, terutama halogen yang lebih ringan seperti fluor dan klorin.
- Polaritas: Senyawa halogen biasanya bersifat polar karena perbedaan elektronegativitas antara halogen dan unsur lain yang terikat padanya.
- Titik didih dan titik leleh: Titik didih dan titik leleh senyawa halogen bervariasi tergantung pada jenis halogen dan struktur molekulnya.
- Kelarutan: Kelarutan senyawa halogen dalam air juga bervariasi tergantung pada jenis halogen dan struktur molekulnya.
Kegunaan Senyawa Halogen
Senyawa halogen memiliki banyak kegunaan dalam berbagai bidang, seperti:
- Industri kimia: Senyawa halogen digunakan sebagai bahan baku dalam pembuatan berbagai produk kimia, seperti plastik, pestisida, dan obat-obatan.
- Medis: Senyawa halogen digunakan sebagai obat-obatan, disinfektan, dan bahan pembasmi kuman.
- Pertanian: Senyawa halogen digunakan sebagai pestisida dan pupuk.
- Kehidupan sehari-hari: Senyawa halogen terdapat dalam berbagai produk sehari-hari, seperti garam dapur, pasta gigi, dan air minum.
Tabel Senyawa Halogen
| Rumus Kimia | Nama Senyawa |
|---|---|
| NaCl | Natrium klorida |
| CaCl2 | Kalsium klorida |
| HCl | Asam klorida |
| KBr | Kalium bromida |
| CHCl3 | Kloroform |
| C2H2Cl4 | Tetrakloroetana |
| CH2F2 | Difluorometana |
Reaksi Halogen
Halogen merupakan unsur golongan VIIA dalam tabel periodik. Halogen memiliki sifat reaktif dan mudah bereaksi dengan berbagai senyawa, termasuk alkana, alkena, dan senyawa aromatik. Reaksi halogen dengan senyawa organik seringkali menghasilkan produk halogenasi, yaitu senyawa organik yang mengandung atom halogen.
Reaksi Halogen dengan Alkana
Reaksi halogen dengan alkana merupakan reaksi substitusi, yaitu reaksi dimana atom hidrogen pada alkana digantikan oleh atom halogen. Reaksi ini membutuhkan cahaya ultraviolet (UV) untuk menginisiasi reaksi. Mekanisme reaksi halogenasi alkana dapat dijelaskan sebagai berikut:
- Inisiasi: Molekul halogen dipecah menjadi radikal bebas oleh cahaya UV.
Cl2 + hv → 2Cl•
- Propagasi: Radikal bebas halogen bereaksi dengan alkana untuk menghasilkan radikal bebas alkil. Radikal bebas alkil kemudian bereaksi dengan molekul halogen untuk menghasilkan produk halogenasi dan radikal bebas halogen baru.
Cl• + RH → R• + HCl
R• + Cl2 → RCl + Cl• - Terminasi: Dua radikal bebas bereaksi untuk membentuk produk stabil.
Cl• + Cl• → Cl2
R• + R• → R-R
Cl• + R• → RCl
Sebagai contoh, reaksi klorinasi metana menghasilkan klorometana, diklorometana, triklorometana (kloroform), dan tetraklorometana (karbon tetraklorida).
Reaksi Halogen dengan Alkena
Reaksi halogen dengan alkena merupakan reaksi adisi, yaitu reaksi dimana atom halogen ditambahkan ke ikatan rangkap alkena. Reaksi ini berlangsung dengan mudah pada suhu ruang dan tidak memerlukan cahaya UV. Reaksi adisi halogen pada alkena menghasilkan dihaloalkana.
- Mekanisme Reaksi: Reaksi adisi halogen pada alkena berlangsung melalui pembentukan ion halonium intermediet. Ion halonium adalah ion siklik yang mengandung atom halogen dan dua atom karbon yang berikatan rangkap. Ion halonium kemudian diserang oleh ion halida untuk menghasilkan dihaloalkana.
Sebagai contoh, reaksi brominasi etilena menghasilkan 1,2-dibromoetana.
Reaksi Halogen dengan Senyawa Aromatik
Reaksi halogen dengan senyawa aromatik merupakan reaksi substitusi elektrofilik, yaitu reaksi dimana atom hidrogen pada cincin aromatik digantikan oleh atom halogen. Reaksi ini memerlukan katalis asam Lewis, seperti FeCl3 atau AlCl3. Reaksi halogenasi senyawa aromatik menghasilkan haloarena.
- Mekanisme Reaksi: Reaksi halogenasi senyawa aromatik berlangsung melalui pembentukan ion halonium intermediet. Ion halonium kemudian diserang oleh cincin aromatik untuk menghasilkan haloarena. Ion halonium dibentuk oleh reaksi antara halogen dan katalis asam Lewis.
Sebagai contoh, reaksi klorinasi benzena menghasilkan klorobenzena.
Halogenasi
Halogenasi adalah proses kimia yang melibatkan penambahan atom halogen (seperti fluor, klorin, brom, dan iodin) ke dalam molekul lain. Proses ini merupakan reaksi kimia yang penting dalam berbagai bidang, mulai dari sintesis kimia hingga produksi bahan kimia industri.
Proses Halogenasi
Proses halogenasi biasanya melibatkan reaksi antara molekul organik dengan halogen atau senyawa halogen. Reaksi ini dapat terjadi dengan berbagai cara, tergantung pada jenis halogen, molekul organik, dan kondisi reaksi. Beberapa contoh umum proses halogenasi meliputi:
- Halogenasi Alkana: Reaksi ini melibatkan penambahan atom halogen ke dalam alkana, yang merupakan hidrokarbon jenuh. Reaksi ini biasanya terjadi dengan bantuan cahaya ultraviolet (UV) atau panas, dan menghasilkan alkil halida. Contoh: Metana (CH4) bereaksi dengan klorin (Cl2) membentuk klorometana (CH3Cl).
- Halogenasi Alkena: Reaksi ini melibatkan penambahan atom halogen ke dalam ikatan rangkap C=C pada alkena. Reaksi ini biasanya terjadi pada suhu kamar dan menghasilkan alkil dihalida. Contoh: Etena (C2H4) bereaksi dengan bromin (Br2) membentuk 1,2-dibromoetana (CH2BrCH2Br).
- Halogenasi Alkana Aromatik: Reaksi ini melibatkan penambahan atom halogen ke dalam cincin aromatik. Reaksi ini biasanya membutuhkan katalis seperti besi (Fe) atau aluminium klorida (AlCl3) dan menghasilkan haloarena. Contoh: Benzena (C6H6) bereaksi dengan klorin (Cl2) membentuk klorobenzena (C6H5Cl).
Contoh Reaksi Halogenasi pada Senyawa Organik
Berikut beberapa contoh reaksi halogenasi pada senyawa organik:
- Halogenasi metana: Metana (CH4) bereaksi dengan klorin (Cl2) dalam cahaya UV membentuk klorometana (CH3Cl), diklorometana (CH2Cl2), kloroform (CHCl3), dan karbon tetraklorida (CCl4). Reaksi ini terjadi melalui serangkaian reaksi radikal bebas.
CH4 + Cl2 → CH3Cl + HCl
- Halogenasi etena: Etena (C2H4) bereaksi dengan bromin (Br2) membentuk 1,2-dibromoetana (CH2BrCH2Br). Reaksi ini terjadi melalui mekanisme adisi elektrofilik.
C2H4 + Br2 → CH2BrCH2Br
- Halogenasi benzena: Benzena (C6H6) bereaksi dengan klorin (Cl2) dalam keberadaan katalis FeCl3 membentuk klorobenzena (C6H5Cl). Reaksi ini terjadi melalui mekanisme substitusi elektrofilik aromatik.
C6H6 + Cl2 → C6H5Cl + HCl
Aplikasi Halogenasi dalam Industri
Halogenasi memiliki berbagai aplikasi penting dalam industri, termasuk:
- Sintesis Kimia: Halogenasi merupakan langkah penting dalam sintesis berbagai senyawa organik, seperti pestisida, obat-obatan, dan plastik.
- Produksi Bahan Kimia Industri: Halogenasi digunakan dalam produksi berbagai bahan kimia industri, seperti kloroform, karbon tetraklorida, dan PVC.
- Pembersihan dan Disinfektan: Senyawa halogen seperti klorin dan bromin digunakan sebagai disinfektan dalam air minum dan kolam renang.
- Bahan Pemadam Kebakaran: Beberapa senyawa halogen, seperti halon, digunakan sebagai bahan pemadam kebakaran karena kemampuannya untuk menyerap panas dan menghentikan reaksi rantai pembakaran.
Pembuatan Halogen: Contoh Soal Halogen
Halogen merupakan kelompok unsur-unsur yang sangat reaktif dan memiliki banyak kegunaan dalam kehidupan sehari-hari. Mulai dari bahan baku pembuatan garam dapur hingga bahan baku pembuatan obat-obatan. Nah, bagaimana cara membuat halogen? Berikut ini akan dijelaskan metode pembuatan halogen di laboratorium dan proses produksi halogen dalam skala industri.
Metode Pembuatan Halogen di Laboratorium
Pembuatan halogen di laboratorium umumnya dilakukan dengan reaksi redoks antara senyawa halogenida dengan oksidator kuat. Berikut adalah beberapa contoh metode pembuatan halogen di laboratorium:
- Pembuatan klorin (Cl2) dapat dilakukan dengan mereaksikan asam klorida (HCl) dengan kalium permanganat (KMnO4) atau dengan mangan dioksida (MnO2) dalam suasana asam. Reaksi ini menghasilkan klorin gas yang dapat dikumpulkan dengan cara penggantian udara dalam wadah tertutup.
- Pembuatan bromin (Br2) dapat dilakukan dengan mereaksikan kalium bromida (KBr) dengan asam sulfat pekat (H2SO4) dan mangan dioksida (MnO2). Bromin yang dihasilkan berupa cairan berwarna merah kecoklatan yang mudah menguap.
- Pembuatan iodin (I2) dapat dilakukan dengan mereaksikan kalium iodida (KI) dengan asam sulfat pekat (H2SO4) dan mangan dioksida (MnO2). Iodin yang dihasilkan berupa padatan berwarna ungu tua yang mudah menyublim.
Proses Produksi Halogen dalam Skala Industri
Proses produksi halogen dalam skala industri dilakukan dengan cara yang berbeda dengan metode di laboratorium. Berikut adalah beberapa contoh proses produksi halogen dalam skala industri:
- Klorin (Cl2) diproduksi secara elektrolitik dengan menggunakan larutan garam (NaCl) atau lelehan garam. Proses ini disebut elektrolisis garam. Klorin dihasilkan di anoda, sedangkan natrium (Na) dihasilkan di katoda.
- Bromin (Br2) diproduksi dari air laut dengan cara ekstraksi menggunakan klorin. Klorin bereaksi dengan ion bromida (Br–) dalam air laut membentuk bromin (Br2) yang kemudian dipisahkan dengan proses distilasi.
- Iodin (I2) diproduksi dari air laut atau dari sumur air asin dengan cara ekstraksi menggunakan klorin. Klorin bereaksi dengan ion iodida (I–) dalam air laut membentuk iodin (I2) yang kemudian dipisahkan dengan proses kristalisasi.
Diagram Alir Pembuatan Halogen
Diagram alir pembuatan halogen dapat diilustrasikan sebagai berikut:
| Tahap | Proses | Diagram |
|---|---|---|
| 1 | Pengumpulan bahan baku | [Diagram: Gambar simbol bahan baku seperti garam, air laut, dll.] |
| 2 | Pembuatan larutan/lelehan | [Diagram: Gambar proses pelarutan/pelelehan bahan baku] |
| 3 | Elektrolisis/reaksi kimia | [Diagram: Gambar proses elektrolisis atau reaksi kimia] |
| 4 | Pemisahan dan pemurnian | [Diagram: Gambar proses pemisahan dan pemurnian halogen] |
| 5 | Penyimpanan dan pengemasan | [Diagram: Gambar proses penyimpanan dan pengemasan halogen] |
Halogen dalam Industri
Halogen merupakan kelompok unsur kimia yang memiliki sifat reaktif tinggi dan sering digunakan dalam berbagai industri. Kemampuan mereka untuk membentuk ikatan kuat dengan berbagai macam unsur lainnya menjadikan mereka bahan baku yang penting dalam berbagai proses industri.
Peran Halogen dalam Industri Kimia
Halogen memainkan peran penting dalam industri kimia, terutama dalam sintesis berbagai senyawa organik dan anorganik. Berikut adalah beberapa contoh peran halogen dalam industri kimia:
- Sintesis Polimer: Halogen, seperti klorin dan fluor, digunakan dalam pembuatan polimer sintetis, seperti PVC (Polyvinyl Chloride) dan Teflon. PVC banyak digunakan untuk membuat pipa, kabel, dan bahan bangunan lainnya, sedangkan Teflon dikenal dengan sifat anti lengketnya dan banyak digunakan dalam peralatan dapur dan industri.
- Sintesis Pestisida dan Herbisida: Beberapa halogen, seperti klorin dan bromin, digunakan dalam pembuatan pestisida dan herbisida untuk mengendalikan hama dan gulma. Senyawa halogen yang digunakan dalam pestisida dan herbisida memiliki efektivitas yang tinggi dalam membunuh hama dan gulma, tetapi penggunaan mereka harus diawasi dengan ketat karena dapat berdampak negatif terhadap lingkungan.
- Sintesis Bahan Kimia Lainnya: Halogen juga digunakan dalam sintesis berbagai bahan kimia lainnya, seperti asam klorida (HCl), natrium hipoklorit (NaClO), dan kalium bromida (KBr). Asam klorida digunakan dalam berbagai proses industri, termasuk produksi plastik, pupuk, dan obat-obatan. Natrium hipoklorit digunakan sebagai pemutih dan desinfektan, sedangkan kalium bromida digunakan dalam pembuatan film fotografi.
Penggunaan Halogen dalam Industri Farmasi
Halogen juga memiliki peran penting dalam industri farmasi. Berikut adalah beberapa contoh penggunaan halogen dalam industri farmasi:
- Antibiotik: Halogen, seperti klorin dan fluor, sering digunakan dalam pembuatan antibiotik. Contohnya, antibiotik golongan kuinolon, seperti ciprofloxacin dan levofloxacin, mengandung atom fluor yang meningkatkan aktivitas antimikrobialnya.
- Obat Antijamur: Beberapa halogen, seperti iodin, digunakan dalam pembuatan obat antijamur. Contohnya, povidone-iodine digunakan sebagai antiseptik untuk mencegah infeksi jamur pada kulit dan luka.
- Obat Antidepresan: Halogen, seperti bromin, digunakan dalam pembuatan beberapa obat antidepresan. Contohnya, bromocriptine digunakan untuk mengobati penyakit Parkinson dan gangguan prolaktin.
Contoh Produk Industri yang Memanfaatkan Halogen
Berikut adalah beberapa contoh produk industri yang memanfaatkan halogen:
- PVC (Polyvinyl Chloride): PVC adalah plastik yang banyak digunakan dalam berbagai aplikasi, seperti pipa, kabel, dan bahan bangunan. PVC terbuat dari polimerisasi vinil klorida, yang mengandung atom klorin.
- Teflon: Teflon adalah polimer fluorocarbon yang dikenal dengan sifat anti lengketnya. Teflon digunakan dalam berbagai peralatan dapur, seperti wajan dan panci, serta dalam industri untuk melapisi permukaan yang tahan terhadap gesekan dan korosi.
- Freon: Freon adalah nama dagang untuk berbagai jenis klorofluorokarbon (CFC) yang dulunya banyak digunakan sebagai refrigeran dan propelan dalam aerosol. Penggunaan freon telah dikurangi secara drastis karena efeknya terhadap lapisan ozon.
- DDT (Dichlorodiphenyltrichloroethane): DDT adalah insektisida yang sangat efektif dalam mengendalikan penyakit yang ditularkan melalui serangga, seperti malaria. Namun, DDT juga memiliki efek negatif terhadap lingkungan dan kesehatan manusia, sehingga penggunaannya telah dilarang di banyak negara.
Penutup
Melalui contoh soal yang telah dibahas, kamu telah menjelajahi dunia halogen secara lebih dalam. Dari sifat kimia dan fisiknya, hingga aplikasi dan dampaknya terhadap lingkungan, pemahamanmu tentang halogen kini semakin kaya. Semoga contoh soal ini bermanfaat dalam membantu kamu memahami materi kimia dan mempersiapkan diri menghadapi ujian atau tantangan lainnya.





