Contoh soal hubungan mol dengan jumlah partikel – Pernahkah kamu bertanya-tanya bagaimana para ilmuwan menghitung jumlah atom atau molekul dalam suatu zat? Mereka menggunakan konsep mol, sebuah satuan yang menghubungkan jumlah partikel dengan massa zat. Dalam artikel ini, kita akan menjelajahi dunia mikroskopis atom dan molekul dengan mempelajari hubungan mol dengan jumlah partikel, yang merupakan konsep dasar dalam kimia.
Mempelajari hubungan mol dengan jumlah partikel akan membantumu memahami bagaimana ilmuwan menghitung jumlah atom atau molekul dalam suatu zat. Kita akan mempelajari konsep bilangan Avogadro, massa molar, dan volume molar, serta bagaimana konsep-konsep ini digunakan dalam berbagai perhitungan kimia. Siapkan dirimu untuk menyelami dunia atom dan molekul, dan mari kita mulai perjalanan kita untuk memahami hubungan mol dengan jumlah partikel!
Hubungan Mol dengan Massa
Setelah membahas hubungan mol dengan jumlah partikel, kita akan mempelajari hubungan mol dengan massa suatu zat. Konsep ini penting dalam kimia karena memungkinkan kita untuk menghitung massa suatu zat berdasarkan jumlah molnya, dan sebaliknya.
Hubungan Mol dan Massa
Hubungan antara mol dan massa suatu zat ditentukan oleh massa molar. Massa molar adalah massa 1 mol suatu zat. Satuan massa molar adalah gram per mol (g/mol).
Menghitung Massa Suatu Zat
Untuk menghitung massa suatu zat berdasarkan mol dan massa molarnya, kita dapat menggunakan rumus berikut:
Massa = Mol x Massa Molar
Contohnya, jika kita ingin mengetahui massa 2 mol air (H2O), kita perlu mengetahui massa molar air terlebih dahulu. Massa molar air adalah 18 g/mol (1 g/mol untuk H x 2 + 16 g/mol untuk O). Maka, massa 2 mol air adalah:
Massa = 2 mol x 18 g/mol = 36 gram
Konsep Massa Molar
Massa molar suatu zat dapat ditentukan dengan menjumlahkan massa atom relatif (Ar) dari semua atom dalam satu molekul zat tersebut. Ar dapat ditemukan pada tabel periodik unsur.
Misalnya, untuk menentukan massa molar natrium klorida (NaCl), kita perlu menjumlahkan Ar natrium (Na) dan Ar klor (Cl). Ar Na adalah 23 dan Ar Cl adalah 35,5. Maka, massa molar NaCl adalah:
Massa Molar NaCl = Ar Na + Ar Cl = 23 + 35,5 = 58,5 g/mol
Penyelesaian Soal Hubungan Mol dengan Jumlah Partikel: Contoh Soal Hubungan Mol Dengan Jumlah Partikel
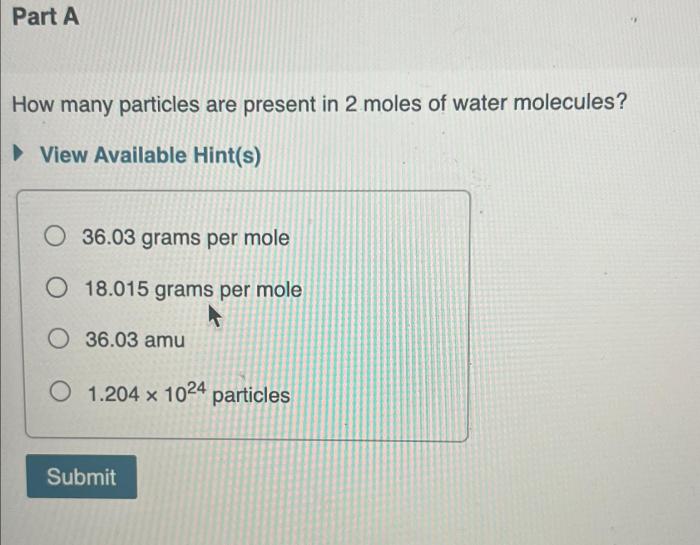
Hubungan mol dengan jumlah partikel merupakan konsep penting dalam kimia. Mol adalah satuan untuk menyatakan jumlah zat, sedangkan jumlah partikel mengacu pada jumlah atom, molekul, atau ion yang ada dalam suatu zat. Hubungan antara keduanya dapat dihubungkan melalui bilangan Avogadro, yaitu 6,022 x 1023 partikel per mol. Dalam soal-soal kimia, sering kali kita diminta untuk menghitung jumlah partikel dari suatu zat yang diketahui molnya, atau sebaliknya. Untuk menyelesaikan soal-soal tersebut, kita perlu memahami konsep mol dan bilangan Avogadro serta langkah-langkah penyelesaiannya.
Langkah-langkah Penyelesaian Soal
Untuk menyelesaikan soal hubungan mol dengan jumlah partikel, kita dapat mengikuti langkah-langkah berikut:
- Tentukan jenis partikel yang ingin dihitung. Apakah atom, molekul, atau ion?
- Tentukan jumlah mol zat yang diketahui.
- Gunakan bilangan Avogadro (6,022 x 1023 partikel/mol) untuk menghitung jumlah partikel.
- Jika diketahui jumlah partikel, gunakan bilangan Avogadro untuk menghitung jumlah mol.
Contoh Soal 1
Hitunglah jumlah molekul air (H2O) dalam 2 mol air!
Penyelesaian:
- Jenis partikel yang ingin dihitung adalah molekul air (H2O).
- Jumlah mol air yang diketahui adalah 2 mol.
- Gunakan bilangan Avogadro untuk menghitung jumlah molekul air:
Jumlah molekul air = 2 mol x 6,022 x 1023 molekul/mol = 1,2044 x 1024 molekul
Jadi, dalam 2 mol air terdapat 1,2044 x 1024 molekul air.
Contoh Soal 2
Berapa mol atom karbon (C) dalam 3,011 x 1023 atom karbon?
Penyelesaian:
- Jenis partikel yang ingin dihitung adalah atom karbon (C).
- Jumlah atom karbon yang diketahui adalah 3,011 x 1023 atom.
- Gunakan bilangan Avogadro untuk menghitung jumlah mol atom karbon:
Jumlah mol atom karbon = 3,011 x 1023 atom / 6,022 x 1023 atom/mol = 0,5 mol
Jadi, dalam 3,011 x 1023 atom karbon terdapat 0,5 mol atom karbon.
Contoh Soal 3
Hitunglah volume gas nitrogen (N2) pada STP jika diketahui massanya 14 gram!
Contoh soal hubungan mol dengan jumlah partikel biasanya melibatkan perhitungan jumlah molekul atau atom dalam suatu sampel. Misalnya, berapa banyak atom karbon dalam 2 mol karbon? Soal seperti ini cukup mudah jika kamu sudah memahami konsep dasar mol dan bilangan Avogadro.
Nah, untuk mengasah kemampuan logika verbalmu, kamu bisa mencoba mengerjakan contoh soal verbal logical reasoning yang bisa ditemukan di situs ini. Melatih logika verbal juga penting untuk memahami konsep-konsep kimia, termasuk hubungan mol dengan jumlah partikel.
Penyelesaian:
- Hitung mol gas nitrogen (N2) dengan rumus:
mol = massa / Mr
mol = 14 gram / 28 gram/mol = 0,5 mol - Gunakan hukum Avogadro untuk menghitung volume gas nitrogen pada STP:
Volume = mol x 22,4 L/mol
Volume = 0,5 mol x 22,4 L/mol = 11,2 L
Jadi, volume gas nitrogen pada STP adalah 11,2 L.
Kesalahan Umum dalam Menghitung Hubungan Mol dengan Jumlah Partikel
Menghitung hubungan mol dengan jumlah partikel merupakan konsep fundamental dalam kimia. Konsep ini penting untuk memahami kuantitas zat yang terlibat dalam reaksi kimia. Namun, dalam prakteknya, sering kali terjadi kesalahan dalam perhitungan ini. Kesalahan-kesalahan ini bisa disebabkan oleh kurangnya pemahaman konsep, kesalahan dalam penggunaan rumus, atau kurang teliti dalam memasukkan data.
Berikut ini adalah beberapa kesalahan umum yang sering terjadi dalam menghitung hubungan mol dengan jumlah partikel dan bagaimana cara menghindarinya:
Lupa Menggunakan Konstanta Avogadro, Contoh soal hubungan mol dengan jumlah partikel
Kesalahan umum yang sering terjadi adalah lupa menggunakan konstanta Avogadro (NA) dalam perhitungan. Konstanta Avogadro merupakan jumlah partikel (atom, molekul, ion) yang terdapat dalam 1 mol zat. Nilai konstanta Avogadro adalah 6,022 x 10^23 partikel/mol. Tanpa menggunakan konstanta Avogadro, hasil perhitungan jumlah partikel akan menjadi tidak tepat.
Contohnya, jika kita ingin menghitung jumlah atom dalam 2 mol karbon (C), kita perlu menggunakan konstanta Avogadro. Berikut adalah langkah-langkahnya:
Jumlah atom C = 2 mol C x 6,022 x 10^23 atom/mol = 1,2044 x 10^24 atom C
Tanpa menggunakan konstanta Avogadro, kita akan mendapatkan hasil yang salah, yaitu 2 atom C.
Mencampur Aduk Konsep Mol dengan Massa
Kesalahan umum lainnya adalah mencampur aduk konsep mol dengan massa. Mol merupakan satuan jumlah zat, sedangkan massa merupakan satuan ukuran berat. Kita tidak bisa langsung mengkonversi mol ke massa atau sebaliknya tanpa menggunakan massa molar.
Contohnya, jika kita ingin menghitung jumlah molekul dalam 10 gram air (H2O), kita perlu menggunakan massa molar air. Massa molar air adalah 18 g/mol. Berikut adalah langkah-langkahnya:
Jumlah mol H2O = 10 gram H2O / 18 g/mol = 0,5556 mol H2O
Jumlah molekul H2O = 0,5556 mol H2O x 6,022 x 10^23 molekul/mol = 3,346 x 10^23 molekul H2O
Kesalahan yang sering terjadi adalah langsung mengkonversi 10 gram H2O ke jumlah molekul tanpa menggunakan massa molar.
Kesalahan dalam Membaca dan Menginterpretasikan Rumus Kimia
Kesalahan umum yang sering terjadi adalah kesalahan dalam membaca dan menginterpretasikan rumus kimia. Rumus kimia menunjukkan jenis dan jumlah atom yang terdapat dalam suatu molekul. Misalnya, rumus kimia H2O menunjukkan bahwa setiap molekul air terdiri dari 2 atom hidrogen (H) dan 1 atom oksigen (O).
Contohnya, jika kita ingin menghitung jumlah atom hidrogen dalam 1 mol air (H2O), kita perlu memperhatikan rumus kimia H2O. Rumus kimia H2O menunjukkan bahwa setiap molekul air memiliki 2 atom hidrogen.
Jumlah atom H = 1 mol H2O x 2 atom H/molekul H2O x 6,022 x 10^23 molekul/mol = 1,2044 x 10^24 atom H
Kesalahan yang sering terjadi adalah langsung mengalikan 1 mol H2O dengan konstanta Avogadro tanpa memperhatikan jumlah atom hidrogen dalam setiap molekul air.
Kesalahan dalam Menghitung Jumlah Partikel dalam Campuran
Kesalahan umum yang sering terjadi adalah kesalahan dalam menghitung jumlah partikel dalam campuran. Dalam campuran, jumlah partikel setiap komponen tidak sama dengan jumlah partikel total. Kita perlu menghitung jumlah partikel setiap komponen secara terpisah.
Contohnya, jika kita ingin menghitung jumlah atom dalam 1 mol campuran yang terdiri dari 0,5 mol karbon (C) dan 0,5 mol oksigen (O), kita perlu menghitung jumlah atom C dan O secara terpisah.
Jumlah atom C = 0,5 mol C x 6,022 x 10^23 atom/mol = 3,011 x 10^23 atom C
Jumlah atom O = 0,5 mol O x 6,022 x 10^23 atom/mol = 3,011 x 10^23 atom O
Jumlah total atom dalam campuran = 3,011 x 10^23 atom C + 3,011 x 10^23 atom O = 6,022 x 10^23 atom
Kesalahan yang sering terjadi adalah langsung mengalikan 1 mol campuran dengan konstanta Avogadro tanpa menghitung jumlah atom setiap komponen secara terpisah.
Kesalahan dalam Menghitung Jumlah Partikel dalam Senyawa Ion
Kesalahan umum yang sering terjadi adalah kesalahan dalam menghitung jumlah partikel dalam senyawa ion. Senyawa ion terdiri dari ion positif dan ion negatif yang bergabung membentuk kisi kristal. Dalam kisi kristal, jumlah ion positif dan ion negatif seimbang sehingga senyawa ion bersifat netral.
Contohnya, jika kita ingin menghitung jumlah ion dalam 1 mol NaCl, kita perlu memperhatikan rumus kimia NaCl. Rumus kimia NaCl menunjukkan bahwa setiap satuan NaCl terdiri dari 1 ion Na+ dan 1 ion Cl-.
Jumlah ion Na+ = 1 mol NaCl x 1 ion Na+/mol NaCl x 6,022 x 10^23 ion/mol = 6,022 x 10^23 ion Na+
Jumlah ion Cl- = 1 mol NaCl x 1 ion Cl-/mol NaCl x 6,022 x 10^23 ion/mol = 6,022 x 10^23 ion Cl-
Jumlah total ion dalam 1 mol NaCl = 6,022 x 10^23 ion Na+ + 6,022 x 10^23 ion Cl- = 1,2044 x 10^24 ion
Kesalahan yang sering terjadi adalah langsung mengalikan 1 mol NaCl dengan konstanta Avogadro tanpa memperhatikan jumlah ion dalam setiap satuan NaCl.
Penutupan
Memahami hubungan mol dengan jumlah partikel adalah kunci untuk memahami dunia kimia. Konsep ini memungkinkan kita untuk menghitung jumlah atom atau molekul dalam suatu zat, dan merupakan dasar untuk berbagai perhitungan kimia lainnya. Dengan mempelajari konsep mol, kita dapat memahami lebih dalam tentang bagaimana zat-zat bereaksi dan bagaimana kita dapat memanfaatkannya dalam berbagai aplikasi, seperti industri kimia, farmasi, dan biologi.





