Contoh soal larutan elektrolit dan non elektrolit – Pernahkah kamu bertanya-tanya mengapa air garam bisa menghantarkan listrik, sedangkan air gula tidak? Nah, itulah misteri di balik larutan elektrolit dan non elektrolit! Sederhananya, larutan elektrolit adalah larutan yang bisa menghantarkan listrik karena mengandung ion-ion yang bergerak bebas, sedangkan larutan non elektrolit tidak memiliki ion sehingga tidak bisa menghantarkan listrik.
Dalam artikel ini, kita akan menjelajahi dunia larutan elektrolit dan non elektrolit lebih dalam, mulai dari pengertian dasar hingga contoh soal yang akan menguji pemahamanmu. Siap-siap untuk mengasah otak dan menjelajahi berbagai contoh soal yang menarik!
Pengertian Larutan Elektrolit dan Non Elektrolit
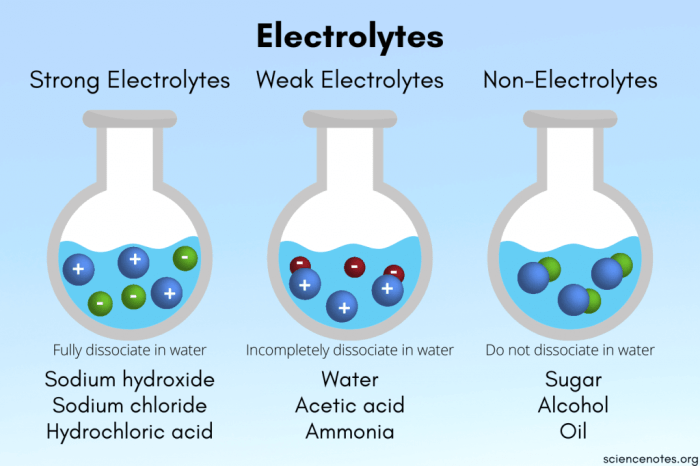
Larutan merupakan campuran homogen antara zat terlarut dan pelarut. Berdasarkan kemampuannya menghantarkan arus listrik, larutan dibedakan menjadi dua jenis, yaitu larutan elektrolit dan larutan non elektrolit.
Perbedaan Larutan Elektrolit dan Non Elektrolit
Perbedaan mendasar antara larutan elektrolit dan non elektrolit terletak pada kemampuannya menghantarkan arus listrik. Larutan elektrolit dapat menghantarkan arus listrik, sedangkan larutan non elektrolit tidak dapat menghantarkan arus listrik.
Contoh Larutan Elektrolit dan Non Elektrolit
Larutan elektrolit dan non elektrolit banyak dijumpai dalam kehidupan sehari-hari. Berikut beberapa contohnya:
- Larutan Elektrolit
- Air garam (NaCl(aq))
- Air gula (C12H22O11(aq))
- Air jeruk (asam sitrat (aq))
- Larutan baterai (asam sulfat (aq))
- Air aki (asam sulfat (aq))
- Larutan Non Elektrolit
- Air murni (H2O(l))
- Gula pasir (C12H22O11(s))
- Minyak goreng (C17H35COOH(l))
- Alkohol (C2H5OH(l))
- Eter (C4H10O(l))
Perbandingan Sifat Larutan Elektrolit dan Non Elektrolit
Berikut tabel perbandingan sifat larutan elektrolit dan non elektrolit:
| Nama | Rumus Kimia | Sifat | Contoh |
|---|---|---|---|
| Elektrolit | NaCl, HCl, H2SO4 | Dapat menghantarkan arus listrik, memiliki derajat ionisasi tinggi, terurai menjadi ion-ion dalam larutan | Air garam, air aki, air jeruk |
| Non Elektrolit | C12H22O11, C2H5OH | Tidak dapat menghantarkan arus listrik, memiliki derajat ionisasi rendah, tidak terurai menjadi ion-ion dalam larutan | Gula pasir, alkohol, minyak goreng |
Faktor yang Mempengaruhi Kekuatan Larutan Elektrolit
Kekuatan larutan elektrolit merupakan kemampuan larutan untuk menghantarkan arus listrik. Semakin kuat larutan elektrolit, semakin baik kemampuannya menghantarkan arus listrik. Kekuatan larutan elektrolit dipengaruhi oleh beberapa faktor, antara lain:
Konsentrasi Larutan
Konsentrasi larutan menunjukkan jumlah zat terlarut dalam suatu volume pelarut. Semakin tinggi konsentrasi larutan, semakin banyak ion yang terlarut dalam larutan. Hal ini mengakibatkan semakin banyak ion yang dapat bergerak bebas dan menghantarkan arus listrik. Dengan demikian, daya hantar listrik larutan akan semakin tinggi.
Contoh soal larutan elektrolit dan non elektrolit biasanya membahas tentang kemampuan zat untuk menghantarkan arus listrik. Sama seperti contoh soal larutan elektrolit dan non elektrolit, memahami konsep dasar penting untuk menyelesaikan contoh soal poligon. Contoh soal poligon biasanya membahas tentang sifat-sifat geometri seperti jumlah sisi dan sudut.
Mempelajari contoh soal poligon bisa membantu kita memahami konsep dasar geometri yang bisa diterapkan pada berbagai bidang, termasuk kimia, dan bisa memudahkan kita dalam menyelesaikan contoh soal larutan elektrolit dan non elektrolit.
- Sebagai contoh, larutan NaCl dengan konsentrasi 1 M akan memiliki daya hantar listrik yang lebih tinggi dibandingkan dengan larutan NaCl dengan konsentrasi 0,1 M.
Suhu
Suhu juga dapat mempengaruhi kekuatan larutan elektrolit. Semakin tinggi suhu, semakin tinggi energi kinetik ion dalam larutan. Hal ini menyebabkan ion bergerak lebih cepat dan lebih bebas, sehingga meningkatkan daya hantar listrik.
- Contohnya, larutan asam sulfat (H2SO4) akan memiliki daya hantar listrik yang lebih tinggi pada suhu 50oC dibandingkan dengan suhu 25oC.
Jenis Pelarut
Jenis pelarut juga dapat mempengaruhi kekuatan larutan elektrolit. Pelarut polar seperti air (H2O) cenderung melarutkan zat terlarut ionik dengan baik. Hal ini karena pelarut polar dapat membentuk ikatan hidrogen dengan ion-ion dalam zat terlarut, sehingga memisahkan ion-ion tersebut dan meningkatkan daya hantar listrik.
- Contohnya, garam dapur (NaCl) akan lebih mudah larut dalam air dibandingkan dengan minyak goreng. Hal ini karena air merupakan pelarut polar, sedangkan minyak goreng merupakan pelarut non-polar.
Sifat Zat Terlarut
Sifat zat terlarut juga dapat mempengaruhi kekuatan larutan elektrolit. Zat terlarut yang mudah terionisasi dalam larutan akan menghasilkan lebih banyak ion, sehingga meningkatkan daya hantar listrik.
- Contohnya, asam kuat seperti HCl akan terionisasi sempurna dalam larutan, sehingga menghasilkan daya hantar listrik yang tinggi.
- Sebaliknya, asam lemah seperti CH3COOH hanya terionisasi sebagian dalam larutan, sehingga menghasilkan daya hantar listrik yang lebih rendah.
Pengujian Daya Hantar Listrik Larutan: Contoh Soal Larutan Elektrolit Dan Non Elektrolit
Untuk menentukan apakah suatu larutan bersifat elektrolit atau non elektrolit, kita perlu menguji daya hantar listriknya. Daya hantar listrik adalah kemampuan suatu zat untuk menghantarkan arus listrik. Larutan elektrolit dapat menghantarkan arus listrik karena mengandung ion-ion yang bergerak bebas, sedangkan larutan non elektrolit tidak dapat menghantarkan arus listrik karena tidak mengandung ion-ion yang bergerak bebas.
Cara Sederhana Menguji Daya Hantar Listrik Larutan
Ada beberapa cara sederhana untuk menguji daya hantar listrik larutan, salah satunya dengan menggunakan alat uji sederhana yang terdiri dari:
- Sumber tegangan (baterai)
- Lampu pijar kecil
- Dua buah elektroda (misalnya, kawat tembaga)
- Kabel penghubung
Cara kerjanya adalah sebagai berikut:
- Hubungkan elektroda ke sumber tegangan dan lampu pijar melalui kabel penghubung. Pastikan rangkaian tertutup.
- Celupkan kedua elektroda ke dalam larutan yang akan diuji.
- Amati apakah lampu pijar menyala atau tidak.
Jika lampu pijar menyala, maka larutan tersebut bersifat elektrolit karena mengandung ion-ion yang bergerak bebas yang menghantarkan arus listrik. Sebaliknya, jika lampu pijar tidak menyala, maka larutan tersebut bersifat non elektrolit karena tidak mengandung ion-ion yang bergerak bebas.
Prinsip Kerja Alat Uji Daya Hantar Listrik
Alat uji daya hantar listrik yang lebih canggih biasanya menggunakan multimeter. Multimeter adalah alat ukur elektronik yang dapat mengukur berbagai besaran listrik, termasuk arus listrik. Prinsip kerja multimeter dalam menguji daya hantar listrik adalah dengan mengukur besarnya arus listrik yang mengalir melalui larutan.
Ketika elektroda multimeter dicelupkan ke dalam larutan, arus listrik akan mengalir melalui larutan jika larutan tersebut mengandung ion-ion yang bergerak bebas. Besarnya arus listrik yang mengalir akan ditunjukkan oleh jarum penunjuk pada multimeter. Semakin besar arus listrik yang mengalir, maka semakin tinggi daya hantar listrik larutan tersebut.
Tabel Hasil Pengujian Daya Hantar Listrik
| Nama Larutan | Hasil Pengujian | Kesimpulan |
|---|---|---|
| Air murni | Lampu tidak menyala/jarum multimeter tidak menyimpang | Non elektrolit |
| Larutan gula | Lampu tidak menyala/jarum multimeter tidak menyimpang | Non elektrolit |
| Larutan garam dapur | Lampu menyala/jarum multimeter menyimpang | Elektrolit |
| Larutan asam cuka | Lampu menyala/jarum multimeter menyimpang | Elektrolit |
| Larutan NaOH | Lampu menyala/jarum multimeter menyimpang | Elektrolit |
Aplikasi Larutan Elektrolit dan Non Elektrolit
Larutan elektrolit dan non elektrolit memiliki peran penting dalam berbagai aspek kehidupan kita, baik dalam industri, kesehatan, maupun kehidupan sehari-hari. Penggunaan larutan elektrolit dan non elektrolit memberikan manfaat yang signifikan dan telah menjadi bagian integral dari berbagai proses dan produk yang kita gunakan.
Aplikasi Larutan Elektrolit dalam Kehidupan Sehari-hari, Contoh soal larutan elektrolit dan non elektrolit
Larutan elektrolit, yang mampu menghantarkan arus listrik, memiliki banyak aplikasi dalam kehidupan sehari-hari. Berikut adalah beberapa contohnya:
- Baterai: Baterai, baik yang digunakan dalam perangkat elektronik maupun kendaraan, memanfaatkan larutan elektrolit untuk menghasilkan arus listrik. Larutan elektrolit dalam baterai umumnya berupa asam, basa, atau garam yang terlarut dalam air atau pelarut lain.
- Elektrolit Olahraga: Elektrolit, seperti natrium, kalium, dan magnesium, merupakan komponen penting dalam cairan tubuh. Saat berolahraga, tubuh kehilangan elektrolit melalui keringat. Elektrolit olahraga membantu mengganti elektrolit yang hilang dan menjaga keseimbangan cairan tubuh.
- Pengolahan Air: Larutan elektrolit digunakan dalam proses pengolahan air untuk menghilangkan kotoran, logam berat, dan bakteri. Elektrolisis, yang melibatkan penggunaan arus listrik dalam larutan elektrolit, membantu membersihkan air dan membuatnya lebih aman untuk dikonsumsi.
Penggunaan Larutan Elektrolit dalam Baterai
Baterai merupakan salah satu aplikasi penting larutan elektrolit. Baterai terdiri dari dua elektroda (anoda dan katoda) yang dicelupkan dalam larutan elektrolit. Ketika baterai dihubungkan ke sirkuit, reaksi kimia terjadi di elektroda, melepaskan elektron dan menghasilkan arus listrik. Larutan elektrolit berperan sebagai penghantar ion yang memungkinkan arus listrik mengalir antara elektroda.
Jenis larutan elektrolit yang digunakan dalam baterai bervariasi tergantung pada jenis baterai. Misalnya, baterai asam timbal menggunakan larutan asam sulfat sebagai elektrolit, sedangkan baterai alkali menggunakan larutan kalium hidroksida. Baterai lithium-ion, yang umum digunakan dalam perangkat elektronik, menggunakan garam lithium sebagai elektrolit.
Penggunaan Larutan Non Elektrolit dalam Industri Makanan dan Minuman
Larutan non elektrolit, yang tidak dapat menghantarkan arus listrik, juga memiliki peran penting dalam industri makanan dan minuman. Berikut adalah beberapa contoh penggunaannya:
- Pembuatan Minuman Manis: Gula, seperti sukrosa, merupakan larutan non elektrolit yang umum digunakan dalam pembuatan minuman manis. Gula memberikan rasa manis dan membantu menjaga keseimbangan rasa dalam minuman.
- Preservasi Makanan: Garam dan gula, sebagai larutan non elektrolit, digunakan sebagai pengawet makanan. Garam dan gula membantu mengurangi pertumbuhan bakteri dan jamur, sehingga memperpanjang masa simpan makanan.
- Pembuatan Produk Susu: Susu dan produk susu lainnya mengandung laktosa, yang merupakan larutan non elektrolit. Laktosa memberikan rasa manis dan tekstur yang khas pada produk susu.
Contoh Larutan Elektrolit dan Non Elektrolit dalam Bidang Kesehatan
Larutan elektrolit dan non elektrolit memiliki peran penting dalam menjaga kesehatan manusia. Berikut adalah beberapa contohnya:
| Jenis Larutan | Contoh | Fungsi dalam Kesehatan |
|---|---|---|
| Elektrolit | Natrium klorida (NaCl), Kalium klorida (KCl), Kalsium klorida (CaCl2) | Menjaga keseimbangan cairan tubuh, membantu fungsi otot dan saraf, mengatur tekanan darah. |
| Non Elektrolit | Glukosa (C6H12O6), Urea (CH4N2O), Asam Urat (C5H4N4O3) | Sumber energi, produk sisa metabolisme, membantu proses detoksifikasi. |
Soal Latihan Larutan Elektrolit dan Non Elektrolit
Larutan elektrolit dan non elektrolit merupakan konsep penting dalam kimia yang menjelaskan kemampuan suatu zat untuk menghantarkan arus listrik ketika dilarutkan dalam air. Pemahaman tentang konsep ini membantu kita memahami berbagai fenomena kimia dan aplikasinya dalam kehidupan sehari-hari.
Berikut adalah beberapa contoh soal latihan yang dapat membantu kamu memahami konsep larutan elektrolit dan non elektrolit.
Soal Pilihan Ganda
Soal pilihan ganda merupakan soal yang menuntut kamu untuk memilih jawaban yang paling tepat dari beberapa pilihan yang tersedia. Soal ini menguji pemahamanmu tentang konsep dasar larutan elektrolit dan non elektrolit.
- Manakah dari zat berikut yang merupakan larutan elektrolit kuat?
- Larutan manakah yang tidak dapat menghantarkan arus listrik?
- Apa yang terjadi ketika larutan elektrolit dialiri arus listrik?
- Manakah dari pernyataan berikut yang benar tentang larutan non elektrolit?
- Apa yang membedakan larutan elektrolit lemah dengan larutan elektrolit kuat?
Soal Essay
Soal essay menuntut kamu untuk menulis jawaban yang lebih lengkap dan rinci. Soal ini menguji kemampuanmu untuk menganalisis dan menjelaskan konsep larutan elektrolit dan non elektrolit.
- Jelaskan faktor-faktor yang mempengaruhi kekuatan larutan elektrolit.
- Bagaimana konsentrasi larutan mempengaruhi kekuatan elektrolit? Berikan contoh untuk memperjelas jawabanmu.
- Bagaimana suhu mempengaruhi kekuatan elektrolit? Jelaskan dengan menggunakan teori yang relevan.
Soal Uraian
Soal uraian meminta kamu untuk menganalisis hasil pengujian daya hantar listrik. Soal ini menguji kemampuanmu untuk menginterpretasikan data dan menghubungkannya dengan konsep larutan elektrolit dan non elektrolit.
- Sebuah larutan diuji dengan menggunakan alat uji daya hantar listrik. Lampu pada alat tersebut menyala terang. Jelaskan jenis larutan tersebut dan berikan alasannya.
- Dua larutan, A dan B, diuji dengan menggunakan alat uji daya hantar listrik. Lampu pada alat tersebut menyala redup untuk larutan A dan tidak menyala untuk larutan B. Jelaskan perbedaan jenis larutan A dan B serta berikan alasannya.
Soal Cerita
Soal cerita menguji kemampuanmu untuk menghubungkan konsep larutan elektrolit dan non elektrolit dengan aplikasi dalam kehidupan sehari-hari.
Seorang petani ingin menanam tanaman cabai di ladangnya. Ia membeli pupuk kimia untuk membantu pertumbuhan tanaman. Pupuk kimia tersebut mengandung ion-ion yang penting bagi pertumbuhan tanaman. Pupuk kimia tersebut dilarutkan dalam air sebelum digunakan. Jelaskan mengapa pupuk kimia tersebut harus dilarutkan dalam air sebelum digunakan. Jelaskan juga jenis larutan yang terbentuk ketika pupuk kimia dilarutkan dalam air.
Kesimpulan
Nah, sekarang kamu sudah lebih memahami tentang larutan elektrolit dan non elektrolit. Dari pemahaman tentang perbedaan keduanya, faktor-faktor yang memengaruhi kekuatan larutan elektrolit, hingga contoh soal yang menantang, kamu siap untuk menguasai materi ini. Ingat, kunci utama adalah memahami konsep dan berlatih dengan berbagai contoh soal. Selamat belajar dan semoga sukses!





