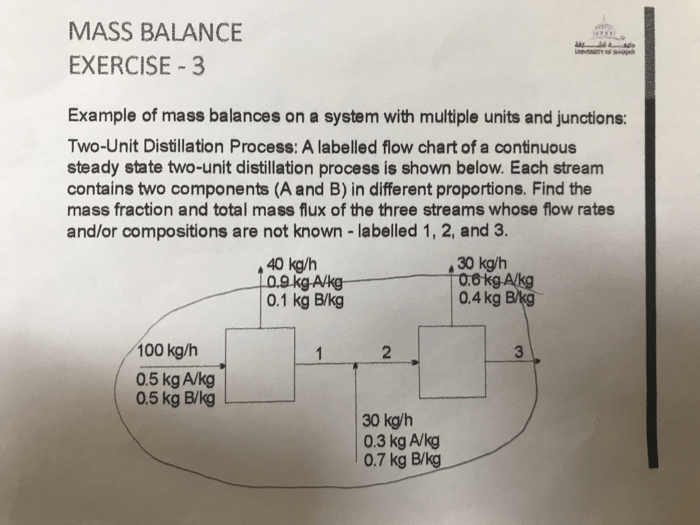
Pernahkah kamu bertanya-tanya bagaimana kecepatan suatu reaksi kimia dapat diukur dan diprediksi? Contoh soal orde reaksi 2 akan membantumu memahami konsep laju reaksi kimia yang melibatkan dua molekul reaktan. Dengan mempelajari contoh soal ini, kamu akan memahami bagaimana konsentrasi reaktan memengaruhi kecepatan reaksi dan bagaimana menentukan orde reaksi suatu reaksi kimia.
Orde reaksi 2 merupakan salah satu konsep penting dalam kimia yang menjelaskan hubungan antara konsentrasi reaktan dengan laju reaksi. Orde reaksi 2 menunjukkan bahwa laju reaksi bergantung pada konsentrasi dua molekul reaktan. Dengan memahami konsep ini, kita dapat memprediksi kecepatan reaksi dan mengendalikannya dalam berbagai proses kimia, seperti produksi obat-obatan, pembuatan pupuk, dan reaksi pembakaran.
Pengertian Orde Reaksi 2

Dalam dunia kimia, reaksi kimia terjadi dengan berbagai kecepatan. Kecepatan reaksi dipengaruhi oleh beberapa faktor, seperti konsentrasi reaktan, suhu, dan katalis. Untuk mempelajari kecepatan reaksi, kita perlu memahami konsep orde reaksi. Orde reaksi adalah pangkat konsentrasi reaktan dalam persamaan laju reaksi. Orde reaksi 2 merupakan salah satu jenis orde reaksi yang penting untuk dipahami.
Definisi Orde Reaksi 2
Orde reaksi 2 adalah reaksi kimia yang laju reaksinya bergantung pada kuadrat konsentrasi satu reaktan atau pada hasil kali konsentrasi dua reaktan. Artinya, jika konsentrasi salah satu reaktan digandakan, laju reaksinya akan meningkat empat kali lipat.
Contoh soal orde reaksi 2 biasanya melibatkan penentuan laju reaksi berdasarkan konsentrasi reaktan. Mirip dengan menyelesaikan contoh soal lari estafet yang menghitung waktu tempuh berdasarkan waktu masing-masing pelari, contoh soal orde reaksi 2 memerlukan analisis terhadap pengaruh konsentrasi reaktan terhadap waktu reaksi.
Memahami konsep orde reaksi 2 akan membantumu dalam memahami kinetika reaksi kimia yang lebih kompleks.
Contoh Reaksi Orde 2, Contoh soal orde reaksi 2
Berikut adalah beberapa contoh reaksi kimia yang termasuk dalam orde reaksi 2:
- Reaksi antara hidrogen dan iodida:
- Reaksi antara ion hidrogen dan ion hidroksida:
- Reaksi antara nitrogen dioksida:
H2(g) + I2(g) → 2HI(g)
H+(aq) + OH–(aq) → H2O(l)
2NO2(g) → 2NO(g) + O2(g)
Perbandingan Orde Reaksi
Berikut adalah tabel yang membandingkan karakteristik orde reaksi 2 dengan orde reaksi lainnya (orde 0, 1, dan 3):
| Orde Reaksi | Persamaan Laju Reaksi | Satuan Konstanta Laju | Hubungan antara Konsentrasi dan Waktu |
|---|---|---|---|
| 0 | r = k | mol L-1 s-1 | Konsentrasi berkurang secara linear terhadap waktu. |
| 1 | r = k[A] | s-1 | Konsentrasi berkurang secara eksponensial terhadap waktu. |
| 2 | r = k[A]2 atau r = k[A][B] | L mol-1 s-1 | Konsentrasi berkurang secara hiperbolik terhadap waktu. |
| 3 | r = k[A]3 atau r = k[A]2[B] atau r = k[A][B][C] | L2 mol-2 s-1 | Konsentrasi berkurang dengan rumus yang lebih kompleks terhadap waktu. |
Hukum Laju Reaksi Orde 2: Contoh Soal Orde Reaksi 2
Hukum laju reaksi adalah persamaan matematis yang menggambarkan hubungan antara laju reaksi dengan konsentrasi reaktan. Orde reaksi menunjukkan bagaimana laju reaksi dipengaruhi oleh perubahan konsentrasi reaktan. Orde reaksi 2 berarti bahwa laju reaksi berbanding lurus dengan kuadrat konsentrasi reaktan atau dengan perkalian konsentrasi dua reaktan yang berbeda.
Persamaan Hukum Laju Reaksi Orde 2
Persamaan hukum laju reaksi untuk orde reaksi 2 dapat dituliskan sebagai berikut:
laju = k[A]2
atau
laju = k[A][B]
di mana:
- laju adalah laju reaksi
- k adalah konstanta laju reaksi
- [A] dan [B] adalah konsentrasi reaktan A dan B
Arti Simbol dalam Persamaan Hukum Laju Reaksi Orde 2
Setiap simbol dalam persamaan hukum laju reaksi orde 2 memiliki arti yang spesifik:
- laju: Laju reaksi adalah perubahan konsentrasi reaktan atau produk per satuan waktu. Biasanya diukur dalam mol per liter per detik (mol/L·s).
- k: Konstanta laju reaksi adalah faktor proporsionalitas yang menunjukkan seberapa cepat reaksi berlangsung. Nilai k dipengaruhi oleh faktor-faktor seperti suhu, katalis, dan luas permukaan. Unit k bergantung pada orde reaksi.
- [A] dan [B]: Konsentrasi reaktan A dan B adalah jumlah mol reaktan per liter larutan. Biasanya diukur dalam mol per liter (mol/L).
Contoh Soal Perhitungan Laju Reaksi Orde 2
Misalkan reaksi antara hidrogen (H2) dan iodium (I2) membentuk hidrogen iodida (HI) adalah orde 2 terhadap H2 dan orde 1 terhadap I2.
H2(g) + I2(g) → 2HI(g)
Persamaan hukum laju reaksinya adalah:
laju = k[H2]2[I2]
Jika konstanta laju reaksi (k) adalah 1,5 x 10-3 L2/mol2·s, dan konsentrasi H2 adalah 0,2 mol/L dan konsentrasi I2 adalah 0,1 mol/L, maka laju reaksinya adalah:
laju = (1,5 x 10-3 L2/mol2·s)(0,2 mol/L)2(0,1 mol/L) = 6 x 10-6 mol/L·s
Penentuan Orde Reaksi 2
Orde reaksi adalah eksponen yang menunjukkan bagaimana konsentrasi reaktan mempengaruhi laju reaksi. Orde reaksi 2 menunjukkan bahwa laju reaksi berbanding lurus dengan kuadrat konsentrasi salah satu reaktan, atau hasil kali konsentrasi dua reaktan. Penentuan orde reaksi 2 dilakukan melalui eksperimen, dan ada beberapa metode yang dapat digunakan untuk menentukannya.
Metode Penentuan Orde Reaksi 2
Beberapa metode yang dapat digunakan untuk menentukan orde reaksi 2 secara eksperimen adalah:
- Metode Grafik: Metode ini melibatkan penggambaran data eksperimen dalam bentuk grafik. Grafik yang dihasilkan kemudian dianalisis untuk menentukan orde reaksi. Contohnya, jika grafik laju reaksi terhadap konsentrasi reaktan menghasilkan garis lurus, maka reaksi tersebut berorde 1 terhadap reaktan tersebut. Jika grafik laju reaksi terhadap kuadrat konsentrasi reaktan menghasilkan garis lurus, maka reaksi tersebut berorde 2 terhadap reaktan tersebut.
- Metode Integral: Metode ini melibatkan integrasi persamaan laju reaksi untuk mendapatkan persamaan konsentrasi reaktan sebagai fungsi waktu. Persamaan ini kemudian digunakan untuk menentukan orde reaksi dengan membandingkan data eksperimen dengan prediksi persamaan. Metode ini lebih rumit daripada metode grafik, tetapi dapat memberikan informasi yang lebih akurat.
- Metode Setengah Hayat: Metode ini melibatkan pengukuran waktu paruh reaksi, yaitu waktu yang dibutuhkan konsentrasi reaktan untuk berkurang menjadi setengahnya. Waktu paruh reaksi bergantung pada orde reaksi. Untuk reaksi orde 2, waktu paruh berbanding terbalik dengan konsentrasi awal reaktan. Dengan mengukur waktu paruh reaksi pada berbagai konsentrasi awal, orde reaksi dapat ditentukan.
- Metode Laju Awal: Metode ini melibatkan pengukuran laju reaksi pada berbagai konsentrasi awal reaktan. Laju reaksi kemudian dianalisis untuk menentukan orde reaksi. Jika laju reaksi berlipat ganda ketika konsentrasi reaktan dilipatgandakan, maka reaksi tersebut berorde 1 terhadap reaktan tersebut. Jika laju reaksi berlipat empat ketika konsentrasi reaktan dilipatgandakan, maka reaksi tersebut berorde 2 terhadap reaktan tersebut.
Contoh Soal Penentuan Orde Reaksi 2
Perhatikan data eksperimen berikut untuk reaksi A + B → C:
| Percobaan | [A] (M) | [B] (M) | Laju Awal (M/s) |
|---|---|---|---|
| 1 | 0.1 | 0.1 | 0.01 |
| 2 | 0.2 | 0.1 | 0.04 |
| 3 | 0.1 | 0.2 | 0.02 |
Tentukan orde reaksi terhadap A dan B, serta orde reaksi keseluruhan.
Penyelesaian:
Pertama, tentukan orde reaksi terhadap A. Perhatikan percobaan 1 dan 2, dimana konsentrasi B tetap, sedangkan konsentrasi A dilipatgandakan. Laju reaksi juga dilipatgandakan. Ini menunjukkan bahwa reaksi berorde 1 terhadap A.
Selanjutnya, tentukan orde reaksi terhadap B. Perhatikan percobaan 1 dan 3, dimana konsentrasi A tetap, sedangkan konsentrasi B dilipatgandakan. Laju reaksi juga dilipatgandakan. Ini menunjukkan bahwa reaksi berorde 1 terhadap B.
Orde reaksi keseluruhan adalah jumlah orde reaksi terhadap masing-masing reaktan. Dalam kasus ini, orde reaksi keseluruhan adalah 1 + 1 = 2.
Jadi, reaksi ini berorde 2, dengan orde 1 terhadap A dan orde 1 terhadap B.
Perbedaan Metode Penentuan Orde Reaksi
Berikut tabel yang menunjukkan perbedaan metode penentuan orde reaksi dan kelebihan serta kekurangan masing-masing metode:
| Metode | Kelebihan | Kekurangan |
|---|---|---|
| Metode Grafik | Mudah dipahami dan diimplementasikan | Kurang akurat untuk data yang tersebar |
| Metode Integral | Lebih akurat daripada metode grafik | Lebih rumit dan membutuhkan integrasi persamaan laju reaksi |
| Metode Setengah Hayat | Mudah diterapkan dan memberikan informasi tentang waktu paruh reaksi | Hanya dapat digunakan untuk reaksi orde 1 dan 2 |
| Metode Laju Awal | Mudah diterapkan dan memberikan informasi tentang pengaruh konsentrasi reaktan terhadap laju reaksi | Membutuhkan pengukuran laju reaksi pada berbagai konsentrasi awal reaktan |
Ulasan Penutup
Dengan mempelajari contoh soal orde reaksi 2, kita dapat memahami bagaimana laju reaksi kimia dipengaruhi oleh konsentrasi reaktan. Konsep ini sangat penting dalam berbagai bidang, seperti kimia, biologi, dan industri. Dengan memahami konsep ini, kita dapat mengendalikan kecepatan reaksi dan mengoptimalkan proses kimia yang melibatkan reaksi orde 2.