Contoh soal pauli – Pernahkah Anda bertanya-tanya bagaimana atom-atom bisa bergabung membentuk molekul yang kompleks? Jawabannya terletak pada prinsip pengecualian Pauli, sebuah konsep fundamental dalam fisika kuantum yang mengatur perilaku elektron dalam atom. Prinsip ini, yang diusulkan oleh fisikawan Wolfgang Pauli, menyatakan bahwa dua elektron dalam suatu atom tidak dapat memiliki bilangan kuantum yang sama. Konsep ini, yang dikenal sebagai soal Pauli, memiliki implikasi yang luas dalam kimia, fisika, dan bahkan teknologi.
Soal Pauli membantu kita memahami bagaimana elektron tersusun dalam atom, bagaimana atom-atom berikatan membentuk molekul, dan bagaimana sifat-sifat materi ditentukan oleh susunan elektronnya. Dalam artikel ini, kita akan menjelajahi konsep soal Pauli, membahas jenis-jenis soal yang umum dijumpai, dan bagaimana cara menyelesaikannya. Kita juga akan melihat bagaimana prinsip ini diterapkan dalam berbagai bidang, seperti dalam pembuatan laser, semikonduktor, dan bahkan dalam memahami sifat-sifat obat-obatan.
Pengertian Soal Pauli
Soal Pauli adalah konsep fundamental dalam fisika kuantum yang menggambarkan perilaku elektron dalam atom. Konsep ini berakar pada prinsip pengecualian Pauli, yang menyatakan bahwa dua elektron dalam atom tidak dapat memiliki bilangan kuantum yang sama. Dengan kata lain, setiap elektron dalam atom harus memiliki sekumpulan bilangan kuantum yang unik, yang menggambarkan keadaan kuantumnya.
Prinsip Pengecualian Pauli
Prinsip pengecualian Pauli adalah salah satu prinsip paling penting dalam mekanika kuantum. Prinsip ini menyatakan bahwa dua fermion (partikel dengan spin setengah bulat, seperti elektron) tidak dapat menempati keadaan kuantum yang sama. Ini berarti bahwa tidak ada dua elektron dalam atom yang dapat memiliki bilangan kuantum yang sama, termasuk bilangan kuantum spinnya.
- Bilangan kuantum utama (n) menggambarkan tingkat energi elektron.
- Bilangan kuantum azimut (l) menggambarkan bentuk orbital elektron.
- Bilangan kuantum magnetik (ml) menggambarkan orientasi orbital elektron dalam ruang.
- Bilangan kuantum spin (ms) menggambarkan momen magnetik intrinsik elektron, yang merupakan sifat kuantum yang dapat dibayangkan sebagai “putaran” elektron.
Prinsip pengecualian Pauli menjelaskan mengapa elektron dalam atom mengisi orbital secara berurutan, dengan masing-masing orbital diisi dengan maksimal dua elektron, yang memiliki spin yang berlawanan. Hal ini juga menjelaskan mengapa atom memiliki struktur elektronik tertentu, yang menentukan sifat kimia atom tersebut.
Contoh soal Pauli bisa membantu kamu memahami konsep dasar kimia, terutama mengenai konfigurasi elektron. Nah, kalau kamu lagi cari contoh soal untuk persiapan perjalanan dinas pimpinan, bisa nih kamu cek contoh soal perjalanan dinas pimpinan yang lengkap di website ini.
Dengan latihan soal, kamu bisa lebih siap dan profesional saat menghadapi perjalanan dinas. Kembali ke contoh soal Pauli, soal-soal ini bisa membantu kamu menguasai konsep dan lebih mudah dalam menyelesaikan soal kimia lainnya.
Contoh Soal Pauli
Sebagai contoh sederhana, perhatikan atom helium (He). Atom helium memiliki dua proton dan dua neutron di intinya, dan dua elektron di kulit elektronnya. Kedua elektron ini menempati orbital 1s, yang merupakan orbital terendah energi. Karena prinsip pengecualian Pauli, kedua elektron ini harus memiliki spin yang berlawanan.
Elektron pertama memiliki bilangan kuantum (n, l, ml, ms) = (1, 0, 0, +1/2).
Elektron kedua memiliki bilangan kuantum (n, l, ml, ms) = (1, 0, 0, -1/2).
Tidak mungkin bagi kedua elektron untuk memiliki bilangan kuantum yang sama, karena ini akan melanggar prinsip pengecualian Pauli.
Jenis-Jenis Soal Pauli
Soal Pauli merupakan jenis soal yang menguji pemahaman siswa tentang prinsip Pauli, sebuah konsep penting dalam mekanika kuantum yang menyatakan bahwa tidak ada dua elektron dalam suatu atom yang dapat memiliki keempat bilangan kuantum yang sama. Soal Pauli dapat bervariasi dalam bentuk dan tingkat kesulitan, dan biasanya melibatkan pemahaman tentang struktur atom, konfigurasi elektron, dan sifat-sifat atom dan molekul.
Jenis-Jenis Soal Pauli
Berikut adalah beberapa jenis soal Pauli yang umum ditemukan, beserta contoh dan rumus yang digunakan:
| Jenis Soal | Contoh Soal | Rumus yang Digunakan |
|---|---|---|
| Konfigurasi Elektron | Tentukan konfigurasi elektron atom oksigen (O) dengan nomor atom 8. | Tidak ada rumus khusus, tetapi melibatkan pemahaman tentang aturan Aufbau, aturan Hund, dan prinsip Pauli. |
| Bilangan Kuantum | Tentukan keempat bilangan kuantum (n, l, ml, ms) untuk elektron terakhir dalam atom nitrogen (N) dengan nomor atom 7. | Tidak ada rumus khusus, tetapi melibatkan pemahaman tentang definisi dan aturan bilangan kuantum. |
| Sifat Atom | Jelaskan mengapa atom helium (He) bersifat inert atau stabil. | Tidak ada rumus khusus, tetapi melibatkan pemahaman tentang prinsip Pauli dan konfigurasi elektron. |
| Ikatan Kimia | Tentukan jenis ikatan yang terbentuk antara atom hidrogen (H) dan atom klorin (Cl) dalam molekul HCl. | Tidak ada rumus khusus, tetapi melibatkan pemahaman tentang prinsip Pauli dan konfigurasi elektron untuk menjelaskan pembentukan ikatan. |
| Spektroskopi | Jelaskan bagaimana prinsip Pauli berperan dalam spektrum emisi atom. | Tidak ada rumus khusus, tetapi melibatkan pemahaman tentang transisi elektron dan prinsip Pauli. |
Perbedaan Soal Pauli tentang Atom, Molekul, dan Inti Atom
Soal Pauli dapat fokus pada berbagai tingkatan struktur materi, termasuk atom, molekul, dan inti atom. Berikut adalah perbedaan utama dalam jenis soal Pauli:
- Soal Pauli tentang atom biasanya berfokus pada konfigurasi elektron, bilangan kuantum, dan sifat-sifat atom seperti energi ionisasi, afinitas elektron, dan jari-jari atom. Soal ini melibatkan pemahaman tentang bagaimana prinsip Pauli mempengaruhi struktur dan perilaku atom.
- Soal Pauli tentang molekul berfokus pada bagaimana prinsip Pauli mempengaruhi pembentukan ikatan kimia dan sifat-sifat molekul, seperti geometri molekul, polaritas, dan titik didih. Soal ini melibatkan pemahaman tentang bagaimana elektron dalam atom berinteraksi untuk membentuk ikatan kimia.
- Soal Pauli tentang inti atom berfokus pada bagaimana prinsip Pauli mempengaruhi struktur dan sifat inti atom, seperti stabilitas nuklir dan peluruhan radioaktif. Soal ini melibatkan pemahaman tentang bagaimana proton dan neutron dalam inti atom diatur dan berinteraksi.
Contoh Soal Pauli tentang Spin Elektron
Berikut adalah contoh soal Pauli yang berkaitan dengan spin elektron:
Tentukan keempat bilangan kuantum (n, l, ml, ms) untuk dua elektron terakhir dalam atom karbon (C) dengan nomor atom 6.
Solusi langkah demi langkah:
- Tentukan konfigurasi elektron atom karbon: Konfigurasi elektron atom karbon adalah 1s22s22p2.
- Tentukan bilangan kuantum untuk dua elektron terakhir: Kedua elektron terakhir berada pada subkulit 2p.
- Bilangan kuantum utama (n) untuk elektron terakhir adalah 2.
- Bilangan kuantum momentum sudut (l) untuk subkulit 2p adalah 1.
- Bilangan kuantum magnetik (ml) untuk elektron terakhir dapat memiliki nilai -1, 0, atau +1. Karena terdapat dua elektron terakhir, kita dapat menetapkan ml = -1 dan ml = 0.
- Bilangan kuantum spin (ms) untuk elektron terakhir dapat memiliki nilai +1/2 atau -1/2. Karena prinsip Pauli menyatakan bahwa tidak ada dua elektron yang dapat memiliki keempat bilangan kuantum yang sama, maka kita harus menetapkan ms = +1/2 untuk satu elektron terakhir dan ms = -1/2 untuk elektron terakhir lainnya.
- Tuliskan keempat bilangan kuantum untuk dua elektron terakhir:
- Elektron terakhir pertama: n = 2, l = 1, ml = -1, ms = +1/2
- Elektron terakhir kedua: n = 2, l = 1, ml = 0, ms = -1/2
Langkah-Langkah Menyelesaikan Soal Pauli
Prinsip Pauli merupakan salah satu prinsip dasar dalam kimia kuantum yang menjelaskan perilaku elektron dalam atom. Prinsip ini menyatakan bahwa tidak ada dua elektron dalam sebuah atom yang dapat memiliki keempat bilangan kuantum yang sama. Untuk menyelesaikan soal Pauli, diperlukan pemahaman yang baik tentang konsep bilangan kuantum dan bagaimana mereka berhubungan dengan konfigurasi elektron dalam atom.
Langkah-Langkah Sistematis
Untuk menyelesaikan soal Pauli secara sistematis, berikut langkah-langkah yang dapat Anda ikuti:
- Tentukan konfigurasi elektron atom: Langkah pertama adalah menentukan konfigurasi elektron atom yang dimaksud dalam soal. Anda dapat menggunakan diagram orbital atau aturan Aufbau untuk menentukan konfigurasi elektron.
- Tentukan bilangan kuantum untuk setiap elektron: Setelah mengetahui konfigurasi elektron, Anda perlu menentukan bilangan kuantum untuk setiap elektron dalam atom. Bilangan kuantum yang perlu ditentukan adalah:
- Bilangan kuantum utama (n): Menunjukkan tingkat energi elektron.
- Bilangan kuantum momentum sudut (l): Menunjukkan bentuk orbital elektron.
- Bilangan kuantum magnetik (ml): Menunjukkan orientasi orbital elektron dalam ruang.
- Bilangan kuantum spin (ms): Menunjukkan arah spin elektron.
- Pastikan tidak ada dua elektron yang memiliki keempat bilangan kuantum yang sama: Setelah menentukan bilangan kuantum untuk setiap elektron, pastikan tidak ada dua elektron yang memiliki keempat bilangan kuantum yang sama. Jika ada, maka soal Pauli tidak terpenuhi.
Contoh Soal Pauli
Sebagai contoh, mari kita selesaikan soal Pauli untuk atom nitrogen (N) yang memiliki nomor atom 7.
- Konfigurasi elektron nitrogen: Konfigurasi elektron nitrogen adalah 1s22s22p3.
- Bilangan kuantum elektron nitrogen: Berikut adalah bilangan kuantum untuk setiap elektron dalam nitrogen:
Elektron n l ml ms 1s1 1 0 0 +1/2 1s2 1 0 0 -1/2 2s1 2 0 0 +1/2 2s2 2 0 0 -1/2 2p1 2 1 -1 +1/2 2p2 2 1 0 +1/2 2p3 2 1 1 +1/2 - Verifikasi Prinsip Pauli: Perhatikan bahwa tidak ada dua elektron yang memiliki keempat bilangan kuantum yang sama. Jadi, prinsip Pauli terpenuhi untuk atom nitrogen.
Contoh Soal Pauli dan Pembahasan
Prinsip Pauli, yang dirumuskan oleh fisikawan Austria Wolfgang Pauli pada tahun 1925, merupakan salah satu prinsip dasar dalam mekanika kuantum. Prinsip ini menyatakan bahwa tidak mungkin dua elektron dalam sebuah atom memiliki keempat bilangan kuantum yang sama. Artinya, setiap elektron dalam sebuah atom harus memiliki kombinasi unik dari bilangan kuantum. Prinsip ini membantu menjelaskan mengapa elektron dalam atom terdistribusi dalam kulit dan subkulit tertentu.
Contoh Soal Pauli Tingkat Dasar
Untuk memahami prinsip Pauli, mari kita lihat beberapa contoh soal dan pembahasannya.
- Tentukan bilangan kuantum keempat untuk elektron dalam atom hidrogen yang memiliki bilangan kuantum utama n = 1, bilangan kuantum azimuthal l = 0, dan bilangan kuantum magnetik ml = 0.
Pembahasan:
- Bilangan kuantum utama (n) menentukan tingkat energi elektron, yang dalam hal ini adalah 1.
- Bilangan kuantum azimuthal (l) menentukan bentuk orbital elektron, yang dalam hal ini adalah 0, yang berarti orbital s.
- Bilangan kuantum magnetik (ml) menentukan orientasi orbital dalam ruang, yang dalam hal ini adalah 0, yang berarti orbital s hanya memiliki satu orientasi.
- Bilangan kuantum spin (ms) menentukan arah spin elektron, yang dapat berupa +1/2 atau -1/2. Karena kita sudah memiliki bilangan kuantum n, l, dan ml, maka bilangan kuantum spin ms dapat berupa +1/2 atau -1/2.
Contoh Soal Pauli Tingkat Menengah
Berikut adalah contoh soal tingkat menengah yang mengilustrasikan prinsip Pauli dalam konteks konfigurasi elektron.
- Tulis konfigurasi elektron untuk atom nitrogen (N) dan jelaskan bagaimana prinsip Pauli diterapkan dalam konfigurasi ini.
Pembahasan:
- Nitrogen memiliki 7 elektron. Konfigurasi elektronnya adalah 1s22s22p3.
- Dalam kulit pertama (n = 1), terdapat 2 elektron yang menempati orbital 1s. Kedua elektron ini memiliki bilangan kuantum n, l, dan ml yang sama, tetapi bilangan kuantum spinnya berbeda (satu +1/2 dan satu -1/2). Ini sesuai dengan prinsip Pauli.
- Dalam kulit kedua (n = 2), terdapat 5 elektron. Dua elektron menempati orbital 2s (n = 2, l = 0, ml = 0, ms = +1/2 dan -1/2). Tiga elektron lainnya menempati orbital 2p (n = 2, l = 1). Orbital 2p memiliki tiga sub-orbital (ml = -1, 0, +1). Masing-masing sub-orbital 2p dapat menampung maksimal dua elektron dengan spin yang berlawanan. Jadi, ketiga elektron 2p memiliki bilangan kuantum n, l, dan ml yang berbeda, tetapi bilangan kuantum spinnya berbeda.
Contoh Soal Pauli Tingkat Lanjut
Contoh soal tingkat lanjut dapat melibatkan aplikasi prinsip Pauli dalam berbagai situasi seperti pembentukan ikatan kimia atau sifat magnetik suatu atom.
- Jelaskan mengapa atom helium (He) bersifat inert secara kimia. Gunakan prinsip Pauli dalam penjelasan Anda.
Pembahasan:
- Helium memiliki 2 elektron. Konfigurasi elektronnya adalah 1s2.
- Kedua elektron dalam helium menempati orbital 1s. Karena orbital 1s hanya dapat menampung dua elektron dengan spin yang berlawanan, maka kulit pertama helium terisi penuh.
- Karena kulit pertama helium terisi penuh, maka tidak ada elektron yang tersedia untuk berpartisipasi dalam pembentukan ikatan kimia. Oleh karena itu, helium bersifat inert secara kimia.
Penerapan Soal Pauli dalam Kehidupan Sehari-hari: Contoh Soal Pauli
Konsep Soal Pauli, yang menyatakan bahwa dua elektron tidak dapat memiliki bilangan kuantum yang sama dalam suatu atom, mungkin terdengar abstrak, namun ternyata memiliki implikasi yang luas dalam kehidupan sehari-hari. Prinsip ini berperan penting dalam memahami perilaku materi dan interaksi antar partikel, yang pada gilirannya menjadi dasar dari berbagai teknologi modern yang kita gunakan setiap hari.
Peran Soal Pauli dalam Teknologi Modern
Salah satu contoh konkret bagaimana Soal Pauli diterapkan dalam teknologi adalah dalam pembuatan laser. Laser memanfaatkan emisi terstimulasi, di mana atom-atom tereksitasi dipancarkan kembali ke keadaan dasar dengan memancarkan foton. Soal Pauli memainkan peran penting di sini karena memastikan bahwa hanya satu elektron per atom yang dapat berada dalam keadaan tereksitasi pada satu waktu. Ini menyebabkan emisi foton yang koheren, yang merupakan ciri khas dari cahaya laser.
Soal Pauli juga memiliki peran penting dalam pengembangan semikonduktor. Semikonduktor adalah material yang memiliki konduktivitas listrik antara konduktor dan isolator. Sifat konduktivitas ini dipengaruhi oleh keberadaan elektron dalam pita konduksi. Soal Pauli membantu menjelaskan mengapa elektron dapat bergerak bebas dalam pita konduksi dan bagaimana sifat semikonduktor dapat diubah dengan doping, yaitu penambahan atom-atom lain yang mengubah jumlah elektron dalam pita konduksi.
Soal Pauli dalam Bidang Kedokteran
Dalam bidang kedokteran, Soal Pauli memiliki implikasi penting dalam pengembangan teknik pencitraan medis seperti Magnetic Resonance Imaging (MRI). MRI memanfaatkan sifat spin nuklir dari atom-atom hidrogen dalam tubuh. Soal Pauli membantu menjelaskan bagaimana spin nuklir dapat diorientasikan dalam medan magnet dan bagaimana sinyal resonansi dapat digunakan untuk menghasilkan gambar organ tubuh.
- Teknik pencitraan MRI bergantung pada sifat spin nuklir dari atom hidrogen, yang diatur oleh Soal Pauli.
- Soal Pauli memastikan bahwa hanya satu elektron per atom yang dapat memiliki spin tertentu, yang memungkinkan deteksi sinyal resonansi dan pembentukan gambar detail.
Memahami Sifat Materi dan Interaksi Antar Partikel
Pemahaman tentang Soal Pauli sangat penting dalam memahami sifat materi dan interaksi antar partikel. Prinsip ini membantu menjelaskan mengapa atom-atom memiliki struktur elektronik tertentu, bagaimana atom-atom berikatan membentuk molekul, dan bagaimana materi berperilaku dalam berbagai kondisi.
Contohnya, Soal Pauli menjelaskan mengapa gas mulia memiliki sifat kimia yang sangat inert. Gas mulia memiliki konfigurasi elektron yang stabil, di mana semua elektron dalam kulit terluar memiliki bilangan kuantum yang berbeda. Ini membuat gas mulia sangat sulit untuk bereaksi dengan atom lain, karena elektron-elektron dalam kulit terluar tidak dapat menerima elektron tambahan.
Soal Pauli dan Konsep Spin Elektron
Soal Pauli, atau prinsip pengecualian Pauli, merupakan salah satu konsep dasar dalam mekanika kuantum yang menjelaskan bagaimana elektron-elektron dalam atom dapat menempati orbital-orbital yang tersedia. Prinsip ini erat kaitannya dengan konsep spin elektron, yaitu momen magnetik intrinsik yang dimiliki oleh elektron. Spin elektron, yang dianalogikan sebagai rotasi elektron pada porosnya sendiri, memiliki dua kemungkinan nilai, yaitu spin up (+1/2) dan spin down (-1/2).
Hubungan Soal Pauli dan Spin Elektron
Soal Pauli menyatakan bahwa tidak ada dua elektron dalam suatu atom yang dapat memiliki keempat bilangan kuantum yang sama. Keempat bilangan kuantum ini meliputi:
- Bilangan kuantum utama (n): Menentukan tingkat energi elektron.
- Bilangan kuantum azimuthal (l): Menentukan bentuk orbital elektron.
- Bilangan kuantum magnetik (ml): Menentukan orientasi orbital elektron dalam ruang.
- Bilangan kuantum spin (ms): Menentukan spin elektron, yaitu spin up (+1/2) atau spin down (-1/2).
Jadi, menurut soal Pauli, meskipun tiga bilangan kuantum pertama (n, l, ml) sama, bilangan kuantum spin (ms) harus berbeda. Ini berarti bahwa dalam satu orbital, yang dapat menampung maksimal dua elektron, kedua elektron tersebut harus memiliki spin yang berlawanan. Fenomena ini disebut dengan istilah “spin pairing”.
Contoh Soal Pauli dan Spin Elektron
Misalnya, perhatikan atom nitrogen (N) yang memiliki nomor atom 7. Konfigurasi elektronnya adalah 1s22s22p3. Mari kita lihat orbital 2p yang memiliki tiga elektron. Tiga elektron tersebut akan menempati tiga orbital 2p yang berbeda, dengan satu elektron di setiap orbital. Karena setiap orbital dapat menampung maksimal dua elektron, maka ketiga elektron tersebut akan memiliki spin yang berbeda-beda. Misalnya, satu elektron memiliki spin up (+1/2), satu lagi spin down (-1/2), dan satu lagi spin up (+1/2).
Pengaruh Spin Elektron terhadap Sifat Kimia dan Fisika Atom
Spin elektron memiliki pengaruh yang signifikan terhadap sifat kimia dan fisika suatu atom. Beberapa contohnya:
- Ikatan Kimia: Spin elektron menentukan bagaimana atom-atom berikatan satu sama lain. Spin pairing merupakan dasar dari ikatan kovalen, di mana dua elektron dengan spin yang berlawanan membentuk ikatan kimia.
- Spektroskopi: Spin elektron juga berperan dalam spektroskopi, khususnya dalam spektroskopi resonansi magnetik nuklir (NMR) dan spektroskopi resonansi spin elektron (ESR).
- Magnetisme: Spin elektron adalah penyebab utama magnetisme. Atom-atom dengan elektron yang tidak berpasangan memiliki momen magnetik bersih, yang menyebabkan sifat magnetik material.
Soal Pauli dan Konsep Orbital Atom
Soal Pauli adalah salah satu prinsip dasar dalam kimia kuantum yang menjelaskan bagaimana elektron menempati orbital atom. Prinsip ini sangat penting dalam memahami struktur atom, sifat kimia, dan ikatan kimia. Dalam konteks ini, kita akan menjelajahi hubungan erat antara soal Pauli dan konsep orbital atom, serta bagaimana orbital atom berperan dalam menentukan sifat kimia suatu atom.
Hubungan Soal Pauli dan Orbital Atom
Soal Pauli menyatakan bahwa tidak mungkin dua elektron dalam suatu atom memiliki keempat bilangan kuantum yang sama. Artinya, setiap orbital atom hanya dapat menampung maksimal dua elektron, dan kedua elektron tersebut harus memiliki spin yang berlawanan. Konsep orbital atom sendiri mengacu pada daerah di sekitar inti atom tempat elektron memiliki kemungkinan terbesar untuk ditemukan.
Secara sederhana, soal Pauli membantu kita memahami bagaimana elektron-elektron terdistribusi dalam atom. Dengan membatasi jumlah elektron dalam setiap orbital, soal Pauli memastikan bahwa elektron-elektron dalam suatu atom terorganisir dengan baik, menghindari tumpang tindih, dan menciptakan konfigurasi elektron yang stabil.
Contoh Soal Pauli yang Melibatkan Orbital Atom
Sebagai contoh, mari kita perhatikan atom nitrogen (N) yang memiliki nomor atom 7. Konfigurasi elektron nitrogen adalah 1s22s22p3. Berikut langkah-langkah untuk menentukan konfigurasi elektron nitrogen dengan menggunakan soal Pauli:
- Tentukan jumlah elektron dalam atom nitrogen (7 elektron).
- Isi orbital atom dengan elektron, mulai dari orbital yang memiliki energi terendah.
- Ingat bahwa setiap orbital hanya dapat menampung maksimal dua elektron dengan spin yang berlawanan.
- Orbital 1s diisi dengan 2 elektron, orbital 2s diisi dengan 2 elektron, dan orbital 2p diisi dengan 3 elektron.
- Karena orbital 2p memiliki tiga orbital (2px, 2py, 2pz), maka setiap orbital ini akan diisi dengan 1 elektron terlebih dahulu sebelum diisi dengan 2 elektron.
- Hasilnya, konfigurasi elektron nitrogen adalah 1s22s22p3.
Dengan memahami soal Pauli dan konsep orbital atom, kita dapat memprediksi dan menjelaskan sifat kimia suatu atom, seperti reaktivitas, titik leleh, dan titik didih.
Peran Orbital Atom dalam Menentukan Sifat Kimia Suatu Atom
Orbital atom berperan penting dalam menentukan sifat kimia suatu atom karena mereka menentukan bagaimana elektron-elektron terdistribusi dalam atom. Distribusi elektron ini, pada gilirannya, menentukan bagaimana atom berinteraksi dengan atom lain untuk membentuk ikatan kimia. Berikut adalah beberapa contoh bagaimana orbital atom berperan dalam menentukan sifat kimia suatu atom:
- Reaktvitas: Atom dengan elektron valensi (elektron di kulit terluar) yang belum terisi penuh cenderung lebih reaktif karena mereka lebih mudah berikatan dengan atom lain untuk mencapai konfigurasi elektron stabil. Orbital atom yang belum terisi penuh ini dapat menerima elektron dari atom lain atau menyumbangkan elektron ke atom lain.
- Titik Leleh dan Titik Didih: Titik leleh dan titik didih suatu zat ditentukan oleh kekuatan ikatan antar atom atau molekul. Ikatan yang lebih kuat membutuhkan lebih banyak energi untuk diputus, sehingga titik leleh dan titik didih akan lebih tinggi. Orbital atom berperan dalam menentukan kekuatan ikatan ini karena mereka menentukan bagaimana atom berinteraksi satu sama lain.
- Bentuk Molekul: Orbital atom juga berperan dalam menentukan bentuk molekul. Bentuk molekul ditentukan oleh bagaimana orbital atom dari atom-atom yang membentuk molekul tersebut saling tumpang tindih.
Soal Pauli dan Konsep Konfigurasi Elektron
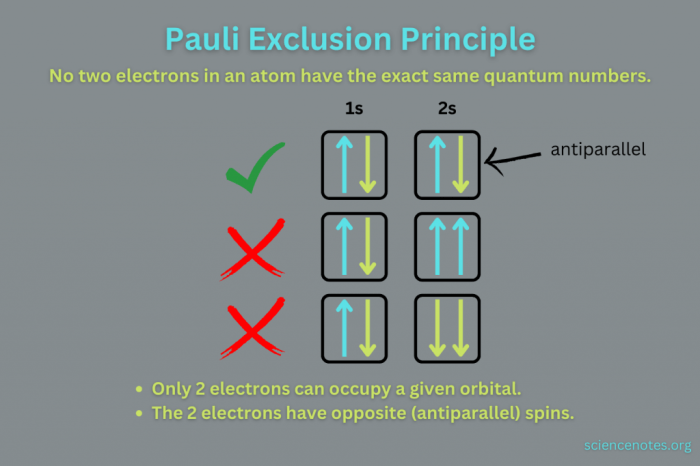
Soal Pauli merupakan prinsip yang penting dalam memahami susunan elektron dalam atom. Prinsip ini menjelaskan bahwa dalam suatu atom, tidak mungkin terdapat dua elektron yang memiliki keempat bilangan kuantum yang sama. Prinsip ini erat kaitannya dengan konsep konfigurasi elektron, yang menggambarkan bagaimana elektron-elektron terdistribusi dalam berbagai tingkat energi dan sub-tingkat energi dalam suatu atom.
Hubungan Soal Pauli dan Konfigurasi Elektron
Soal Pauli merupakan dasar untuk memahami konfigurasi elektron. Prinsip ini membantu kita dalam menentukan bagaimana elektron-elektron ditempatkan dalam orbital-orbital atom. Setiap orbital dapat menampung maksimal dua elektron, dan kedua elektron tersebut harus memiliki spin yang berlawanan. Hal ini memastikan bahwa tidak ada dua elektron dalam suatu atom yang memiliki keempat bilangan kuantum yang sama.
Contoh Soal Pauli dan Konfigurasi Elektron
Sebagai contoh, perhatikan atom nitrogen (N) yang memiliki nomor atom 7. Konfigurasi elektronnya adalah 1s22s22p3. Berikut adalah langkah-langkah untuk menentukan konfigurasi elektron nitrogen berdasarkan Soal Pauli:
- Tentukan jumlah elektron dalam atom nitrogen. Atom nitrogen memiliki 7 elektron.
- Isi orbital-orbital dengan elektron sesuai urutan tingkat energi. Orbital 1s diisi dengan 2 elektron, kemudian orbital 2s diisi dengan 2 elektron, dan akhirnya orbital 2p diisi dengan 3 elektron.
- Terapkan Soal Pauli. Setiap orbital hanya dapat menampung maksimal dua elektron, dan kedua elektron tersebut harus memiliki spin yang berlawanan. Dalam orbital 2p, terdapat tiga orbital yang masing-masing diisi dengan satu elektron, dan masing-masing elektron memiliki spin yang berlawanan.
Konfigurasi elektron ini menunjukkan bahwa elektron-elektron dalam atom nitrogen terdistribusi dalam berbagai tingkat energi dan sub-tingkat energi, sesuai dengan Soal Pauli. Dengan menggunakan prinsip ini, kita dapat memahami bagaimana elektron-elektron terdistribusi dalam berbagai orbital atom.
Peran Konfigurasi Elektron dalam Memahami Sifat Kimia dan Fisika Suatu Atom, Contoh soal pauli
Konfigurasi elektron memiliki peran penting dalam memahami sifat kimia dan fisika suatu atom. Beberapa contohnya adalah:
- Keelektronegatifan: Konfigurasi elektron dapat membantu kita memprediksi keelektronegatifan suatu atom, yaitu kemampuan suatu atom untuk menarik elektron dalam ikatan kimia. Atom dengan konfigurasi elektron yang memiliki elektron valensi yang lebih banyak cenderung lebih elektronegatif.
- Sifat Kimia: Konfigurasi elektron juga dapat membantu kita memahami sifat kimia suatu atom, seperti kemampuannya untuk membentuk ikatan kimia. Atom dengan elektron valensi yang tidak lengkap cenderung lebih reaktif dan mudah membentuk ikatan kimia.
- Spektrum Atom: Konfigurasi elektron juga berperan dalam menentukan spektrum atom, yaitu pola cahaya yang dipancarkan oleh atom ketika elektron-elektronnya berpindah antar tingkat energi. Spektrum atom ini dapat digunakan untuk mengidentifikasi jenis atom yang ada.
Soal Pauli dan Konsep Ikatan Kimia
Prinsip Pauli, yang menyatakan bahwa dua elektron dalam satu atom tidak dapat memiliki keempat bilangan kuantum yang sama, merupakan prinsip dasar dalam kimia. Prinsip ini memiliki implikasi yang mendalam pada pembentukan ikatan kimia dan sifat molekul.
Hubungan Soal Pauli dan Ikatan Kimia
Soal Pauli berhubungan erat dengan konsep ikatan kimia karena prinsip Pauli menentukan bagaimana elektron-elektron dalam atom berinteraksi dan membentuk ikatan dengan atom lain. Prinsip ini menjelaskan mengapa atom-atom tertentu membentuk ikatan tertentu dan mengapa molekul memiliki struktur dan sifat tertentu.
Contoh Soal Pauli dan Ikatan Kimia
Sebagai contoh, perhatikan pembentukan molekul hidrogen (H2). Atom hidrogen memiliki satu elektron dalam kulit terluarnya. Ketika dua atom hidrogen saling mendekat, elektron-elektronnya akan berinteraksi. Prinsip Pauli mengharuskan elektron-elektron ini memiliki spin yang berlawanan. Akibatnya, elektron-elektron tersebut akan membentuk ikatan kovalen, di mana mereka dibagikan antara kedua atom hidrogen. Ikatan kovalen ini menghasilkan molekul hidrogen yang stabil.
Berikut adalah contoh soal Pauli yang melibatkan ikatan kimia:
- Tentukan konfigurasi elektron atom nitrogen (N) dan oksigen (O). Jelaskan bagaimana prinsip Pauli memengaruhi pembentukan ikatan kovalen dalam molekul nitrogen dioksida (NO2).
- Jelaskan mengapa molekul metana (CH4) memiliki bentuk tetrahedral, dengan menggunakan prinsip Pauli dan teori ikatan valensi.
Peran Prinsip Pauli dalam Pembentukan Ikatan Kimia
Prinsip Pauli memainkan peran penting dalam pembentukan ikatan kimia dengan menentukan bagaimana elektron-elektron dalam atom berinteraksi. Prinsip ini menetapkan bahwa:
- Elektron-elektron dalam atom harus memiliki bilangan kuantum yang berbeda, termasuk spin. Ini berarti bahwa hanya dua elektron yang dapat menempati orbital atom yang sama, dan mereka harus memiliki spin yang berlawanan.
- Elektron-elektron dalam orbital yang sama cenderung saling tolak menolak, karena mereka memiliki muatan yang sama. Tolakan ini dapat memengaruhi bentuk molekul dan sifat-sifatnya.
- Elektron-elektron dalam orbital yang berbeda dapat berinteraksi untuk membentuk ikatan kimia, seperti ikatan kovalen atau ikatan ionik. Jenis ikatan yang terbentuk tergantung pada perbedaan elektronegativitas antara atom-atom yang terlibat.
Pengaruh Prinsip Pauli pada Sifat Molekul
Prinsip Pauli memengaruhi sifat molekul dengan menentukan:
- Bentuk molekul: Prinsip Pauli menentukan bagaimana elektron-elektron dalam atom berinteraksi, yang pada gilirannya memengaruhi bentuk molekul. Misalnya, molekul metana (CH4) memiliki bentuk tetrahedral karena keempat ikatan C-H dibentuk oleh elektron-elektron dalam orbital hibrida sp3.
- Sifat kimia: Prinsip Pauli memengaruhi sifat kimia molekul dengan menentukan bagaimana elektron-elektron dalam atom berinteraksi dengan atom lain. Misalnya, molekul air (H2O) bersifat polar karena ikatan O-H bersifat polar, yang disebabkan oleh perbedaan elektronegativitas antara oksigen dan hidrogen.
- Kestabilan molekul: Prinsip Pauli membantu menjelaskan mengapa beberapa molekul lebih stabil daripada yang lain. Molekul yang memiliki elektron-elektron yang terisi penuh dalam orbitalnya cenderung lebih stabil daripada molekul yang memiliki elektron-elektron yang tidak terisi penuh.
Akhir Kata
Memahami soal Pauli adalah kunci untuk memahami dunia kuantum dan bagaimana dunia kita bekerja. Prinsip ini, meskipun abstrak, memiliki aplikasi praktis yang luas dalam berbagai bidang ilmu pengetahuan dan teknologi. Dengan mempelajari soal Pauli, kita dapat lebih memahami perilaku atom, molekul, dan materi pada tingkat fundamental, yang membuka jalan untuk penemuan dan inovasi baru di masa depan.





