Pernahkah Anda bertanya-tanya mengapa es krim lebih cepat mencair di cuaca panas dibandingkan di cuaca dingin? Fenomena ini terkait dengan penurunan titik beku, sebuah konsep penting dalam kimia yang menjelaskan perubahan titik beku suatu pelarut akibat penambahan zat terlarut. Penurunan titik beku merupakan salah satu sifat koligatif larutan, yang bergantung pada jumlah partikel zat terlarut, bukan jenisnya. Dalam artikel ini, kita akan menjelajahi contoh soal penurunan titik beku dan membahas bagaimana konsep ini diterapkan dalam berbagai bidang kehidupan.
Penurunan titik beku terjadi karena adanya interaksi antara molekul pelarut dan zat terlarut. Ketika zat terlarut ditambahkan ke dalam pelarut, molekul zat terlarut akan menghalangi proses pembekuan pelarut, sehingga diperlukan suhu yang lebih rendah untuk membekukan larutan tersebut. Penurunan titik beku dapat dihitung menggunakan rumus yang melibatkan konsentrasi zat terlarut dan sifat khas pelarut. Rumus ini memungkinkan kita untuk menghitung penurunan titik beku larutan dan menentukan massa molekul relatif (Mr) zat terlarut.
Pengertian Penurunan Titik Beku: Contoh Soal Penurunan Titik Beku
Penurunan titik beku merupakan salah satu sifat koligatif larutan. Sifat koligatif larutan adalah sifat larutan yang hanya bergantung pada jumlah partikel zat terlarut dan tidak bergantung pada jenis zat terlarutnya. Penurunan titik beku adalah penurunan titik beku pelarut murni ketika zat terlarut ditambahkan ke dalamnya.
Contoh Penurunan Titik Beku dalam Kehidupan Sehari-hari
Contoh penurunan titik beku dalam kehidupan sehari-hari adalah penggunaan garam untuk mencairkan es di jalanan pada musim dingin. Garam yang ditaburkan pada es akan larut dalam air yang mencair, membentuk larutan garam. Larutan garam memiliki titik beku yang lebih rendah daripada air murni, sehingga es akan mencair pada suhu yang lebih rendah. Hal ini membuat jalanan menjadi lebih aman untuk dilalui.
Faktor-faktor yang Mempengaruhi Penurunan Titik Beku
Ada beberapa faktor yang dapat mempengaruhi penurunan titik beku suatu larutan, yaitu:
- Jenis zat terlarut: Zat terlarut yang bersifat elektrolit akan menyebabkan penurunan titik beku yang lebih besar dibandingkan dengan zat terlarut yang bersifat nonelektrolit. Hal ini karena zat terlarut elektrolit akan terionisasi menjadi ion-ion dalam larutan, sehingga jumlah partikel zat terlarut dalam larutan akan lebih banyak.
- Konsentrasi zat terlarut: Semakin tinggi konsentrasi zat terlarut, semakin besar penurunan titik bekunya. Hal ini karena semakin banyak partikel zat terlarut yang ada dalam larutan, semakin besar pengaruhnya terhadap titik beku pelarut.
- Sifat pelarut: Sifat pelarut juga dapat mempengaruhi penurunan titik beku. Pelarut dengan titik beku yang lebih tinggi akan memiliki penurunan titik beku yang lebih besar dibandingkan dengan pelarut dengan titik beku yang lebih rendah.
Rumus Penurunan Titik Beku
Penurunan titik beku merupakan salah satu sifat koligatif larutan, yaitu sifat yang bergantung pada jumlah partikel zat terlarut dalam larutan, bukan jenis zat terlarutnya. Penurunan titik beku terjadi ketika zat terlarut ditambahkan ke dalam pelarut murni, sehingga titik beku larutan menjadi lebih rendah dibandingkan dengan titik beku pelarut murni.
Rumus Penurunan Titik Beku Larutan
Penurunan titik beku larutan dapat dihitung menggunakan rumus berikut:
ΔTf = Kf x m x i
Keterangan:
- ΔTf = Penurunan titik beku larutan (dalam °C)
- Kf = Konstanta penurunan titik beku molal pelarut (dalam °C/m)
- m = Molalitas larutan (dalam mol/kg)
- i = Faktor van’t Hoff, menunjukkan jumlah ion yang dihasilkan ketika satu molekul zat terlarut terlarut dalam pelarut
Contoh Perhitungan Penurunan Titik Beku Larutan
Misalnya, kita ingin menghitung penurunan titik beku larutan glukosa (C6H12O6) 0,5 molal dalam air. Konstanta penurunan titik beku molal air adalah 1,86 °C/m. Glukosa merupakan zat non-elektrolit, sehingga faktor van’t Hoff (i) = 1.
Maka, penurunan titik beku larutan glukosa tersebut dapat dihitung sebagai berikut:
ΔTf = Kf x m x i = 1,86 °C/m x 0,5 mol/kg x 1 = 0,93 °C
Artinya, titik beku larutan glukosa 0,5 molal dalam air akan turun sebesar 0,93 °C dibandingkan dengan titik beku air murni (0 °C). Jadi, titik beku larutan glukosa tersebut adalah -0,93 °C.
Sifat Koligatif Penurunan Titik Beku
Penurunan titik beku merupakan salah satu sifat koligatif larutan. Sifat koligatif sendiri merupakan sifat larutan yang hanya bergantung pada jumlah partikel zat terlarut dalam larutan, dan tidak bergantung pada jenis zat terlarutnya. Pada penurunan titik beku, titik beku larutan akan lebih rendah daripada titik beku pelarut murninya.
Penurunan Titik Beku
Penurunan titik beku merupakan fenomena di mana titik beku suatu pelarut mengalami penurunan ketika zat terlarut ditambahkan ke dalamnya. Penurunan titik beku ini sebanding dengan konsentrasi zat terlarut dalam larutan. Semakin tinggi konsentrasi zat terlarut, semakin besar penurunan titik bekunya.
Contoh Penerapan Penurunan Titik Beku dalam Kehidupan Sehari-hari
Penurunan titik beku memiliki berbagai aplikasi dalam kehidupan sehari-hari. Berikut adalah beberapa contohnya:
- Penambahan garam pada es untuk membuat es krim: Garam yang ditambahkan ke dalam es akan menurunkan titik beku es, sehingga es akan meleleh pada suhu yang lebih rendah. Hal ini akan membantu proses pembuatan es krim menjadi lebih cepat dan efisien.
- Penggunaan antibeku pada radiator mobil: Antibeku adalah zat yang ditambahkan ke dalam air radiator untuk mencegah air membeku pada suhu rendah. Antibeku akan menurunkan titik beku air, sehingga air radiator tidak akan membeku meskipun suhu lingkungan sangat dingin.
- Penambahan garam pada jalanan saat musim dingin: Garam yang ditambahkan ke jalanan akan menurunkan titik beku air, sehingga es dan salju akan mencair lebih cepat dan jalanan akan lebih mudah dilalui.
Penentuan Massa Molekul Relatif (Mr) Zat Terlarut
Penurunan titik beku dapat digunakan untuk menentukan massa molekul relatif (Mr) zat terlarut. Hal ini karena penurunan titik beku sebanding dengan molalitas zat terlarut. Molalitas sendiri didefinisikan sebagai jumlah mol zat terlarut per kilogram pelarut. Dengan mengetahui penurunan titik beku, massa zat terlarut, dan massa pelarut, kita dapat menghitung molalitas larutan. Selanjutnya, kita dapat menghitung massa molekul relatif (Mr) zat terlarut dengan menggunakan rumus berikut:
Mr = (massa zat terlarut x Kf) / (ΔTf x massa pelarut)
Keterangan:
- Mr = Massa molekul relatif zat terlarut
- Kf = Konstanta penurunan titik beku pelarut
- ΔTf = Penurunan titik beku
- Massa zat terlarut = Massa zat terlarut dalam gram
- Massa pelarut = Massa pelarut dalam kilogram
Contoh Soal Penurunan Titik Beku
Penurunan titik beku merupakan salah satu sifat koligatif larutan yang menunjukkan penurunan titik beku pelarut murni akibat adanya zat terlarut. Sifat ini dapat digunakan untuk menentukan massa molekul relatif (Mr) zat terlarut, menganalisis kemurnian zat, dan bahkan memahami beberapa fenomena alam. Berikut beberapa contoh soal yang akan membantu kamu memahami konsep penurunan titik beku dan penerapannya.
Contoh Soal Penurunan Titik Beku
Berikut ini adalah contoh soal penurunan titik beku yang mencakup berbagai aspek, mulai dari perhitungan penurunan titik beku hingga penerapannya dalam kehidupan sehari-hari.
| Nomor Soal | Soal | Jawaban | Pembahasan |
|---|---|---|---|
| 1 | Suatu larutan dibuat dengan melarutkan 18 gram glukosa (C6H12O6) dalam 250 gram air. Jika Kf air = 1,86 oC/m, hitunglah penurunan titik beku larutan tersebut! | ΔTf = 0,744 oC |
Langkah pertama adalah menghitung molalitas larutan glukosa. Molalitas didefinisikan sebagai jumlah mol zat terlarut per kilogram pelarut.
Massa glukosa = 18 gram Mr glukosa = 180 gram/mol Massa air = 250 gram = 0,25 kg Maka, molalitas larutan glukosa adalah:
Selanjutnya, kita dapat menghitung penurunan titik beku menggunakan rumus:
Kf air = 1,86 oC/m Contoh soal penurunan titik beku biasanya melibatkan perhitungan perubahan suhu beku larutan dibandingkan dengan pelarut murni. Mirip dengan contoh soal penurunan titik beku, contoh soal tentang listrik statis juga seringkali menguji pemahaman tentang konsep dasar seperti muatan listrik, gaya Coulomb, dan induksi listrik. Kedua topik ini mungkin tampak berbeda, namun sama-sama menarik untuk dipelajari dan dipahami. m = 0,4 mol/kg Maka, penurunan titik beku larutan glukosa adalah:
|
| 2 | Sebuah larutan nonelektrolit dengan massa 10 gram dilarutkan dalam 200 gram air. Jika titik beku larutan tersebut adalah -0,372 oC dan Kf air = 1,86 oC/m, tentukan massa molekul relatif (Mr) zat terlarut tersebut! | Mr = 100 gram/mol |
Pertama, kita hitung molalitas larutan menggunakan rumus penurunan titik beku:
ΔTf = 0,372 oC Kf = 1,86 oC/m Maka, molalitas larutan adalah:
Selanjutnya, kita dapat menghitung massa molekul relatif (Mr) zat terlarut menggunakan rumus molalitas:
Massa zat terlarut = 10 gram Massa air = 200 gram = 0,2 kg m = 0,2 mol/kg Maka, Mr zat terlarut adalah:
|
| 3 | Pada musim dingin, jalanan seringkali disemprot dengan garam untuk mencegah pembentukan es. Jelaskan mengapa garam dapat menurunkan titik beku air dan bagaimana hal ini membantu mencegah pembentukan es! | Garam (NaCl) dapat menurunkan titik beku air karena sifat koligatif larutan. Ketika garam dilarutkan dalam air, ion-ion Na+ dan Cl– akan bercampur dengan molekul air. Hal ini menyebabkan penurunan titik beku air, sehingga air akan membeku pada suhu yang lebih rendah dari 0 oC. |
Penurunan titik beku air akibat penambahan garam merupakan contoh penerapan sifat koligatif larutan dalam kehidupan sehari-hari. Penambahan garam menyebabkan air membeku pada suhu yang lebih rendah, sehingga air tidak akan membeku pada suhu normal dan mencegah pembentukan es di jalanan. Hal ini membuat jalanan tetap aman untuk dilalui kendaraan dan pejalan kaki. |
| 4 | Jelaskan mengapa air laut membeku pada suhu yang lebih rendah dibandingkan dengan air tawar! | Air laut membeku pada suhu yang lebih rendah dibandingkan dengan air tawar karena adanya garam terlarut di dalamnya. Garam terlarut dalam air laut menyebabkan penurunan titik beku air, sehingga air laut membeku pada suhu yang lebih rendah dari 0 oC. |
Air laut mengandung berbagai macam garam terlarut, seperti NaCl, MgCl2, dan K2SO4. Keberadaan garam terlarut ini menyebabkan air laut memiliki titik beku yang lebih rendah dibandingkan dengan air tawar. Hal ini dapat diamati di daerah kutub, di mana air laut masih tetap cair meskipun suhu udara sudah berada di bawah titik beku air tawar. |
| 5 | Mengapa menambahkan gula ke dalam air dapat membuat es krim lebih cepat membeku? | Penambahan gula ke dalam air akan menurunkan titik beku air. Ketika air dengan gula ditambahkan ke dalam campuran es krim, titik bekunya akan lebih rendah daripada air murni. Hal ini memungkinkan es krim untuk membeku lebih cepat pada suhu yang lebih tinggi. |
Gula merupakan zat terlarut yang dapat menurunkan titik beku air. Penurunan titik beku ini memungkinkan campuran es krim untuk membeku lebih cepat pada suhu yang lebih tinggi. Ini karena titik beku campuran es krim akan lebih rendah dibandingkan dengan titik beku air murni. Dengan kata lain, es krim akan lebih mudah membeku dalam campuran air gula daripada dalam air murni. |
Aplikasi Penurunan Titik Beku
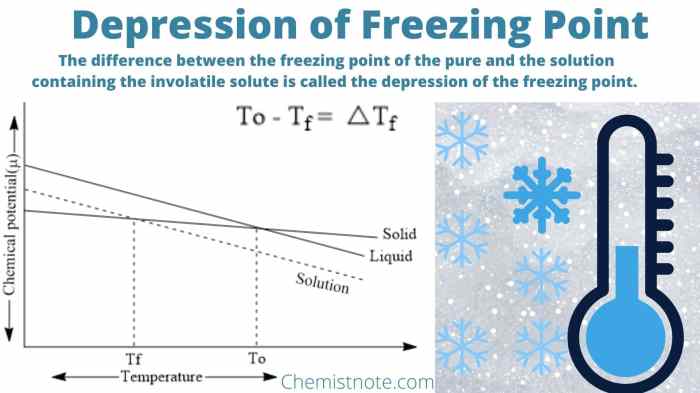
Penurunan titik beku merupakan fenomena fisika yang terjadi ketika zat terlarut ditambahkan ke dalam pelarut. Penurunan titik beku ini memiliki berbagai aplikasi penting dalam berbagai bidang, seperti industri makanan, industri kimia, dan bidang kesehatan.
Industri Makanan
Penurunan titik beku memiliki peran penting dalam industri makanan, terutama dalam pembuatan es krim dan makanan beku lainnya.
- Pembuatan Es Krim: Penurunan titik beku memungkinkan es krim tetap lembut dan mudah dimakan meskipun disimpan dalam suhu rendah. Garam yang ditambahkan ke dalam air es akan menurunkan titik beku air, sehingga es krim dapat dibekukan pada suhu yang lebih rendah tanpa menjadi terlalu keras.
- Makanan Beku: Penurunan titik beku juga digunakan untuk mengawetkan makanan. Penambahan garam atau gula ke dalam makanan dapat menurunkan titik beku, sehingga makanan dapat disimpan dalam suhu yang lebih rendah tanpa membeku.
Industri Kimia, Contoh soal penurunan titik beku
Penurunan titik beku juga digunakan dalam industri kimia untuk berbagai proses, seperti:
- Sintesis Kimia: Penurunan titik beku dapat digunakan untuk melarutkan zat yang sulit larut pada suhu normal. Penambahan zat terlarut dapat menurunkan titik beku pelarut, sehingga zat yang sulit larut dapat larut pada suhu yang lebih rendah.
- Pemisahan dan Pemurnian: Penurunan titik beku dapat digunakan untuk memisahkan dan memurnikan zat. Contohnya, proses kristalisasi fraksional memanfaatkan penurunan titik beku untuk memisahkan komponen-komponen dalam campuran.
Bidang Kesehatan
Penurunan titik beku memiliki beberapa aplikasi penting dalam bidang kesehatan, seperti:
- Antibeku: Penurunan titik beku digunakan dalam pembuatan antibeku untuk kendaraan. Antibeku membantu mencegah air dalam radiator kendaraan membeku pada suhu rendah, sehingga mesin kendaraan dapat bekerja dengan baik dalam cuaca dingin.
- Pembuatan Obat: Penurunan titik beku juga digunakan dalam pembuatan beberapa jenis obat, seperti obat-obatan cair yang membutuhkan penyimpanan pada suhu rendah.
Contoh Soal dan Pembahasan
Untuk memahami konsep penurunan titik beku dengan lebih baik, mari kita bahas beberapa contoh soal dan pembahasannya. Contoh soal ini akan membantu Anda memahami bagaimana penurunan titik beku dihitung dan bagaimana konsep ini diterapkan dalam kehidupan sehari-hari.
Contoh Soal Penurunan Titik Beku
Berikut adalah beberapa contoh soal penurunan titik beku yang dilengkapi dengan pembahasannya:
| Soal | Pembahasan |
|---|---|
| Sebuah larutan dibuat dengan melarutkan 10 gram glukosa (C6H12O6) dalam 100 gram air. Hitunglah penurunan titik beku larutan tersebut! (Kf air = 1,86 oC/m). |
|
| Suatu larutan dibuat dengan melarutkan 5 gram urea (CO(NH2)2) dalam 250 gram air. Jika titik beku larutan tersebut adalah -0,372 oC, tentukan titik beku air murni! (Kf air = 1,86 oC/m). |
|
Ilustrasi Penurunan Titik Beku
Penurunan titik beku merupakan salah satu sifat koligatif larutan. Sifat koligatif larutan merupakan sifat yang bergantung pada jumlah partikel zat terlarut dalam larutan, bukan pada jenis zat terlarutnya. Penurunan titik beku terjadi ketika zat terlarut ditambahkan ke dalam pelarut murni, menyebabkan titik beku larutan menjadi lebih rendah daripada titik beku pelarut murni.
Ilustrasi Penurunan Titik Beku
Ilustrasi penurunan titik beku dapat digambarkan dengan menggunakan contoh larutan gula dalam air. Air murni memiliki titik beku 0 derajat Celcius. Ketika gula ditambahkan ke dalam air, titik beku larutan akan turun menjadi di bawah 0 derajat Celcius. Penurunan titik beku ini sebanding dengan konsentrasi gula dalam larutan.
Berikut ilustrasi penurunan titik beku dengan gambar:
Gambar 1: Ilustrasi Penurunan Titik Beku
Gambar tersebut menunjukkan bahwa titik beku larutan gula dalam air lebih rendah daripada titik beku air murni. Hal ini disebabkan karena molekul gula menghalangi molekul air untuk membentuk ikatan hidrogen dan membentuk struktur kisi kristal es. Molekul gula yang lebih banyak akan menyebabkan penurunan titik beku yang lebih besar.
Keterangan gambar:
- Air murni: Titik beku 0 derajat Celcius
- Larutan gula dalam air: Titik beku di bawah 0 derajat Celcius
- Molekul gula: Menghalang molekul air untuk membentuk ikatan hidrogen
- Struktur kisi kristal es: Terbentuk pada titik beku air murni
Ilustrasi penurunan titik beku ini menunjukkan bahwa sifat koligatif larutan, seperti penurunan titik beku, merupakan fenomena yang terjadi karena interaksi antara zat terlarut dan pelarut.
Kesimpulan
Penurunan titik beku merupakan fenomena penting dalam kimia yang menunjukkan bahwa penambahan zat terlarut ke dalam pelarut murni akan menurunkan titik beku pelarut tersebut. Fenomena ini dapat dijelaskan dengan adanya interaksi antara molekul zat terlarut dan pelarut yang mengganggu pembentukan kristal padat pelarut.
Memahami konsep penurunan titik beku memiliki berbagai manfaat, baik dalam kehidupan sehari-hari maupun dalam bidang industri.
Manfaat Mempelajari Penurunan Titik Beku
- Aplikasi dalam kehidupan sehari-hari: Penurunan titik beku berperan penting dalam berbagai kegiatan sehari-hari, seperti:
- Penghilang es: Garam yang ditaburkan di jalanan pada musim dingin dapat menurunkan titik beku air, sehingga es mencair dan jalan menjadi lebih aman untuk dilalui.
- Pembuatan es krim: Penambahan gula ke dalam air akan menurunkan titik bekunya, sehingga es krim dapat dibuat dengan tekstur yang lembut dan creamy.
- Pembuatan acar: Penambahan garam ke dalam sayur-sayuran dapat menurunkan titik beku air, sehingga sayur-sayuran dapat diawetkan dalam jangka waktu yang lebih lama.
- Aplikasi dalam bidang industri: Penurunan titik beku juga memiliki peran penting dalam berbagai proses industri, seperti:
- Industri kimia: Penurunan titik beku digunakan untuk menentukan berat molekul zat terlarut dan untuk mengontrol titik beku larutan dalam proses kimia.
- Industri pangan: Penurunan titik beku digunakan untuk mengontrol titik beku produk pangan, seperti minuman, es krim, dan makanan beku.
- Industri otomotif: Penurunan titik beku digunakan dalam pembuatan cairan pendingin radiator untuk mencegah pembekuan air pada suhu rendah.
Ringkasan Akhir
Penurunan titik beku merupakan konsep penting yang memiliki aplikasi luas dalam berbagai bidang, mulai dari industri makanan hingga bidang kesehatan. Dengan memahami konsep ini, kita dapat mengendalikan titik beku larutan dan memanfaatkannya untuk berbagai keperluan. Contoh soal penurunan titik beku membantu kita memahami konsep ini dengan lebih baik dan menerapkannya dalam memecahkan masalah-masalah yang terkait dengan larutan.





