Contoh soal ph asam basa – Pernahkah Anda penasaran bagaimana cara menentukan tingkat keasaman atau kebasaan suatu larutan? Atau mungkin Anda ingin menguji pemahaman Anda tentang konsep pH dalam kimia? Nah, dalam artikel ini, kita akan menjelajahi dunia pH asam basa dengan membahas berbagai contoh soal yang akan membantu Anda mengasah kemampuan dalam menentukan pH larutan, menganalisis reaksi asam-basa, dan memahami aplikasi pH dalam kehidupan sehari-hari.
Mulai dari definisi pH, rumus perhitungan, hingga aplikasi pH dalam berbagai bidang, kita akan membahasnya secara tuntas. Siap-siap untuk menguji pengetahuan Anda dengan contoh soal yang menarik dan pembahasan yang detail!
Pengertian pH Asam Basa
pH merupakan singkatan dari “power of hydrogen” atau kekuatan hidrogen. Konsep pH digunakan untuk mengukur tingkat keasaman atau kebasaan suatu larutan. Skala pH digunakan untuk menyatakan tingkat keasaman atau kebasaan suatu larutan secara kuantitatif.
Definisi pH Asam Basa
Dalam konteks kimia, pH adalah ukuran konsentrasi ion hidrogen (H+) dalam suatu larutan. Semakin tinggi konsentrasi ion hidrogen, semakin asam larutan tersebut. Sebaliknya, semakin rendah konsentrasi ion hidrogen, semakin basa larutan tersebut.
Skala pH
Skala pH adalah skala logaritmik yang berkisar dari 0 hingga 14. Setiap perubahan satu satuan pH menunjukkan perubahan sepuluh kali lipat dalam konsentrasi ion hidrogen. Larutan dengan pH 7 dianggap netral, larutan dengan pH kurang dari 7 bersifat asam, dan larutan dengan pH lebih dari 7 bersifat basa.
Contoh Zat Asam, Basa, dan Netral
- Asam: Jus lemon (pH 2-3), cuka (pH 2-3), asam lambung (pH 1-2)
- Basa: Sabun (pH 9-11), air sabun (pH 10-12), air kapur (pH 12-13)
- Netral: Air murni (pH 7), darah manusia (pH 7,35-7,45)
Rumus dan Perhitungan pH
pH merupakan skala yang digunakan untuk mengukur tingkat keasaman atau kebasaan suatu larutan. Skala pH berkisar dari 0 hingga 14, dengan pH 7 dianggap netral. Larutan dengan pH kurang dari 7 bersifat asam, sedangkan larutan dengan pH lebih dari 7 bersifat basa.
Rumus Perhitungan pH
Rumus perhitungan pH berdasarkan konsentrasi ion hidrogen (H+) adalah:
pH = -log[H+]
Dimana:
- pH adalah derajat keasaman
- [H+] adalah konsentrasi ion hidrogen dalam mol/liter
Contoh Soal Perhitungan pH
Larutan Asam
Contoh soal perhitungan pH larutan asam:
Hitunglah pH larutan HCl 0,01 M!
Penyelesaian:
HCl merupakan asam kuat yang terionisasi sempurna dalam air, sehingga konsentrasi ion H+ sama dengan konsentrasi HCl yaitu 0,01 M.
Maka, pH larutan HCl dapat dihitung dengan rumus:
pH = -log[H+] = -log(0,01) = 2
Jadi, pH larutan HCl 0,01 M adalah 2.
Larutan Basa
Contoh soal perhitungan pH larutan basa:
Hitunglah pH larutan NaOH 0,001 M!
Penyelesaian:
NaOH merupakan basa kuat yang terionisasi sempurna dalam air, sehingga konsentrasi ion OH- sama dengan konsentrasi NaOH yaitu 0,001 M.
Maka, pOH larutan NaOH dapat dihitung dengan rumus:
pOH = -log[OH-] = -log(0,001) = 3
Kemudian, pH dapat dihitung dengan rumus:
pH + pOH = 14
Maka, pH larutan NaOH 0,001 M adalah:
pH = 14 – pOH = 14 – 3 = 11
Jadi, pH larutan NaOH 0,001 M adalah 11.
Menentukan pH Larutan Asam Lemah dan Basa Lemah
Asam lemah dan basa lemah tidak terionisasi sempurna dalam air, sehingga konsentrasi ion H+ atau OH- tidak sama dengan konsentrasi asam atau basa. Untuk menentukan pH larutan asam lemah dan basa lemah, diperlukan perhitungan menggunakan rumus kesetimbangan kimia.
Contohnya, untuk asam lemah HA, reaksi ionisasinya adalah:
HA(aq) ⇌ H+(aq) + A-(aq)
Rumus kesetimbangan kimia untuk menentukan pH asam lemah adalah:
Ka = [H+][A-] / [HA]
Dimana:
- Ka adalah tetapan ionisasi asam
- [H+] adalah konsentrasi ion hidrogen
- [A-] adalah konsentrasi ion anion
- [HA] adalah konsentrasi asam lemah
Dengan menggunakan rumus kesetimbangan kimia, kita dapat menghitung konsentrasi ion H+ dan kemudian menentukan pH larutan asam lemah.
Perhitungan pH untuk basa lemah juga dilakukan dengan cara yang mirip, menggunakan rumus kesetimbangan kimia dan tetapan ionisasi basa (Kb).
Indikator pH: Contoh Soal Ph Asam Basa
Indikator pH merupakan zat yang dapat mengubah warna sesuai dengan tingkat keasaman atau kebasaan larutan. Zat ini berfungsi sebagai penanda perubahan pH, memberikan informasi kualitatif tentang sifat asam, basa, atau netral suatu larutan.
Prinsip Kerja Indikator pH
Indikator pH bekerja berdasarkan prinsip perubahan warna yang terjadi akibat perubahan kesetimbangan kimia dalam larutan. Indikator pH sendiri adalah asam lemah atau basa lemah yang memiliki warna berbeda dalam bentuk asam dan basa konjugatnya. Ketika indikator ditambahkan ke dalam larutan, ia akan bereaksi dengan ion hidrogen (H+) atau ion hidroksida (OH-) dalam larutan, sehingga menyebabkan perubahan kesetimbangan kimia. Perubahan ini akan mengubah warna indikator, yang kemudian dapat digunakan untuk menentukan pH larutan.
Contoh Indikator pH
Ada banyak jenis indikator pH yang tersedia, masing-masing memiliki rentang pH dan warna yang berbeda. Berikut beberapa contoh indikator pH dan perubahan warna yang terjadi pada rentang pH tertentu:
- Lakmus: Merah dalam larutan asam (pH 8), dan ungu dalam larutan netral (pH 5-8).
- Fenolftalein: Tidak berwarna dalam larutan asam (pH 10), dan tidak berwarna dalam larutan netral (pH 8,2-10).
- Metil Jingga: Merah dalam larutan asam (pH 4,4), dan jingga dalam larutan netral (pH 3,1-4,4).
- Bromtimol Biru: Kuning dalam larutan asam (pH 7,6), dan hijau dalam larutan netral (pH 6,0-7,6).
Tabel Indikator pH
| Nama Indikator | Rentang pH | Warna Asam | Warna Netral | Warna Basa |
|---|---|---|---|---|
| Lakmus | 5-8 | Merah | Ungu | Biru |
| Fenolftalein | 8,2-10 | Tidak berwarna | Tidak berwarna | Merah muda |
| Metil Jingga | 3,1-4,4 | Merah | Jingga | Kuning |
| Bromtimol Biru | 6,0-7,6 | Kuning | Hijau | Biru |
Titrasi Asam Basa
Titrasi asam basa merupakan salah satu teknik penting dalam kimia analitik. Teknik ini memungkinkan kita untuk menentukan konsentrasi suatu larutan asam atau basa dengan cara mereaksikan larutan tersebut dengan larutan basa atau asam yang konsentrasinya sudah diketahui.
Prinsip Titrasi Asam Basa
Titrasi asam basa didasarkan pada reaksi netralisasi antara asam dan basa. Prinsip utamanya adalah penambahan larutan standar (larutan dengan konsentrasi yang diketahui) ke dalam larutan analit (larutan yang konsentrasinya ingin ditentukan) secara bertahap. Reaksi netralisasi akan terjadi hingga titik ekivalen tercapai, yaitu titik di mana jumlah mol asam sama dengan jumlah mol basa.
Langkah-langkah Titrasi Asam Basa
- Persiapan Larutan: Siapkan larutan standar (titran) dan larutan analit (larutan yang ingin ditentukan konsentrasinya). Pastikan kedua larutan tersebut telah diencerkan dengan benar dan diukur volumenya secara akurat.
- Pengisian Buret: Isi buret dengan larutan standar (titran). Buret merupakan alat berbentuk silinder yang dilengkapi dengan kran untuk mengatur pengeluaran larutan.
- Penambahan Titran: Teteskan larutan standar (titran) ke dalam larutan analit secara perlahan, sambil terus diaduk. Gunakan indikator untuk menunjukkan perubahan warna saat titik ekivalen tercapai.
- Titik Ekivalen: Titik ekivalen tercapai ketika jumlah mol asam sama dengan jumlah mol basa. Hal ini ditandai dengan perubahan warna indikator. Catat volume titran yang digunakan untuk mencapai titik ekivalen.
- Perhitungan: Gunakan data yang diperoleh dari titrasi untuk menghitung konsentrasi larutan analit. Gunakan rumus yang sesuai dengan reaksi netralisasi yang terjadi.
Contoh Soal Titrasi Asam Basa, Contoh soal ph asam basa
Misalnya, kita ingin menentukan konsentrasi larutan asam cuka (CH3COOH) dengan menggunakan larutan standar NaOH. Asumsikan kita memiliki 25,00 mL larutan asam cuka yang dititrasi dengan 25,00 mL larutan NaOH 0,100 M. Titik ekivalen tercapai ketika 20,00 mL larutan NaOH telah ditambahkan.
Untuk menentukan konsentrasi asam cuka, kita perlu menggunakan rumus berikut:
Masam x Vasam = Mbasa x Vbasa
Dimana:
– Masam adalah konsentrasi asam cuka
– Vasam adalah volume asam cuka
– Mbasa adalah konsentrasi larutan NaOH
– Vbasa adalah volume larutan NaOH yang digunakan untuk mencapai titik ekivalen
Substitusikan nilai yang diketahui ke dalam rumus:
Masam x 25,00 mL = 0,100 M x 20,00 mL
Masam = (0,100 M x 20,00 mL) / 25,00 mL
Masam = 0,080 M
Jadi, konsentrasi larutan asam cuka adalah 0,080 M.
Menentukan Titik Ekivalen
Titik ekivalen merupakan titik di mana jumlah mol asam sama dengan jumlah mol basa. Titik ini dapat ditentukan dengan menggunakan indikator, yaitu zat yang berubah warna saat pH larutan berubah.
Indikator yang tepat akan berubah warna pada pH yang dekat dengan titik ekivalen. Misalnya, fenolftalein akan berubah warna dari tidak berwarna menjadi merah muda pada pH sekitar 8,2.
Pertimbangan Tambahan
- Pilihan Indikator: Pemilihan indikator yang tepat sangat penting untuk memastikan hasil titrasi yang akurat. Indikator harus memiliki rentang pH yang sesuai dengan reaksi netralisasi yang terjadi.
- Ketepatan Pengukuran: Pengukuran volume larutan standar dan larutan analit harus dilakukan secara akurat untuk mendapatkan hasil titrasi yang tepat.
- Pengaruh Suhu: Suhu dapat mempengaruhi volume larutan, sehingga penting untuk memastikan bahwa suhu larutan standar dan larutan analit konsisten selama titrasi.
Aplikasi pH Asam Basa
pH, singkatan dari “potential of hydrogen”, adalah ukuran konsentrasi ion hidrogen dalam suatu larutan. Skala pH berkisar dari 0 hingga 14, dengan nilai 7 menunjukkan larutan netral. Larutan dengan pH kurang dari 7 bersifat asam, sedangkan larutan dengan pH lebih dari 7 bersifat basa. Konsep pH ini sangat penting karena memiliki aplikasi yang luas dalam berbagai bidang kehidupan, mulai dari kesehatan hingga industri.
Aplikasi pH dalam Bidang Kesehatan
pH memainkan peran penting dalam menjaga keseimbangan kimiawi tubuh manusia. Misalnya, pH darah harus berada dalam kisaran 7,35 hingga 7,45. Jika pH darah turun di bawah kisaran ini, kondisi tersebut disebut asidosis, sedangkan jika naik di atas kisaran ini, kondisi tersebut disebut alkalosis. Kedua kondisi tersebut dapat berakibat fatal. pH juga berperan penting dalam pencernaan, dengan lambung menghasilkan asam klorida (HCl) yang memiliki pH rendah untuk membantu mencerna makanan.
- Pengobatan: pH digunakan untuk mengukur keasaman atau kebasaan obat-obatan, membantu dalam pengembangan dan administrasi obat-obatan yang aman dan efektif. Obat-obatan yang digunakan untuk mengobati gangguan pencernaan seperti maag dan asam lambung seringkali mengandung antasida yang menetralkan asam lambung.
- Diagnosa: Analisis urine dan darah dapat memberikan informasi tentang kesehatan tubuh. Misalnya, pH urine dapat menunjukkan adanya infeksi saluran kemih atau batu ginjal.
Aplikasi pH dalam Bidang Pertanian
pH tanah sangat penting untuk pertumbuhan tanaman. Tanaman membutuhkan nutrisi tertentu untuk tumbuh dengan baik, dan ketersediaan nutrisi ini dipengaruhi oleh pH tanah. Setiap jenis tanaman memiliki rentang pH tanah yang optimal untuk pertumbuhannya. Misalnya, tanaman seperti kentang dan wortel tumbuh dengan baik di tanah yang sedikit asam, sedangkan tanaman seperti kacang tanah dan kedelai lebih menyukai tanah yang sedikit basa.
Contoh soal pH asam basa seringkali melibatkan perhitungan konsentrasi ion hidrogen atau hidroksida. Nah, kalau kamu tertarik untuk belajar tentang perhitungan nilai intrinsik saham, kamu bisa cek contoh soal menghitung nilai intrinsik saham ini. Sama seperti perhitungan pH, menghitung nilai intrinsik saham juga melibatkan beberapa variabel dan rumus yang perlu dipahami.
Jadi, meskipun terlihat berbeda, keduanya sama-sama membutuhkan pemahaman konsep dan aplikasi rumus yang tepat.
- Pengaturan pH Tanah: Petani dapat mengatur pH tanah dengan menambahkan bahan organik seperti kompos atau pupuk kandang, atau dengan menggunakan pupuk kimia yang dapat menurunkan atau menaikkan pH tanah.
- Penyerapan Nutrisi: pH tanah memengaruhi ketersediaan nutrisi penting seperti nitrogen, fosfor, dan kalium. Pada pH yang optimal, nutrisi ini lebih mudah diserap oleh akar tanaman.
Aplikasi pH dalam Bidang Industri
pH memiliki peran penting dalam berbagai proses industri, termasuk produksi makanan, minuman, kosmetik, dan farmasi. Pengaturan pH yang tepat sangat penting untuk memastikan kualitas dan keamanan produk.
- Industri Makanan dan Minuman: pH digunakan untuk mengontrol fermentasi, membantu menjaga rasa dan kualitas produk. Misalnya, dalam pembuatan yogurt, pH dikontrol untuk memastikan pertumbuhan bakteri asam laktat yang bertanggung jawab untuk fermentasi.
- Industri Kimia: pH digunakan untuk mengontrol reaksi kimia, memaksimalkan efisiensi proses produksi, dan memastikan keamanan proses. Misalnya, dalam produksi sabun, pH diatur untuk memastikan sabun memiliki pH yang tepat untuk digunakan.
- Pengolahan Air: pH air minum harus berada dalam kisaran tertentu untuk memastikan keamanan dan kualitasnya. Pengolahan air minum melibatkan penyesuaian pH untuk menghilangkan kontaminan dan bakteri berbahaya.
Dampak pH terhadap Lingkungan dan Kesehatan Manusia
pH memainkan peran penting dalam menjaga keseimbangan ekosistem. Perubahan pH pada air, tanah, atau udara dapat berdampak negatif terhadap lingkungan dan kesehatan manusia. Asam hujan, misalnya, disebabkan oleh emisi gas asam seperti sulfur dioksida dan nitrogen oksida ke atmosfer. Asam hujan dapat menurunkan pH tanah dan air, menyebabkan kerusakan hutan, dan mencemari sumber air minum.
- Pencemaran Air: Air limbah industri dan pertanian dapat menyebabkan perubahan pH pada sungai dan danau, mengancam kehidupan air dan ekosistem akuatik.
- Pencemaran Udara: Emisi gas asam dari pembangkit listrik dan industri dapat menyebabkan hujan asam, yang berdampak negatif pada tanaman, bangunan, dan kesehatan manusia.
- Kesehatan Manusia: Paparan jangka panjang terhadap air dan udara yang asam dapat menyebabkan masalah kesehatan seperti gangguan pernapasan, masalah kulit, dan penyakit kronis lainnya.
Soal Latihan
Setelah mempelajari materi tentang pH asam basa, sekarang saatnya untuk menguji pemahaman Anda dengan mengerjakan soal-soal latihan berikut. Soal-soal ini dirancang dengan berbagai tingkat kesulitan untuk mengukur pemahaman Anda tentang konsep pH asam basa, mulai dari pemahaman dasar hingga penerapannya dalam berbagai situasi.
Soal Pilihan Ganda
Berikut adalah 5 soal pilihan ganda tentang pH asam basa dengan berbagai tingkat kesulitan. Pilihlah jawaban yang paling tepat untuk setiap pertanyaan.
- Manakah dari berikut ini yang merupakan ciri khas larutan asam?
- pH lebih dari 7
- pH kurang dari 7
- pH sama dengan 7
- Tidak ada yang benar
- Larutan dengan pH 3 lebih bersifat … daripada larutan dengan pH 5.
- asam
- basa
- netral
- sama asamnya
- Manakah dari berikut ini yang merupakan contoh larutan basa?
- Air jeruk nipis
- Cuka
- Sabun cuci piring
- Air aki
- Apa yang terjadi ketika asam kuat direaksikan dengan basa kuat?
- Terbentuk garam dan air
- Terbentuk asam yang lebih kuat
- Terbentuk basa yang lebih kuat
- Tidak terjadi reaksi
- Bagaimana cara menentukan pH suatu larutan secara praktis?
- Dengan mencicipi larutan
- Dengan menggunakan kertas lakmus
- Dengan melihat warna larutan
- Dengan menggunakan alat ukur khusus
Soal Essay
Berikut adalah 3 soal essay tentang pH asam basa yang menuntut pemahaman konsep dan kemampuan analisis. Jawablah pertanyaan-pertanyaan berikut dengan lengkap dan jelas.
- Jelaskan hubungan antara pH dan konsentrasi ion hidrogen (H+) dalam suatu larutan. Bagaimana pengaruh perubahan konsentrasi ion hidrogen terhadap nilai pH? Berikan contoh konkret untuk memperjelas penjelasan Anda.
- Apa perbedaan utama antara asam kuat dan asam lemah? Jelaskan pengaruh perbedaan ini terhadap nilai pH larutan asam. Berikan contoh masing-masing jenis asam dan jelaskan bagaimana nilai pH-nya diukur.
- Jelaskan bagaimana buffer bekerja dalam menjaga pH larutan agar tetap stabil. Berikan contoh sistem buffer dalam kehidupan sehari-hari dan jelaskan mekanisme kerjanya. Apa pentingnya buffer dalam sistem biologis?
Kunci Jawaban
Berikut adalah contoh kunci jawaban untuk soal-soal latihan di atas. Kunci jawaban ini hanya sebagai panduan dan tidak mutlak benar. Anda dapat mengembangkan jawaban Anda sendiri berdasarkan pemahaman Anda terhadap materi.
Soal Pilihan Ganda
- b
- a
- c
- a
- d
Soal Essay
- pH dan konsentrasi ion hidrogen (H+) memiliki hubungan invers. Semakin tinggi konsentrasi ion hidrogen, semakin rendah nilai pH, dan sebaliknya. Misalnya, larutan dengan konsentrasi ion hidrogen 10-3 M memiliki pH 3, sedangkan larutan dengan konsentrasi ion hidrogen 10-5 M memiliki pH 5. Perbedaan konsentrasi ion hidrogen ini menunjukkan bahwa larutan pertama lebih asam daripada larutan kedua.
- Asam kuat terionisasi sepenuhnya dalam larutan, sedangkan asam lemah hanya terionisasi sebagian. Akibatnya, asam kuat menghasilkan konsentrasi ion hidrogen yang lebih tinggi dibandingkan dengan asam lemah pada konsentrasi yang sama. Hal ini menyebabkan pH larutan asam kuat lebih rendah daripada pH larutan asam lemah. Contoh asam kuat adalah asam klorida (HCl), sedangkan contoh asam lemah adalah asam asetat (CH3COOH). pH larutan asam kuat dapat diukur dengan menggunakan pH meter atau kertas lakmus, sedangkan pH larutan asam lemah dapat diukur dengan menggunakan titrasi.
- Buffer adalah sistem yang dapat menahan perubahan pH larutan ketika ditambahkan asam atau basa. Buffer bekerja dengan cara menetralkan ion hidrogen (H+) atau ion hidroksida (OH-) yang ditambahkan ke dalam larutan. Contoh sistem buffer dalam kehidupan sehari-hari adalah larutan buffer dalam darah, yang membantu menjaga pH darah agar tetap stabil. Sistem buffer dalam darah terdiri dari asam karbonat (H2CO3) dan bikarbonat (HCO3–). Ketika asam ditambahkan ke dalam darah, bikarbonat akan bereaksi dengan asam untuk membentuk asam karbonat. Sebaliknya, ketika basa ditambahkan ke dalam darah, asam karbonat akan bereaksi dengan basa untuk membentuk bikarbonat. Reaksi-reaksi ini membantu menjaga pH darah agar tetap stabil di sekitar 7,4. Buffer sangat penting dalam sistem biologis karena banyak reaksi biokimia yang hanya dapat berlangsung pada pH tertentu.
Contoh Soal dan Pembahasan
Pada bagian ini, kita akan membahas contoh soal tentang perhitungan pH larutan asam kuat dan basa kuat. Pembahasan akan meliputi langkah-langkah penyelesaian dan penjelasan detail untuk memahami konsep perhitungan pH.
Contoh Soal Perhitungan pH Larutan Asam Kuat
Misalnya, kita ingin menghitung pH larutan HCl 0,01 M.
Langkah-langkah Penyelesaian
- Tuliskan persamaan reaksi ionisasi asam kuat.
- Tentukan konsentrasi ion H+ dalam larutan.
- Hitung pH larutan menggunakan rumus pH = -log [H+].
Pembahasan
- HCl merupakan asam kuat yang terionisasi sempurna dalam air. Persamaan reaksinya adalah:
HCl (aq) → H+ (aq) + Cl- (aq)
- Karena HCl terionisasi sempurna, konsentrasi ion H+ sama dengan konsentrasi HCl, yaitu 0,01 M.
- pH larutan dihitung dengan rumus:
pH = -log [H+] = -log (0,01) = 2
Contoh Soal Perhitungan pH Larutan Basa Kuat
Misalnya, kita ingin menghitung pH larutan NaOH 0,001 M.
Langkah-langkah Penyelesaian
- Tuliskan persamaan reaksi ionisasi basa kuat.
- Tentukan konsentrasi ion OH- dalam larutan.
- Hitung pOH larutan menggunakan rumus pOH = -log [OH-].
- Hitung pH larutan menggunakan rumus pH + pOH = 14.
Pembahasan
- NaOH merupakan basa kuat yang terionisasi sempurna dalam air. Persamaan reaksinya adalah:
NaOH (aq) → Na+ (aq) + OH- (aq)
- Karena NaOH terionisasi sempurna, konsentrasi ion OH- sama dengan konsentrasi NaOH, yaitu 0,001 M.
- pOH larutan dihitung dengan rumus:
pOH = -log [OH-] = -log (0,001) = 3
- pH larutan dihitung dengan rumus:
pH + pOH = 14
pH = 14 – pOH = 14 – 3 = 11
Tabel Rangkuman Langkah Penyelesaian
| Langkah | Asam Kuat | Basa Kuat |
|---|---|---|
| 1. Tuliskan persamaan reaksi ionisasi | HA (aq) → H+ (aq) + A- (aq) | BOH (aq) → B+ (aq) + OH- (aq) |
| 2. Tentukan konsentrasi ion H+ atau OH- | [H+] = [HA] | [OH-] = [BOH] |
| 3. Hitung pH atau pOH | pH = -log [H+] | pOH = -log [OH-] |
| 4. Hitung pH atau pOH (jika diperlukan) | – | pH + pOH = 14 |
Konsep Keasaman dan Kebasaan
Konsep keasaman dan kebasaan merupakan topik penting dalam kimia yang menjelaskan sifat-sifat senyawa dan reaksinya. Ada beberapa teori yang menjelaskan konsep ini, salah satunya adalah teori Brønsted-Lowry. Teori ini memberikan pemahaman yang lebih luas tentang asam dan basa, serta hubungannya dalam reaksi kimia.
Teori Brønsted-Lowry
Teori Brønsted-Lowry mendefinisikan asam sebagai senyawa yang dapat mendonorkan proton (H+), sedangkan basa didefinisikan sebagai senyawa yang dapat menerima proton. Dengan kata lain, asam merupakan donor proton, sementara basa merupakan akseptor proton.
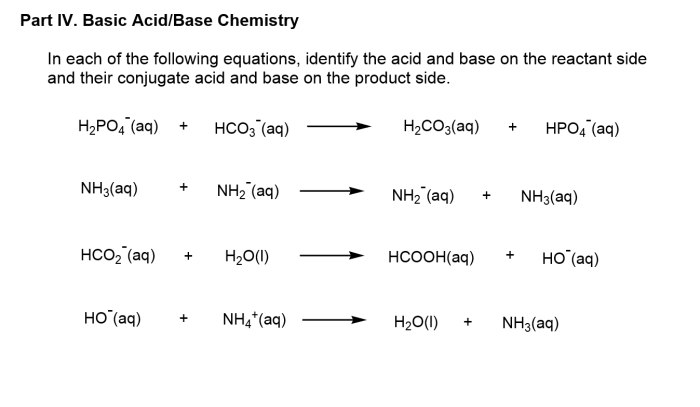
Asam dan Basa Konjugat
Ketika asam melepaskan proton, ia akan membentuk basa konjugat. Begitu pula, ketika basa menerima proton, ia akan membentuk asam konjugat. Pasangan asam-basa konjugat ini selalu hadir dalam reaksi asam-basa.
- Asam konjugat adalah spesies yang terbentuk ketika basa menerima proton.
- Basa konjugat adalah spesies yang terbentuk ketika asam melepaskan proton.
Contoh Reaksi Asam-Basa
Perhatikan reaksi berikut:
HCl(aq) + H2O(l) ⇌ H3O+(aq) + Cl–(aq)
Dalam reaksi ini, HCl bertindak sebagai asam karena melepaskan proton (H+) membentuk ion hidronium (H3O+). Air (H2O) bertindak sebagai basa karena menerima proton dari HCl, membentuk ion hidronium (H3O+).
Dalam reaksi ini, HCl dan Cl– merupakan pasangan asam-basa konjugat. HCl adalah asam, sedangkan Cl– adalah basa konjugatnya. Demikian pula, H2O dan H3O+ merupakan pasangan asam-basa konjugat. H2O adalah basa, sedangkan H3O+ adalah asam konjugatnya.
Pengaruh Suhu terhadap pH
Nilai pH suatu larutan menunjukkan tingkat keasaman atau kebasaan. Namun, nilai pH ini tidaklah statis dan dapat berubah dipengaruhi oleh beberapa faktor, salah satunya adalah suhu. Suhu memiliki peran penting dalam menentukan kesetimbangan reaksi asam-basa, yang pada gilirannya memengaruhi nilai pH.
Pengaruh Suhu terhadap pH Larutan Asam dan Basa
Pada umumnya, peningkatan suhu akan menyebabkan penurunan pH pada larutan asam dan peningkatan pH pada larutan basa. Hal ini dapat dijelaskan dengan prinsip Le Chatelier, yang menyatakan bahwa suatu sistem dalam kesetimbangan akan bergeser ke arah yang mengurangi tekanan yang diberikan padanya. Dalam konteks ini, tekanan yang diberikan adalah perubahan suhu.
- Larutan Asam: Pada larutan asam, peningkatan suhu akan mendorong kesetimbangan reaksi ionisasi asam ke arah pembentukan ion hidrogen (H+) yang lebih banyak. Reaksi ionisasi asam adalah reaksi endotermis, yang artinya membutuhkan energi panas untuk berlangsung. Peningkatan suhu akan memberikan energi yang dibutuhkan untuk reaksi berlangsung lebih cepat, sehingga lebih banyak ion H+ terbentuk, dan nilai pH akan turun.
- Larutan Basa: Pada larutan basa, peningkatan suhu akan mendorong kesetimbangan reaksi ionisasi basa ke arah pembentukan ion hidroksida (OH-) yang lebih banyak. Reaksi ionisasi basa adalah reaksi eksotermis, yang artinya melepaskan energi panas. Peningkatan suhu akan mengurangi tekanan pada sistem, sehingga kesetimbangan bergeser ke arah pembentukan OH- yang lebih banyak, dan nilai pH akan naik.
Contoh Kasus Perubahan pH Akibat Perubahan Suhu
Sebagai contoh, perhatikan larutan asam cuka (CH3COOH). Asam cuka adalah asam lemah yang terionisasi sebagian dalam air. Ketika suhu larutan cuka dinaikkan, kesetimbangan reaksi ionisasi asam cuka akan bergeser ke arah pembentukan ion hidrogen (H+) yang lebih banyak. Hal ini menyebabkan penurunan pH larutan cuka.
Faktor Lain yang Mempengaruhi pH Selain Suhu
Selain suhu, terdapat beberapa faktor lain yang dapat memengaruhi nilai pH suatu larutan, yaitu:
- Konsentrasi: Semakin tinggi konsentrasi asam atau basa, semakin rendah atau tinggi nilai pH-nya.
- Kekuatan Asam/Basa: Asam kuat akan terionisasi sepenuhnya dalam air, sehingga memiliki nilai pH yang lebih rendah dibandingkan asam lemah yang hanya terionisasi sebagian. Hal yang sama berlaku untuk basa.
- Pelarut: Nilai pH suatu larutan juga dipengaruhi oleh pelarut yang digunakan. Air adalah pelarut yang paling umum, tetapi pelarut lain seperti alkohol atau aseton dapat memengaruhi nilai pH.
Ringkasan Penutup
Dengan memahami konsep pH asam basa, Anda dapat menganalisis berbagai fenomena kimia dan biologi, serta mengaplikasikannya dalam berbagai bidang, mulai dari kesehatan hingga industri. Jadi, jangan ragu untuk terus mempelajari dan memperdalam pengetahuan Anda tentang pH asam basa, karena pengetahuan ini akan sangat bermanfaat dalam perjalanan Anda di dunia sains.





