Contoh soal reaksi redoks – Reaksi redoks, atau reaksi reduksi-oksidasi, merupakan proses kimia yang melibatkan perpindahan elektron antara dua zat. Perpindahan elektron ini menyebabkan perubahan bilangan oksidasi pada atom-atom yang terlibat. Mempelajari reaksi redoks penting karena berperan dalam berbagai proses kehidupan, seperti respirasi seluler dan fotosintesis, serta dalam berbagai aplikasi teknologi seperti baterai dan korosi.
Dalam artikel ini, kita akan membahas contoh soal reaksi redoks yang mencakup berbagai aspek, mulai dari penentuan bilangan oksidasi hingga pengenalan jenis-jenis reaksi redoks. Melalui contoh soal ini, Anda dapat memperdalam pemahaman tentang konsep reaksi redoks dan mengasah kemampuan Anda dalam menyelesaikan soal-soal terkait.
Pengertian Reaksi Redoks
Reaksi redoks merupakan reaksi kimia yang melibatkan perpindahan elektron antara dua zat atau lebih. Dalam reaksi redoks, terjadi perubahan bilangan oksidasi (biloks) dari atom-atom yang terlibat. Bilangan oksidasi adalah angka yang menunjukkan jumlah elektron yang hilang atau diperoleh oleh suatu atom dalam suatu senyawa.
Contoh Reaksi Redoks
Contoh reaksi redoks yang sederhana adalah reaksi antara logam magnesium (Mg) dengan larutan asam klorida (HCl) untuk menghasilkan magnesium klorida (MgCl2) dan gas hidrogen (H2).
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
Dalam reaksi ini, atom magnesium (Mg) kehilangan 2 elektron dan bilangan oksidasinya berubah dari 0 menjadi +2, sehingga mengalami oksidasi. Sementara itu, atom hidrogen (H) dalam HCl menerima 1 elektron dan bilangan oksidasinya berubah dari +1 menjadi 0, sehingga mengalami reduksi.
Perbedaan Reaksi Reduksi dan Reaksi Oksidasi
Reaksi redoks terdiri dari dua proses yang saling terkait, yaitu reaksi reduksi dan reaksi oksidasi. Berikut adalah perbedaan antara kedua reaksi tersebut:
| Aspek | Reduksi | Oksidasi |
|---|---|---|
| Perubahan Bilangan Oksidasi | Menurun | Meningkat |
| Perubahan Elektron | Menerima Elektron | Melepaskan Elektron |
| Contoh | Fe3+ + e– → Fe2+ | Cu → Cu2+ + 2e– |
Cara Menentukan Bilangan Oksidasi
Bilangan oksidasi merupakan angka yang menunjukkan tingkat oksidasi suatu atom dalam suatu senyawa atau ion. Bilangan oksidasi dapat bernilai positif, negatif, atau nol. Penentuan bilangan oksidasi penting untuk memahami reaksi redoks, yaitu reaksi yang melibatkan perpindahan elektron. Dalam reaksi redoks, bilangan oksidasi atom-atom yang terlibat dalam reaksi akan berubah.
Langkah-langkah Menentukan Bilangan Oksidasi
Berikut langkah-langkah umum dalam menentukan bilangan oksidasi suatu atom dalam senyawa:
- Tentukan jenis ikatan dalam senyawa. Apakah ikatannya ionik atau kovalen?
- Jika ikatannya ionik, bilangan oksidasi atom sama dengan muatan ionnya. Misalnya, bilangan oksidasi Na dalam NaCl adalah +1, sedangkan bilangan oksidasi Cl adalah -1.
- Jika ikatannya kovalen, bilangan oksidasi atom ditentukan berdasarkan aturan-aturan yang telah ditetapkan.
Contoh Soal Menentukan Bilangan Oksidasi pada Senyawa Ion
Berikut contoh soal menentukan bilangan oksidasi pada senyawa ion:
Tentukan bilangan oksidasi Mn dalam senyawa KMnO4.
- Tentukan bilangan oksidasi K dan O. Bilangan oksidasi K adalah +1 dan bilangan oksidasi O adalah -2.
- Jumlah total bilangan oksidasi dalam senyawa harus nol. Jadi, bilangan oksidasi Mn dapat dihitung dengan persamaan berikut:
- Selesaikan persamaan tersebut, maka bilangan oksidasi Mn adalah +7.
(+1) + (Mn) + 4(-2) = 0
Contoh Soal Menentukan Bilangan Oksidasi pada Senyawa Kovalen
Berikut contoh soal menentukan bilangan oksidasi pada senyawa kovalen:
Tentukan bilangan oksidasi S dalam senyawa SO2.
- Tentukan bilangan oksidasi O. Bilangan oksidasi O adalah -2.
- Jumlah total bilangan oksidasi dalam senyawa harus nol. Jadi, bilangan oksidasi S dapat dihitung dengan persamaan berikut:
- Selesaikan persamaan tersebut, maka bilangan oksidasi S adalah +4.
(S) + 2(-2) = 0
Aturan-aturan Umum dalam Menentukan Bilangan Oksidasi
Berikut aturan-aturan umum dalam menentukan bilangan oksidasi:
| Aturan | Keterangan |
|---|---|
| Atom dalam bentuk unsur bebas | Bilangan oksidasinya 0 |
| Atom golongan IA | Bilangan oksidasinya +1 |
| Atom golongan IIA | Bilangan oksidasinya +2 |
| Atom golongan VIIA | Bilangan oksidasinya -1, kecuali dalam senyawa dengan atom yang lebih elektronegatif |
| Atom golongan VIA | Bilangan oksidasinya -2, kecuali dalam senyawa dengan atom yang lebih elektronegatif |
| Hidrogen (H) | Bilangan oksidasinya +1, kecuali dalam senyawa hidrida logam (bilangan oksidasinya -1) |
| Oksigen (O) | Bilangan oksidasinya -2, kecuali dalam senyawa peroksida (bilangan oksidasinya -1) dan superoksida (bilangan oksidasinya -1/2) |
| Jumlah bilangan oksidasi dalam senyawa | Harus sama dengan nol |
| Jumlah bilangan oksidasi dalam ion | Harus sama dengan muatan ion |
Jenis-jenis Reaksi Redoks
Reaksi redoks, singkatan dari reaksi reduksi-oksidasi, merupakan jenis reaksi kimia yang melibatkan perpindahan elektron antar atom. Reaksi ini melibatkan dua proses utama: reduksi dan oksidasi. Reduksi adalah proses penambahan elektron, sedangkan oksidasi adalah proses pelepasan elektron. Jenis reaksi redoks dibedakan berdasarkan mekanisme dan perubahan kimia yang terjadi.
Jenis-jenis Reaksi Redoks
Reaksi redoks dapat dibedakan menjadi beberapa jenis, yaitu:
- Reaksi Kombinasi: Reaksi kombinasi merupakan reaksi redoks yang melibatkan penggabungan dua atau lebih zat untuk membentuk satu zat baru. Contohnya, reaksi antara logam magnesium (Mg) dengan oksigen (O2) membentuk magnesium oksida (MgO):
2Mg(s) + O2(g) → 2MgO(s)
- Dalam reaksi ini, magnesium mengalami oksidasi karena melepaskan elektron dan membentuk ion Mg2+, sedangkan oksigen mengalami reduksi karena menerima elektron dan membentuk ion O2-.
- Reaksi Dekomposisi: Reaksi dekomposisi adalah reaksi redoks yang melibatkan penguraian satu zat menjadi dua atau lebih zat. Contohnya, penguraian kalium klorat (KClO3) menjadi kalium klorida (KCl) dan oksigen (O2):
2KClO3(s) → 2KCl(s) + 3O2(g)
- Dalam reaksi ini, klorin mengalami reduksi karena menerima elektron dan membentuk ion Cl–, sedangkan oksigen mengalami oksidasi karena melepaskan elektron dan membentuk O2.
- Reaksi Penggantian Tunggal: Reaksi penggantian tunggal adalah reaksi redoks yang melibatkan penggantian satu unsur dalam senyawa oleh unsur lain. Contohnya, reaksi antara seng (Zn) dengan larutan tembaga(II) sulfat (CuSO4) membentuk seng sulfat (ZnSO4) dan tembaga (Cu):
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
- Dalam reaksi ini, seng mengalami oksidasi karena melepaskan elektron dan membentuk ion Zn2+, sedangkan tembaga mengalami reduksi karena menerima elektron dan membentuk Cu.
- Reaksi Penggantian Ganda: Reaksi penggantian ganda adalah reaksi redoks yang melibatkan pertukaran ion antara dua senyawa. Contohnya, reaksi antara larutan perak nitrat (AgNO3) dengan larutan natrium klorida (NaCl) membentuk perak klorida (AgCl) dan natrium nitrat (NaNO3):
AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
- Dalam reaksi ini, perak mengalami reduksi karena menerima elektron dan membentuk Ag, sedangkan natrium mengalami oksidasi karena melepaskan elektron dan membentuk ion Na+.
Diagram Alir Identifikasi Jenis Reaksi Redoks
Untuk memudahkan identifikasi jenis reaksi redoks, dapat digunakan diagram alir berikut:
[Gambar diagram alir identifikasi jenis reaksi redoks]
Diagram alir ini menunjukkan langkah-langkah yang dapat digunakan untuk mengidentifikasi jenis reaksi redoks berdasarkan perubahan kimia yang terjadi.
Aplikasi Reaksi Redoks dalam Kehidupan Sehari-hari
Reaksi redoks merupakan proses kimia yang melibatkan transfer elektron antara dua spesies kimia. Proses ini sangat penting dalam berbagai aspek kehidupan sehari-hari, mulai dari proses alamiah seperti fotosintesis hingga teknologi yang kita gunakan setiap hari. Berikut ini beberapa contoh aplikasi reaksi redoks yang kita temui dalam kehidupan sehari-hari.
Baterai
Baterai merupakan contoh aplikasi reaksi redoks yang sangat umum. Baterai memanfaatkan reaksi redoks untuk menghasilkan energi listrik. Pada baterai, terdapat dua elektroda yang terbuat dari logam berbeda. Elektroda ini direndam dalam larutan elektrolit yang memungkinkan perpindahan ion.
- Pada elektroda negatif, terjadi reaksi oksidasi, yaitu pelepasan elektron.
- Pada elektroda positif, terjadi reaksi reduksi, yaitu penerimaan elektron.
Perpindahan elektron ini menghasilkan arus listrik yang dapat digunakan untuk berbagai keperluan.
Contohnya, pada baterai alkaline, reaksi redoks terjadi antara seng (Zn) sebagai elektroda negatif dan mangan dioksida (MnO2) sebagai elektroda positif. Seng teroksidasi dan melepaskan elektron, sedangkan mangan dioksida direduksi dan menerima elektron. Arus listrik yang dihasilkan kemudian digunakan untuk menyalakan berbagai perangkat elektronik.
Korosi
Korosi adalah proses degradasi material, terutama logam, akibat reaksi redoks dengan lingkungan. Proses ini terjadi ketika logam bereaksi dengan oksigen dan air, membentuk oksida logam yang rapuh dan mudah hancur.
- Contohnya, korosi pada besi (karat) terjadi ketika besi teroksidasi oleh oksigen di udara, membentuk besi oksida (Fe2O3) yang berwarna kemerahan.
- Korosi dapat dicegah dengan berbagai cara, seperti melapisi logam dengan cat, pelumas, atau logam lain yang lebih tahan terhadap korosi.
Pembakaran, Contoh soal reaksi redoks
Pembakaran adalah reaksi kimia yang melibatkan reaksi redoks antara bahan bakar dan oksidator, biasanya oksigen. Reaksi ini menghasilkan panas dan cahaya.
- Contohnya, pembakaran kayu, gas alam, dan bahan bakar fosil lainnya merupakan reaksi redoks yang menghasilkan energi panas dan cahaya.
- Reaksi ini melibatkan oksidasi bahan bakar, seperti kayu, dan reduksi oksigen.
Fotosintesis
Fotosintesis merupakan proses kompleks yang terjadi pada tumbuhan dan beberapa organisme lain untuk mengubah energi cahaya matahari menjadi energi kimia dalam bentuk glukosa. Proses ini melibatkan reaksi redoks yang terjadi di dalam kloroplas sel tumbuhan.
- Pada tahap pertama, air (H2O) teroksidasi menjadi oksigen (O2), melepaskan elektron.
- Pada tahap kedua, karbon dioksida (CO2) direduksi menjadi glukosa (C6H12O6) dengan menggunakan elektron yang dilepaskan dari oksidasi air.
Proses ini merupakan dasar dari rantai makanan di bumi, karena menghasilkan oksigen yang kita hirup dan glukosa yang merupakan sumber energi utama bagi makhluk hidup.
Soal Latihan Reaksi Redoks
Reaksi redoks merupakan reaksi kimia yang melibatkan perpindahan elektron antara reaktan. Dalam reaksi redoks, terdapat dua proses utama yaitu reduksi dan oksidasi. Reduksi adalah proses penerimaan elektron, sedangkan oksidasi adalah proses pelepasan elektron. Reaksi redoks dapat diidentifikasi melalui perubahan bilangan oksidasi pada atom-atom yang terlibat dalam reaksi.
Untuk menguji pemahaman Anda tentang reaksi redoks, berikut ini 5 soal latihan yang mencakup berbagai aspek, seperti penentuan bilangan oksidasi, pengenalan jenis reaksi, dan kesetimbangan reaksi. Soal latihan ini akan membantu Anda dalam mengasah kemampuan dalam menganalisis dan menyelesaikan masalah yang berkaitan dengan reaksi redoks.
Soal Latihan Reaksi Redoks
Berikut ini 5 soal latihan reaksi redoks yang meliputi berbagai aspek, seperti penentuan bilangan oksidasi, pengenalan jenis reaksi, dan kesetimbangan reaksi.
- Tentukan bilangan oksidasi atom Mn dalam senyawa KMnO4!
- Tentukan jenis reaksi redoks pada reaksi berikut: 2 FeCl2 + Cl2 → 2 FeCl3
- Setarakan reaksi redoks berikut dengan metode setengah reaksi: MnO4– + Fe2+ → Mn2+ + Fe3+ (dalam suasana asam)
- Tentukan bilangan oksidasi atom S dalam senyawa H2SO4!
- Tentukan jenis reaksi redoks pada reaksi berikut: 2 H2S + SO2 → 3 S + 2 H2O
Kunci Jawaban
Berikut adalah kunci jawaban untuk soal latihan reaksi redoks di atas:
- Bilangan oksidasi atom Mn dalam senyawa KMnO4 adalah +7.
- Jenis reaksi redoks pada reaksi 2 FeCl2 + Cl2 → 2 FeCl3 adalah reaksi oksidasi. Fe2+ teroksidasi menjadi Fe3+, sedangkan Cl2 tereduksi menjadi Cl–.
- Reaksi redoks MnO4– + Fe2+ → Mn2+ + Fe3+ (dalam suasana asam) dapat disetarakan dengan metode setengah reaksi sebagai berikut:
- Setarakan atom Mn pada kedua ruas: MnO4– → Mn2+
- Tambahkan H2O untuk menyeimbangkan atom O: MnO4– → Mn2+ + 4 H2O
- Tambahkan H+ untuk menyeimbangkan atom H: MnO4– + 8 H+ → Mn2+ + 4 H2O
- Tambahkan elektron untuk menyeimbangkan muatan: MnO4– + 8 H+ + 5 e– → Mn2+ + 4 H2O
- Setarakan atom Fe pada kedua ruas: Fe2+ → Fe3+
- Tambahkan elektron untuk menyeimbangkan muatan: Fe2+ → Fe3+ + e–
- Kalikan persamaan reaksi kedua dengan 5 untuk menyamakan jumlah elektron yang ditransfer: 5 Fe2+ → 5 Fe3+ + 5 e–
- Jumlahkan kedua persamaan reaksi: MnO4– + 8 H+ + 5 Fe2+ → Mn2+ + 4 H2O + 5 Fe3+
- Bilangan oksidasi atom S dalam senyawa H2SO4 adalah +6.
- Jenis reaksi redoks pada reaksi 2 H2S + SO2 → 3 S + 2 H2O adalah reaksi disproporsionasi. Atom S dalam H2S mengalami oksidasi menjadi S, sedangkan atom S dalam SO2 mengalami reduksi menjadi S.
Metode Setengah Reaksi
Metode setengah reaksi merupakan salah satu metode yang umum digunakan untuk menyeimbangkan reaksi redoks. Metode ini melibatkan pemisahan reaksi redoks menjadi dua setengah reaksi, yaitu setengah reaksi oksidasi dan setengah reaksi reduksi. Berikut adalah langkah-langkah untuk menyeimbangkan reaksi redoks dengan metode setengah reaksi:
- Pisahkan reaksi redoks menjadi dua setengah reaksi, yaitu setengah reaksi oksidasi dan setengah reaksi reduksi.
- Setarakan atom selain H dan O pada setiap setengah reaksi.
- Setarakan atom O dengan menambahkan H2O pada ruas yang kekurangan atom O.
- Setarakan atom H dengan menambahkan H+ pada ruas yang kekurangan atom H.
- Setarakan muatan dengan menambahkan elektron (e–) pada ruas yang memiliki muatan lebih positif.
- Kalikan kedua setengah reaksi dengan faktor yang sesuai agar jumlah elektron yang ditransfer pada kedua setengah reaksi sama.
- Jumlahkan kedua setengah reaksi dan sederhanakan.
Contoh: Setarakan reaksi redoks berikut dengan metode setengah reaksi: MnO4– + Fe2+ → Mn2+ + Fe3+ (dalam suasana asam)
- Pisahkan reaksi redoks menjadi dua setengah reaksi:
- Setengah reaksi oksidasi: Fe2+ → Fe3+
- Setengah reaksi reduksi: MnO4– → Mn2+
- Setarakan atom selain H dan O pada setiap setengah reaksi:
- Setengah reaksi oksidasi: Fe2+ → Fe3+
- Setengah reaksi reduksi: MnO4– → Mn2+
- Setarakan atom O dengan menambahkan H2O pada ruas yang kekurangan atom O:
- Setengah reaksi oksidasi: Fe2+ → Fe3+
- Setengah reaksi reduksi: MnO4– → Mn2+ + 4 H2O
- Setarakan atom H dengan menambahkan H+ pada ruas yang kekurangan atom H:
- Setengah reaksi oksidasi: Fe2+ → Fe3+
- Setengah reaksi reduksi: MnO4– + 8 H+ → Mn2+ + 4 H2O
- Setarakan muatan dengan menambahkan elektron (e–) pada ruas yang memiliki muatan lebih positif:
- Setengah reaksi oksidasi: Fe2+ → Fe3+ + e–
- Setengah reaksi reduksi: MnO4– + 8 H+ + 5 e– → Mn2+ + 4 H2O
- Kalikan kedua setengah reaksi dengan faktor yang sesuai agar jumlah elektron yang ditransfer pada kedua setengah reaksi sama:
- Setengah reaksi oksidasi: 5 Fe2+ → 5 Fe3+ + 5 e–
- Setengah reaksi reduksi: MnO4– + 8 H+ + 5 e– → Mn2+ + 4 H2O
- Jumlahkan kedua setengah reaksi dan sederhanakan:
- MnO4– + 8 H+ + 5 Fe2+ → Mn2+ + 4 H2O + 5 Fe3+
Soal Ujian Reaksi Redoks
Reaksi redoks merupakan reaksi kimia yang melibatkan perpindahan elektron. Reaksi ini sangat penting dalam berbagai bidang, seperti kimia, biologi, dan industri. Untuk menguji pemahaman siswa tentang reaksi redoks, guru dapat memberikan soal ujian yang menantang kemampuan mereka dalam mengidentifikasi, menyeimbangkan, dan menerapkan konsep reaksi redoks.
Contoh Soal Ujian Reaksi Redoks
Berikut adalah contoh soal ujian reaksi redoks dengan tingkat kesulitan yang berbeda:
-
Tentukan bilangan oksidasi atom Mn dalam senyawa KMnO4!
-
Setarakan reaksi redoks berikut dengan metode setengah reaksi dalam suasana asam:
MnO4–(aq) + Fe2+(aq) → Mn2+(aq) + Fe3+(aq)
-
Dalam reaksi redoks berikut, tentukan zat yang berperan sebagai oksidator dan reduktor:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Petunjuk Pengerjaan Soal Ujian Reaksi Redoks
Berikut adalah beberapa petunjuk yang dapat membantu siswa dalam mengerjakan soal ujian reaksi redoks:
-
Pahami definisi reaksi redoks dan konsep bilangan oksidasi.
-
Mampu mengidentifikasi zat yang mengalami oksidasi dan reduksi.
-
Kuasai metode penyetaraan reaksi redoks, seperti metode setengah reaksi.
-
Latihlah dengan mengerjakan berbagai soal latihan.
Contoh soal reaksi redoks bisa berupa soal yang meminta kita untuk mengidentifikasi zat yang berperan sebagai oksidator dan reduktor, atau soal yang meminta kita untuk menentukan perubahan bilangan oksidasi. Untuk membuat soal yang menantang, kamu bisa merujuk pada contoh perintah soal pilihan ganda di sini untuk mendapatkan inspirasi.
Dengan begitu, soal reaksi redoks yang kamu buat akan lebih variatif dan menarik, dan bisa menguji kemampuan berpikir kritis siswa.
Cara Mengevaluasi Jawaban Soal Ujian Reaksi Redoks
Untuk mengevaluasi jawaban soal ujian reaksi redoks, guru dapat menggunakan beberapa kriteria, yaitu:
-
Kemampuan siswa dalam menentukan bilangan oksidasi atom dalam senyawa.
-
Kemampuan siswa dalam mengidentifikasi zat yang mengalami oksidasi dan reduksi.
-
Kemampuan siswa dalam menyetarakan reaksi redoks dengan metode yang tepat.
-
Kemampuan siswa dalam menerapkan konsep reaksi redoks dalam berbagai contoh soal.
Soal Cerita Reaksi Redoks
Soal cerita reaksi redoks dapat menjadi cara yang menarik dan menantang untuk menguji pemahamanmu tentang konsep reaksi redoks. Dalam soal cerita, kamu akan dihadapkan pada skenario nyata yang melibatkan perubahan bilangan oksidasi, yang mengharuskan kamu untuk menganalisis dan menyelesaikan masalah dengan menggunakan pengetahuan reaksi redoks.
Contoh Soal Cerita Reaksi Redoks
Berikut adalah contoh soal cerita reaksi redoks yang dapat kamu coba selesaikan:
Di sebuah laboratorium kimia, seorang ilmuwan bernama Dr. Amelia sedang melakukan penelitian tentang baterai lithium-ion. Dia ingin mengetahui bagaimana reaksi redoks yang terjadi di dalam baterai tersebut dapat menghasilkan arus listrik. Dia menyiapkan dua elektroda, yaitu elektroda anode yang terbuat dari lithium dan elektroda katoda yang terbuat dari kobalt oksida (CoO2). Kedua elektroda tersebut dihubungkan dengan sebuah sirkuit listrik dan direndam dalam larutan elektrolit. Ketika baterai tersebut dihidupkan, lithium di anode mengalami oksidasi dan melepaskan elektron. Elektron tersebut mengalir melalui sirkuit listrik menuju katoda, di mana kobalt oksida mengalami reduksi dan menerima elektron. Proses ini menghasilkan arus listrik yang dapat digunakan untuk menyalakan perangkat elektronik.
Persamaan reaksi yang terjadi di dalam baterai lithium-ion adalah:
Anode (Oksidasi): Li(s) → Li+(aq) + e-
Katoda (Reduksi): CoO2(s) + Li+(aq) + e- → LiCoO2(s)
Pertanyaan:
- Identifikasi zat yang mengalami oksidasi dan reduksi dalam reaksi redoks yang terjadi di dalam baterai lithium-ion.
- Jelaskan perubahan bilangan oksidasi yang terjadi pada lithium dan kobalt dalam reaksi redoks tersebut.
- Apa peran elektrolit dalam reaksi redoks di dalam baterai lithium-ion?
Petunjuk Menyelesaikan Soal Cerita Reaksi Redoks
Berikut beberapa petunjuk yang dapat membantumu menyelesaikan soal cerita reaksi redoks:
- Identifikasi zat-zat yang terlibat dalam reaksi redoks dan tuliskan persamaan reaksinya.
- Tentukan bilangan oksidasi setiap atom dalam reaktan dan produk.
- Identifikasi zat yang mengalami peningkatan bilangan oksidasi (oksidasi) dan zat yang mengalami penurunan bilangan oksidasi (reduksi).
- Tuliskan setengah reaksi oksidasi dan setengah reaksi reduksi.
- Seimbangkan persamaan reaksi redoks dengan menggunakan metode setengah reaksi.
- Hubungkan persamaan reaksi redoks dengan skenario cerita yang diberikan.
Soal Reaksi Redoks Berbasis Gambar: Contoh Soal Reaksi Redoks
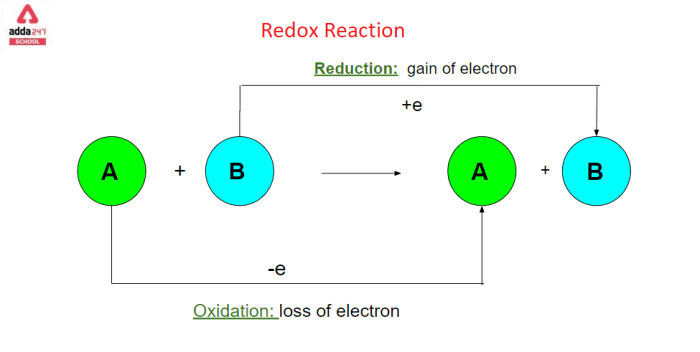
Soal reaksi redoks berbasis gambar merupakan cara menarik untuk menguji pemahaman siswa tentang konsep redoks dalam konteks nyata. Dengan menggunakan gambar, siswa dapat mengamati proses kimia secara visual dan menghubungkannya dengan konsep redoks. Hal ini membuat pembelajaran lebih interaktif dan mudah dipahami.
Cara Menganalisis Gambar untuk Menjawab Soal Reaksi Redoks
Untuk menganalisis gambar dan menjawab soal reaksi redoks, siswa perlu memperhatikan beberapa aspek penting, antara lain:
- Identifikasi zat-zat yang terlibat dalam reaksi. Perhatikan perubahan warna, pembentukan endapan, atau perubahan bentuk zat.
- Tentukan bilangan oksidasi setiap atom dalam zat-zat yang terlibat. Perubahan bilangan oksidasi menunjukkan terjadinya reaksi redoks.
- Identifikasi zat yang mengalami oksidasi (kehilangan elektron) dan zat yang mengalami reduksi (mendapatkan elektron).
- Tuliskan persamaan reaksi redoks yang terjadi, termasuk penyetaraan reaksi.
Contoh Ilustrasi Gambar Reaksi Redoks pada Proses Korosi
Korosi adalah proses elektrokimia yang melibatkan reaksi redoks. Ilustrasi gambar berikut menunjukkan proses korosi pada logam besi:
Gambar menunjukkan sepotong logam besi yang terendam dalam air. Permukaan besi tampak berkarat, berwarna coklat kemerahan. Di sekitar permukaan besi, terlihat gelembung-gelembung gas hidrogen.
- Pada proses korosi, besi (Fe) mengalami oksidasi menjadi ion besi (Fe2+) dan melepaskan elektron. Reaksi ini terjadi di anoda.
- Elektron yang dilepaskan oleh besi akan berpindah ke katoda, di mana air (H2O) mengalami reduksi menjadi gas hidrogen (H2) dan ion hidroksida (OH–).
- Ion besi (Fe2+) dan ion hidroksida (OH–) kemudian bereaksi membentuk ion feri hidroksida (Fe(OH)3), yang merupakan karat.
Soal Reaksi Redoks Berbasis Gambar
Soal reaksi redoks berbasis gambar dapat dibuat dengan berbagai cara, misalnya:
- Menampilkan gambar proses korosi pada berbagai logam, seperti tembaga, aluminium, atau seng, dan meminta siswa untuk menuliskan persamaan reaksi redoks yang terjadi.
- Menampilkan gambar sel elektrokimia, seperti sel Daniell, dan meminta siswa untuk menentukan anoda, katoda, arah aliran elektron, dan reaksi redoks yang terjadi pada setiap elektroda.
- Menampilkan gambar reaksi redoks dalam kehidupan sehari-hari, seperti pembakaran kayu, reaksi fotosintesis, atau proses pengolahan air minum, dan meminta siswa untuk menganalisis reaksi redoks yang terjadi.
Contoh Soal
Berikut adalah contoh soal reaksi redoks berbasis gambar:
Gambar menunjukkan sebuah paku besi yang terendam dalam larutan asam cuka. Permukaan paku tampak berkarat, berwarna coklat kemerahan. Di sekitar permukaan paku, terlihat gelembung-gelembung gas hidrogen.
- Identifikasi zat-zat yang terlibat dalam reaksi.
- Tentukan bilangan oksidasi setiap atom dalam zat-zat yang terlibat.
- Identifikasi zat yang mengalami oksidasi dan zat yang mengalami reduksi.
- Tuliskan persamaan reaksi redoks yang terjadi, termasuk penyetaraan reaksi.
Soal Reaksi Redoks Berbasis Video
Menggunakan video sebagai media dalam soal reaksi redoks dapat memberikan pengalaman belajar yang lebih interaktif dan menarik. Video memungkinkan siswa untuk mengamati proses reaksi secara langsung, yang dapat membantu mereka memahami konsep reaksi redoks dengan lebih baik. Selain itu, video juga dapat menampilkan berbagai contoh reaksi redoks dalam kehidupan sehari-hari, sehingga siswa dapat melihat relevansi topik ini dengan dunia nyata.
Membuat Soal Reaksi Redoks Berbasis Video
Untuk membuat soal reaksi redoks berbasis video, kita perlu memilih video yang menampilkan proses reaksi redoks yang jelas. Video tersebut dapat berupa rekaman eksperimen, demonstrasi, atau bahkan animasi. Berikut adalah beberapa hal yang perlu diperhatikan dalam memilih video:
- Video harus menampilkan reaksi redoks yang jelas, dengan perubahan warna atau pembentukan endapan yang terlihat.
- Video harus memiliki kualitas gambar dan suara yang baik, sehingga mudah dipahami.
- Video harus memiliki durasi yang sesuai dengan tingkat kesulitan soal.
Menganalisis Video untuk Menjawab Soal Reaksi Redoks
Setelah memilih video yang tepat, kita dapat menganalisis video tersebut untuk menjawab soal reaksi redoks. Berikut adalah beberapa langkah yang dapat dilakukan:
- Identifikasi reaktan dan produk dalam reaksi redoks yang ditampilkan dalam video.
- Tentukan zat yang mengalami oksidasi dan zat yang mengalami reduksi.
- Tulis persamaan reaksi redoks yang terjadi.
- Tentukan bilangan oksidasi setiap atom dalam reaktan dan produk.
- Jelaskan perubahan bilangan oksidasi yang terjadi selama reaksi.
Contoh Video Reaksi Redoks dalam Pembakaran Bahan Bakar
Salah satu contoh reaksi redoks yang dapat diilustrasikan melalui video adalah pembakaran bahan bakar. Dalam video, kita dapat mengamati proses pembakaran bahan bakar seperti kayu, kertas, atau bensin. Pembakaran merupakan reaksi redoks yang melibatkan reaksi antara bahan bakar dengan oksigen. Bahan bakar mengalami oksidasi, sementara oksigen mengalami reduksi.
Video tersebut dapat menunjukkan perubahan warna, pembentukan asap, dan pelepasan panas sebagai bukti terjadinya reaksi redoks. Siswa dapat menganalisis video tersebut untuk menentukan reaktan, produk, zat yang mengalami oksidasi dan reduksi, serta menulis persamaan reaksi redoks yang terjadi.
Soal Reaksi Redoks Berbasis Simulasi
Simulasi komputer merupakan alat bantu yang efektif dalam mempelajari konsep reaksi redoks. Simulasi memungkinkan visualisasi proses yang kompleks, seperti pergerakan elektron dan perubahan bilangan oksidasi, sehingga lebih mudah dipahami.
Simulasi Reaksi Redoks dalam Sel Elektrokimia
Simulasi komputer dapat membantu memahami proses reaksi redoks dalam sel elektrokimia. Misalnya, simulasi dapat menunjukkan pergerakan ion dalam larutan elektrolit, pergerakan elektron melalui sirkuit eksternal, dan perubahan potensial pada elektroda. Simulasi ini dapat membantu menjawab pertanyaan tentang bagaimana konsentrasi reaktan, temperatur, dan jenis elektroda memengaruhi potensial sel dan arus yang dihasilkan.
- Simulasi dapat menunjukkan bagaimana perubahan konsentrasi ion logam dalam larutan elektrolit memengaruhi potensial sel. Misalnya, jika konsentrasi ion logam pada anoda meningkat, potensial sel akan menjadi lebih positif.
- Simulasi dapat menunjukkan bagaimana perubahan temperatur memengaruhi kecepatan reaksi redoks. Misalnya, peningkatan temperatur dapat mempercepat reaksi redoks, sehingga arus yang dihasilkan akan meningkat.
- Simulasi dapat menunjukkan bagaimana jenis elektroda memengaruhi potensial sel. Misalnya, elektroda yang terbuat dari logam yang lebih reaktif akan memiliki potensial sel yang lebih negatif dibandingkan dengan elektroda yang terbuat dari logam yang kurang reaktif.
Contoh Simulasi Sel Elektrokimia
Misalnya, simulasi sel elektrokimia untuk reaksi antara seng dan tembaga dapat menunjukkan bagaimana elektron berpindah dari seng ke tembaga, membentuk seng(II) dan tembaga(0). Simulasi ini dapat menampilkan perubahan bilangan oksidasi pada seng dan tembaga, serta pergerakan ion dalam larutan elektrolit.
Simulasi ini membantu memahami konsep dasar reaksi redoks dalam sel elektrokimia, seperti pergerakan elektron, perubahan bilangan oksidasi, dan pengaruh konsentrasi reaktan dan temperatur pada potensial sel.
Kesimpulan
Memahami konsep reaksi redoks merupakan langkah penting dalam mempelajari kimia. Melalui contoh soal yang telah dibahas, diharapkan Anda dapat lebih memahami dan menguasai konsep reaksi redoks. Ingat, latihan adalah kunci untuk menguasai suatu materi. Semakin banyak soal yang Anda kerjakan, semakin mahir Anda dalam menyelesaikan soal-soal reaksi redoks.




