Sistem periodik unsur, sebuah peta kimia yang mengagumkan, menyimpan rahasia tentang perilaku dan sifat setiap unsur. Dengan memahami sistem periodik, kita dapat menjelajahi dunia kimia dengan lebih mudah. Dalam artikel ini, kita akan mengupas contoh soal sistem periodik unsur beserta jawabannya, membantu Anda mengasah pemahaman dan menguasai konsep kimia yang penting.
Dari penemuannya hingga aplikasi praktisnya, sistem periodik unsur telah menjadi alat penting dalam kimia. Mempelajari sistem periodik membantu kita memahami bagaimana unsur-unsur dikelompokkan berdasarkan sifat-sifatnya, bagaimana mereka bereaksi satu sama lain, dan bagaimana mereka digunakan dalam berbagai bidang. Mari kita selami contoh soal yang akan mengantarkan Anda pada pemahaman yang lebih dalam tentang sistem periodik unsur.
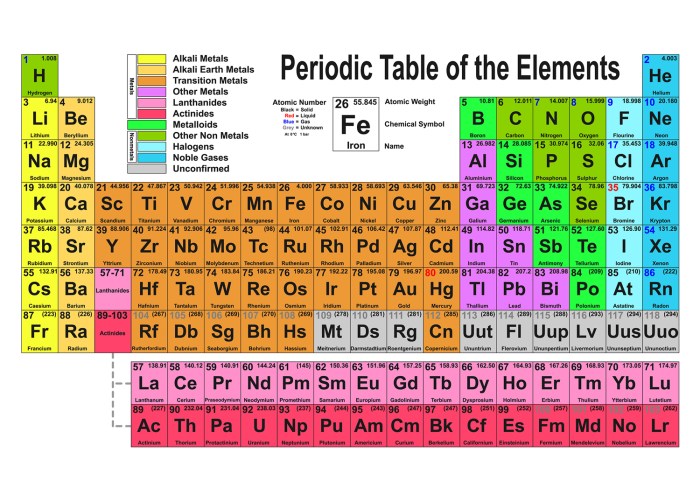
Sistem Periodik Unsur
Sistem periodik unsur adalah tabel yang mengorganisasikan semua unsur kimia berdasarkan sifat-sifat kimia dan fisika mereka. Sistem periodik merupakan alat yang sangat penting dalam kimia karena memungkinkan kita untuk memahami hubungan antara unsur-unsur dan memprediksi bagaimana mereka akan bereaksi.
Sejarah Singkat Penemuan Sistem Periodik Unsur
Sistem periodik unsur telah berkembang selama berabad-abad, dengan banyak ilmuwan yang berkontribusi pada pengembangannya. Pada awal abad ke-19, para ilmuwan mulai mengklasifikasikan unsur-unsur berdasarkan sifat-sifat mereka. Misalnya, Döbereiner (1817) mengamati bahwa beberapa unsur memiliki sifat-sifat yang mirip, seperti klorin, bromin, dan iodin.
Pada tahun 1869, Dmitri Mendeleev, seorang ilmuwan Rusia, menerbitkan sistem periodik unsur pertamanya. Mendeleev mengatur unsur-unsur berdasarkan massa atomnya dan mengamati bahwa sifat-sifat unsur-unsur berulang secara periodik. Dia juga berani memprediksi keberadaan unsur-unsur baru yang belum ditemukan pada saat itu, dan memprediksi sifat-sifatnya. Prediksi Mendeleev terbukti benar ketika unsur-unsur tersebut kemudian ditemukan.
Dasar Pengelompokan Unsur-Unsur dalam Sistem Periodik
Sistem periodik modern didasarkan pada nomor atom unsur, yang merupakan jumlah proton dalam inti atom. Unsur-unsur dalam sistem periodik disusun dalam tujuh periode (baris) dan 18 golongan (kolom).
- Periode: Periode menunjukkan jumlah kulit elektron yang dimiliki oleh atom unsur tersebut. Misalnya, unsur-unsur pada periode 1 memiliki satu kulit elektron, sedangkan unsur-unsur pada periode 2 memiliki dua kulit elektron.
- Golongan: Golongan menunjukkan jumlah elektron valensi yang dimiliki oleh atom unsur tersebut. Elektron valensi adalah elektron yang berada pada kulit terluar atom dan bertanggung jawab untuk ikatan kimia. Misalnya, unsur-unsur pada golongan 1 memiliki satu elektron valensi, sedangkan unsur-unsur pada golongan 2 memiliki dua elektron valensi.
Contoh Penggunaan Sistem Periodik Unsur dalam Kimia
Sistem periodik unsur merupakan alat yang sangat penting dalam kimia. Berikut beberapa contoh bagaimana sistem periodik unsur digunakan dalam kimia:
- Memprediksi Sifat Unsur: Sistem periodik memungkinkan kita untuk memprediksi sifat-sifat unsur, seperti titik leleh, titik didih, dan reaktivitas. Misalnya, kita dapat melihat bahwa unsur-unsur dalam golongan 1 (logam alkali) sangat reaktif dan mudah bereaksi dengan air.
- Memprediksi Reaksi Kimia: Sistem periodik juga dapat digunakan untuk memprediksi bagaimana unsur-unsur akan bereaksi satu sama lain. Misalnya, kita dapat melihat bahwa unsur-unsur dalam golongan 17 (halogen) sangat reaktif dan cenderung membentuk senyawa ionik dengan unsur-unsur logam.
- Menentukan Jumlah Elektron Valensi: Sistem periodik juga dapat digunakan untuk menentukan jumlah elektron valensi yang dimiliki oleh atom unsur tersebut. Informasi ini sangat penting untuk memahami bagaimana unsur-unsur berikatan satu sama lain.
Struktur Sistem Periodik Unsur
Sistem periodik unsur merupakan suatu tabel yang menyusun semua unsur kimia yang diketahui berdasarkan sifat-sifat kimia dan fisika yang mirip. Sistem periodik ini disusun dengan cermat sehingga memberikan informasi yang berharga tentang perilaku unsur-unsur dan bagaimana mereka berinteraksi satu sama lain.
Periode dan Golongan dalam Sistem Periodik
Sistem periodik disusun dalam bentuk tabel dengan baris dan kolom. Baris horizontal disebut periode, sedangkan kolom vertikal disebut golongan.
- Periode menunjukkan jumlah kulit elektron utama yang dimiliki atom unsur tersebut. Unsur-unsur dalam satu periode memiliki jumlah kulit elektron yang sama. Sebagai contoh, unsur-unsur pada periode 2 memiliki 2 kulit elektron utama.
- Golongan menunjukkan jumlah elektron valensi (elektron pada kulit terluar) yang dimiliki atom unsur tersebut. Unsur-unsur dalam satu golongan memiliki jumlah elektron valensi yang sama. Sebagai contoh, unsur-unsur pada golongan 1 (alkali) memiliki 1 elektron valensi, sedangkan unsur-unsur pada golongan 17 (halogen) memiliki 7 elektron valensi.
Hubungan Nomor Atom dan Nomor Massa dengan Posisi Unsur
Nomor atom dan nomor massa unsur memiliki peran penting dalam menentukan posisi unsur dalam sistem periodik.
- Nomor atom menunjukkan jumlah proton dalam inti atom unsur. Nomor atom menentukan identitas suatu unsur. Posisi unsur dalam sistem periodik ditentukan oleh nomor atomnya.
- Nomor massa menunjukkan jumlah proton dan neutron dalam inti atom unsur. Nomor massa tidak menentukan posisi unsur dalam sistem periodik, namun dapat digunakan untuk membedakan isotop dari suatu unsur. Isotop adalah atom dari unsur yang sama tetapi memiliki jumlah neutron yang berbeda.
Perbedaan Unsur Logam, Non-logam, dan Metalloid
Berdasarkan sifat-sifatnya, unsur-unsur dapat dikelompokkan menjadi tiga jenis: logam, non-logam, dan metalloid.
| Sifat | Logam | Non-logam | Metalloid |
|---|---|---|---|
| Kilau | Berkilau | Tidak berkilau | Berkilau redup |
| Kekerasan | Keras | Lunak | Beragam |
| Konduktivitas | Konduktor listrik dan panas yang baik | Konduktor listrik dan panas yang buruk | Konduktor listrik dan panas yang sedang |
| Keadaan fisik | Padat (kecuali merkuri) | Padat, cair, atau gas | Padat |
| Reaktivitas | Reaaktif | Kurang reaktif | Beragam |
| Contoh | Besi, emas, aluminium | Oksigen, karbon, nitrogen | Silikon, germanium, arsenik |
Sifat-Sifat Unsur Berdasarkan Letaknya dalam Sistem Periodik
Sistem periodik unsur merupakan alat yang sangat berguna untuk memahami sifat-sifat unsur dan bagaimana sifat-sifat tersebut berubah secara periodik. Dengan memahami tren periodik sifat-sifat unsur, kita dapat memprediksi bagaimana suatu unsur akan bereaksi dengan unsur lainnya dan bagaimana sifat-sifat suatu senyawa akan berubah berdasarkan unsur-unsur yang membentuknya.
Tren Periodik Sifat-Sifat Unsur
Beberapa sifat-sifat unsur yang menunjukkan tren periodik meliputi:
- Jari-jari atom
- Energi ionisasi
- Afinitas elektron
- Elektronegativitas
Jari-jari Atom
Jari-jari atom adalah jarak antara inti atom dengan kulit elektron terluar. Tren periodik jari-jari atom adalah sebagai berikut:
- Jari-jari atom meningkat dari atas ke bawah dalam satu golongan. Hal ini disebabkan karena jumlah kulit elektron semakin banyak sehingga jarak antara inti atom dengan kulit elektron terluar semakin besar.
- Jari-jari atom menurun dari kiri ke kanan dalam satu periode. Hal ini disebabkan karena jumlah proton dalam inti atom semakin banyak sehingga tarikan inti atom terhadap elektron terluar semakin kuat, akibatnya jarak antara inti atom dengan kulit elektron terluar semakin kecil.
Energi Ionisasi
Energi ionisasi adalah energi minimum yang diperlukan untuk melepaskan satu elektron dari atom netral dalam keadaan gas. Tren periodik energi ionisasi adalah sebagai berikut:
- Energi ionisasi menurun dari atas ke bawah dalam satu golongan. Hal ini disebabkan karena elektron terluar semakin jauh dari inti atom sehingga lebih mudah dilepas.
- Energi ionisasi meningkat dari kiri ke kanan dalam satu periode. Hal ini disebabkan karena tarikan inti atom terhadap elektron terluar semakin kuat sehingga lebih sulit untuk melepaskan elektron.
Afinitas Elektron
Afinitas elektron adalah perubahan energi yang terjadi ketika sebuah atom netral dalam keadaan gas menerima satu elektron. Tren periodik afinitas elektron adalah sebagai berikut:
- Afinitas elektron menurun dari atas ke bawah dalam satu golongan. Hal ini disebabkan karena elektron terluar semakin jauh dari inti atom sehingga kurang tertarik untuk menerima elektron tambahan.
- Afinitas elektron meningkat dari kiri ke kanan dalam satu periode. Hal ini disebabkan karena tarikan inti atom terhadap elektron terluar semakin kuat sehingga lebih mudah untuk menerima elektron tambahan.
Elektronegativitas
Elektronegativitas adalah kemampuan suatu atom untuk menarik elektron dalam ikatan kimia. Tren periodik elektronegativitas adalah sebagai berikut:
- Elektronegativitas menurun dari atas ke bawah dalam satu golongan. Hal ini disebabkan karena elektron terluar semakin jauh dari inti atom sehingga kurang tertarik untuk menarik elektron dari atom lain.
- Elektronegativitas meningkat dari kiri ke kanan dalam satu periode. Hal ini disebabkan karena tarikan inti atom terhadap elektron terluar semakin kuat sehingga lebih mudah untuk menarik elektron dari atom lain.
Contoh Soal dan Penyelesaian, Contoh soal sistem periodik unsur beserta jawabannya
Berikut adalah contoh soal yang melibatkan tren periodik sifat-sifat unsur:
Manakah dari unsur berikut yang memiliki energi ionisasi terendah: Li, Na, K, Rb, Cs?
Langkah-langkah penyelesaiannya adalah:
- Identifikasi letak unsur-unsur tersebut dalam sistem periodik.
- Ingat bahwa energi ionisasi menurun dari atas ke bawah dalam satu golongan.
- Oleh karena itu, unsur yang memiliki energi ionisasi terendah adalah Cs karena letaknya paling bawah dalam golongan tersebut.
Contoh Soal Sistem Periodik Unsur
Sistem periodik unsur merupakan alat yang sangat berguna untuk memahami sifat dan perilaku unsur-unsur kimia. Dengan mempelajari sistem periodik, kita dapat memprediksi sifat-sifat suatu unsur, memahami bagaimana unsur-unsur bereaksi satu sama lain, dan bahkan mempelajari tentang sejarah penemuan unsur-unsur baru. Dalam artikel ini, kita akan membahas beberapa contoh soal yang berkaitan dengan sistem periodik unsur.
Penentuan Nomor Atom dan Nomor Massa Unsur Berdasarkan Posisinya dalam Sistem Periodik
Nomor atom dan nomor massa merupakan dua informasi penting yang dapat kita peroleh dari sistem periodik. Nomor atom menunjukkan jumlah proton dalam inti atom suatu unsur, sedangkan nomor massa menunjukkan jumlah proton dan neutron dalam inti atom.
Berikut adalah beberapa contoh soal yang dapat membantu kita memahami bagaimana menentukan nomor atom dan nomor massa unsur berdasarkan posisinya dalam sistem periodik:
- Tentukan nomor atom dan nomor massa unsur X yang terletak pada periode 3 dan golongan VIIA dalam sistem periodik.
- Tentukan nomor atom dan nomor massa unsur Y yang memiliki 2 elektron valensi dan terletak pada periode 4 dalam sistem periodik.
- Tentukan nomor atom dan nomor massa unsur Z yang merupakan halogen dan memiliki 17 neutron dalam inti atomnya.
Penentuan Sifat-Sifat Unsur Berdasarkan Posisinya dalam Sistem Periodik
Sistem periodik unsur disusun berdasarkan sifat-sifat unsur yang cenderung berulang secara periodik. Beberapa sifat yang dapat kita prediksi berdasarkan posisi unsur dalam sistem periodik meliputi:
- Jari-jari atom
- Elektronegativitas
- Energi ionisasi
- Afinitas elektron
Berikut adalah beberapa contoh soal yang dapat membantu kita memahami bagaimana menentukan sifat-sifat unsur berdasarkan posisinya dalam sistem periodik:
- Manakah unsur yang memiliki jari-jari atom lebih besar: Na atau K?
- Manakah unsur yang memiliki elektronegativitas lebih tinggi: Cl atau Br?
- Manakah unsur yang memiliki energi ionisasi lebih rendah: Li atau Be?
- Manakah unsur yang memiliki afinitas elektron lebih tinggi: O atau S?
Penentuan Konfigurasi Elektron Unsur Berdasarkan Posisinya dalam Sistem Periodik
Konfigurasi elektron menunjukkan bagaimana elektron-elektron tersusun dalam atom. Dengan memahami konfigurasi elektron, kita dapat memprediksi sifat kimia suatu unsur. Sistem periodik dapat membantu kita menentukan konfigurasi elektron suatu unsur dengan lebih mudah.
Berikut adalah beberapa contoh soal yang dapat membantu kita memahami bagaimana menentukan konfigurasi elektron unsur berdasarkan posisinya dalam sistem periodik:
- Tentukan konfigurasi elektron unsur Ca yang terletak pada periode 4 dan golongan IIA dalam sistem periodik.
- Tentukan konfigurasi elektron unsur Br yang merupakan halogen dan terletak pada periode 4 dalam sistem periodik.
- Tentukan konfigurasi elektron unsur Fe yang memiliki 26 elektron dan terletak pada periode 4 dalam sistem periodik.
Pembahasan Soal Sistem Periodik Unsur
Sistem periodik unsur merupakan alat yang sangat berguna untuk memahami perilaku dan sifat kimia unsur-unsur. Dalam artikel ini, kita akan membahas beberapa contoh soal yang membahas tentang pembentukan ion dan senyawa ionik, pembentukan ikatan kovalen, serta sifat-sifat kimia unsur berdasarkan letaknya dalam sistem periodik.
Pembentukan Ion dan Senyawa Ionik
Pembentukan ion dan senyawa ionik merupakan konsep penting dalam kimia. Ion terbentuk ketika atom kehilangan atau mendapatkan elektron, menghasilkan muatan positif (kation) atau negatif (anion). Senyawa ionik terbentuk dari ikatan elektrostatik antara kation dan anion.
Nggak cuma contoh soal sistem periodik unsur beserta jawabannya yang bisa bikin kamu pusing, contoh soal lamaran pekerjaan juga bisa bikin keringetan, kan? Nah, buat kamu yang lagi nyiapin diri buat melamar kerja, coba deh cek contoh soal lamaran pekerjaan di link ini.
Soalnya, selain nentuin kamu paham tentang kimia, soal lamaran pekerjaan juga ngetes kemampuan kamu dalam menghadapi tantangan di dunia kerja. Jadi, latihan soal sistem periodik unsur dan soal lamaran pekerjaan, semuanya penting buat ngejar cita-cita kamu!
- Contoh Soal 1: Jelaskan pembentukan ion dan senyawa ionik yang terjadi ketika natrium (Na) bereaksi dengan klorin (Cl).
- Contoh Soal 2: Mengapa senyawa ionik umumnya memiliki titik leleh dan titik didih yang tinggi?
Pembentukan Ikatan Kovalen
Ikatan kovalen terjadi ketika dua atom berbagi elektron untuk mencapai konfigurasi elektron stabil. Ikatan kovalen dapat berupa ikatan tunggal, ganda, atau rangkap tiga, tergantung pada jumlah elektron yang dibagi.
- Contoh Soal 1: Jelaskan bagaimana ikatan kovalen terbentuk antara atom karbon (C) dan hidrogen (H) dalam molekul metana (CH4).
- Contoh Soal 2: Mengapa senyawa kovalen umumnya memiliki titik leleh dan titik didih yang rendah dibandingkan dengan senyawa ionik?
Sifat-Sifat Kimia Unsur Berdasarkan Letaknya dalam Sistem Periodik
Sistem periodik unsur disusun berdasarkan tren periodik, yaitu kecenderungan sifat kimia unsur yang berubah secara teratur berdasarkan letaknya dalam tabel. Tren periodik yang penting meliputi jari-jari atom, energi ionisasi, afinitas elektron, dan elektronegativitas.
- Contoh Soal 1: Jelaskan bagaimana jari-jari atom berubah dari kiri ke kanan dan dari atas ke bawah dalam sistem periodik.
- Contoh Soal 2: Mengapa energi ionisasi unsur-unsur golongan utama meningkat dari kiri ke kanan dan menurun dari atas ke bawah dalam sistem periodik?
Aplikasi Sistem Periodik Unsur
Sistem periodik unsur merupakan alat yang sangat berguna dalam berbagai bidang, mulai dari industri kimia hingga kesehatan dan pertanian. Susunan unsur-unsur dalam sistem periodik ini memberikan informasi penting tentang sifat kimia dan fisika setiap unsur, sehingga memudahkan para ilmuwan dan praktisi untuk memahami dan memprediksi perilaku unsur-unsur tersebut.
Aplikasi dalam Industri Kimia
Sistem periodik unsur merupakan alat yang sangat penting dalam industri kimia. Dengan memahami sifat-sifat unsur, para ahli kimia dapat memilih bahan yang tepat untuk berbagai proses kimia, seperti produksi pupuk, pembuatan obat-obatan, dan sintesis bahan-bahan baru.
- Contohnya, dalam industri pupuk, para ahli kimia menggunakan sistem periodik untuk menentukan jenis pupuk yang paling efektif untuk tanaman tertentu. Misalnya, pupuk nitrogen (N) dibutuhkan oleh tanaman untuk pertumbuhan, sedangkan pupuk fosfor (P) dibutuhkan untuk perkembangan akar. Sistem periodik membantu para ahli kimia untuk memahami sifat-sifat nitrogen dan fosfor, sehingga mereka dapat memilih jenis pupuk yang tepat untuk kebutuhan tanaman.
- Sistem periodik juga membantu para ahli kimia dalam proses pembuatan obat-obatan. Dengan memahami sifat-sifat unsur-unsur, para ahli kimia dapat merancang dan mensintesis molekul-molekul baru yang memiliki sifat farmakologis yang diinginkan. Contohnya, dalam pengembangan obat anti kanker, para ahli kimia menggunakan sistem periodik untuk memahami sifat-sifat unsur-unsur seperti platinum (Pt) dan emas (Au) yang digunakan dalam terapi kanker.
Aplikasi dalam Bidang Kesehatan
Sistem periodik unsur juga memiliki peran penting dalam bidang kesehatan. Unsur-unsur tertentu memiliki sifat khusus yang bermanfaat untuk kesehatan manusia, seperti kalsium (Ca) untuk tulang dan gigi, besi (Fe) untuk pembentukan sel darah merah, dan yodium (I) untuk produksi hormon tiroid.
- Para ahli kesehatan menggunakan sistem periodik untuk memahami kebutuhan tubuh akan unsur-unsur tertentu dan untuk menentukan kekurangan atau kelebihan unsur-unsur tersebut dalam tubuh. Misalnya, kekurangan zat besi dapat menyebabkan anemia, sedangkan kelebihan zat besi dapat menyebabkan kerusakan organ. Sistem periodik membantu para ahli kesehatan untuk memahami sifat-sifat zat besi dan menentukan dosis yang tepat untuk mengatasi kekurangan atau kelebihan zat besi dalam tubuh.
- Sistem periodik juga membantu para ahli kesehatan dalam memahami mekanisme kerja obat-obatan. Banyak obat-obatan mengandung unsur-unsur tertentu yang memiliki sifat terapeutik. Contohnya, obat-obatan untuk mengobati infeksi bakteri seringkali mengandung unsur-unsur seperti perak (Ag) dan tembaga (Cu) yang memiliki sifat antibakteri.
Aplikasi dalam Bidang Pertanian
Sistem periodik unsur sangat bermanfaat dalam bidang pertanian. Unsur-unsur seperti nitrogen (N), fosfor (P), dan kalium (K) merupakan nutrisi penting bagi tanaman. Para petani menggunakan sistem periodik untuk memahami kebutuhan nutrisi tanaman dan untuk memilih pupuk yang tepat untuk meningkatkan hasil panen.
- Contohnya, kekurangan nitrogen dapat menyebabkan pertumbuhan tanaman terhambat, sedangkan kekurangan fosfor dapat menyebabkan akar tanaman lemah. Sistem periodik membantu para petani untuk memahami sifat-sifat nitrogen dan fosfor, sehingga mereka dapat memilih jenis pupuk yang tepat untuk memenuhi kebutuhan nutrisi tanaman.
- Selain itu, sistem periodik juga membantu para petani dalam memahami dampak unsur-unsur tertentu terhadap tanah. Contohnya, penggunaan pupuk yang mengandung unsur-unsur seperti cadmium (Cd) dan merkuri (Hg) dapat mencemari tanah dan merugikan tanaman. Sistem periodik membantu para petani untuk memahami sifat-sifat unsur-unsur tersebut dan untuk menghindari penggunaan pupuk yang dapat mencemari tanah.
Pentingnya Mempelajari Sistem Periodik Unsur
Sistem periodik unsur merupakan alat yang sangat penting dalam memahami kimia. Ia mengatur semua unsur kimia yang diketahui berdasarkan sifat-sifatnya yang berulang. Mempelajari sistem periodik unsur membantu kita memahami bagaimana unsur-unsur berinteraksi satu sama lain dan bagaimana mereka membentuk senyawa. Dengan memahami sistem periodik, kita dapat memprediksi sifat-sifat unsur baru dan memahami reaksi kimia yang terjadi di sekitar kita.
Manfaat Mempelajari Sistem Periodik Unsur bagi Siswa Kimia
Mempelajari sistem periodik unsur sangat penting bagi siswa kimia karena:
- Memberikan pemahaman yang mendalam tentang sifat-sifat unsur, seperti elektronegativitas, energi ionisasi, dan afinitas elektron.
- Membantu memprediksi reaksi kimia yang mungkin terjadi antara unsur-unsur.
- Memudahkan dalam mempelajari dan mengingat sifat-sifat unsur, sehingga lebih mudah untuk memahami konsep kimia yang lebih kompleks.
- Menyediakan kerangka kerja untuk memahami struktur atom dan ikatan kimia.
Memahami Sifat-Sifat Unsur dan Reaksi Kimia
Sistem periodik unsur mengorganisir unsur-unsur berdasarkan kesamaan sifat-sifatnya. Unsur-unsur dalam satu golongan (kolom) memiliki jumlah elektron valensi yang sama, sehingga memiliki sifat kimia yang mirip. Contohnya, semua unsur dalam golongan 1 (alkali) sangat reaktif dan mudah membentuk ion bermuatan +1.
Selain itu, sistem periodik membantu kita memahami bagaimana unsur-unsur bereaksi satu sama lain. Unsur-unsur yang terletak di dekat satu sama lain dalam sistem periodik cenderung membentuk ikatan kimia yang kuat, sementara unsur-unsur yang jauh lebih berbeda cenderung membentuk ikatan yang lebih lemah. Dengan memahami tren periodik, kita dapat memprediksi bagaimana unsur-unsur akan bereaksi dan membentuk senyawa baru.
Pengembangan Teknologi Baru
Pemahaman tentang sistem periodik unsur telah berperan penting dalam pengembangan teknologi baru. Misalnya, penemuan silikon dan germanium, yang terletak di golongan 14, telah memungkinkan pengembangan transistor dan komputer. Unsur-unsur tanah jarang, yang terletak di bagian bawah sistem periodik, digunakan dalam berbagai aplikasi teknologi tinggi, seperti laser, magnet, dan baterai.
Selain itu, sistem periodik membantu kita memahami bagaimana unsur-unsur dapat digunakan untuk membuat bahan-bahan baru dengan sifat-sifat yang unik. Contohnya, penggunaan karbon dalam bentuk berlian dan grafit menghasilkan bahan-bahan dengan sifat fisik yang sangat berbeda. Pemahaman tentang tren periodik memungkinkan kita untuk merancang bahan-bahan baru dengan sifat-sifat yang disesuaikan dengan kebutuhan spesifik.
Soal Latihan Sistem Periodik Unsur: Contoh Soal Sistem Periodik Unsur Beserta Jawabannya
Sistem periodik unsur adalah salah satu konsep penting dalam kimia yang membantu kita memahami sifat dan perilaku unsur-unsur. Untuk menguji pemahaman kamu tentang sistem periodik, berikut beberapa soal latihan dengan tingkat kesulitan yang berbeda.
Soal Latihan Tingkat Dasar
Soal-soal ini menguji pemahaman dasar tentang sistem periodik, seperti letak unsur dalam tabel periodik, golongan, periode, dan sifat-sifat dasar unsur.
- Tentukan letak unsur Natrium (Na) dalam tabel periodik, berdasarkan golongan dan periode.
- Sebutkan tiga unsur yang berada dalam golongan halogen.
- Jelaskan perbedaan sifat antara unsur logam dan non-logam.
Soal Latihan Tingkat Menengah
Soal-soal ini menguji pemahaman tentang hubungan antara konfigurasi elektron dengan sifat unsur, serta aplikasi sistem periodik dalam kimia.
- Tentukan konfigurasi elektron unsur Kalium (K) dan jelaskan bagaimana konfigurasi elektron tersebut mempengaruhi sifat kimianya.
- Jelaskan bagaimana tren keelektronegatifan unsur berubah dalam tabel periodik.
- Gunakan sistem periodik untuk memprediksi sifat kimia dari senyawa yang terbentuk antara unsur Natrium (Na) dan Klorin (Cl).
Soal Latihan Tingkat Lanjut
Soal-soal ini menguji pemahaman tentang konsep-konsep yang lebih kompleks dalam sistem periodik, seperti sifat periodik, tren, dan aplikasi dalam kimia.
- Jelaskan bagaimana sifat periodik unsur dapat dijelaskan berdasarkan teori orbital atom.
- Jelaskan hubungan antara jari-jari atom dan energi ionisasi dalam tabel periodik.
- Gunakan sistem periodik untuk menjelaskan mengapa unsur-unsur dalam golongan alkali sangat reaktif.
Kunci Jawaban
Berikut kunci jawaban untuk soal-soal latihan di atas:
- Natrium (Na) terletak pada golongan 1 (alkali) dan periode 3 dalam tabel periodik.
- Tiga unsur yang berada dalam golongan halogen adalah Fluor (F), Klorin (Cl), dan Brom (Br).
- Unsur logam umumnya memiliki sifat lunak, konduktor listrik dan panas yang baik, dan mudah bereaksi dengan non-logam. Unsur non-logam umumnya keras, isolator listrik dan panas, dan mudah bereaksi dengan logam.
- Konfigurasi elektron Kalium (K) adalah 1s22s22p63s23p64s1. Konfigurasi elektron ini menunjukkan bahwa Kalium memiliki satu elektron valensi pada kulit terluar, yang membuatnya mudah melepaskan elektron dan membentuk ion positif (K+). Hal ini menyebabkan Kalium menjadi unsur yang sangat reaktif.
- Keelektronegatifan unsur meningkat dari kiri ke kanan dalam tabel periodik dan menurun dari atas ke bawah. Ini karena semakin banyak elektron valensi yang dimiliki unsur, semakin kuat tarik menarik antara inti atom dengan elektron valensi, sehingga semakin mudah unsur tersebut menarik elektron.
- Senyawa yang terbentuk antara Natrium (Na) dan Klorin (Cl) adalah Natrium Klorida (NaCl). Natrium adalah logam alkali yang mudah melepaskan elektron dan membentuk ion positif (Na+). Klorin adalah halogen yang mudah menarik elektron dan membentuk ion negatif (Cl–). Ion-ion ini kemudian saling tarik menarik dan membentuk senyawa ionik NaCl.
- Teori orbital atom menjelaskan bahwa elektron dalam atom menempati orbital-orbital tertentu dengan tingkat energi yang berbeda. Sifat periodik unsur dapat dijelaskan berdasarkan konfigurasi elektron dalam orbital-orbital tersebut. Misalnya, jari-jari atom meningkat dari atas ke bawah dalam tabel periodik karena penambahan kulit elektron baru. Energi ionisasi menurun dari atas ke bawah karena elektron valensi semakin jauh dari inti atom, sehingga lebih mudah untuk dilepaskan.
- Jari-jari atom meningkat dari atas ke bawah dalam tabel periodik karena penambahan kulit elektron baru. Energi ionisasi menurun dari atas ke bawah karena elektron valensi semakin jauh dari inti atom, sehingga lebih mudah untuk dilepaskan.
- Unsur-unsur dalam golongan alkali memiliki satu elektron valensi pada kulit terluar. Karena elektron valensi ini mudah dilepaskan, unsur-unsur alkali sangat reaktif dan mudah membentuk ion positif (M+) dengan melepaskan elektron tersebut.
Tips Menyelesaikan Soal Sistem Periodik Unsur
Berikut beberapa tips yang dapat membantu kamu menyelesaikan soal-soal sistem periodik unsur:
- Pahami konsep dasar sistem periodik, seperti golongan, periode, dan sifat-sifat unsur.
- Pelajari konfigurasi elektron dan bagaimana konfigurasi elektron mempengaruhi sifat unsur.
- Latihlah diri kamu dengan mengerjakan soal-soal latihan dan contoh soal.
- Gunakan tabel periodik sebagai alat bantu untuk menyelesaikan soal.
- Jangan ragu untuk bertanya kepada guru atau teman jika kamu mengalami kesulitan.
Sumber Informasi Tambahan
Untuk memperdalam pemahaman tentang sistem periodik unsur, Anda dapat memanfaatkan berbagai sumber informasi, baik berupa buku maupun situs web. Berikut beberapa referensi yang dapat Anda gunakan.
Buku Referensi
Buku-buku berikut ini dapat membantu Anda mempelajari sistem periodik unsur secara lebih mendalam.
- Kimia Dasar oleh Chang, Raymond. Buku ini membahas sistem periodik unsur secara komprehensif, mulai dari sejarah, perkembangan, hingga aplikasi dalam kehidupan sehari-hari.
- Kimia oleh Petrucci, Harwood, Herring, dan Madura. Buku ini menyajikan penjelasan yang detail tentang sistem periodik unsur, termasuk sifat-sifat unsur, ikatan kimia, dan reaksi kimia.
- Chemistry: The Central Science oleh Theodore L. Brown, H. Eugine LeMay Jr., dan Bruce E. Bursten. Buku ini membahas sistem periodik unsur dengan pendekatan yang modern dan terintegrasi dengan berbagai bidang ilmu pengetahuan.
Situs Web
Selain buku, Anda juga dapat memanfaatkan berbagai situs web yang menyediakan informasi tentang sistem periodik unsur. Berikut beberapa situs web yang direkomendasikan.
- Ptable.com: Situs web ini menampilkan tabel periodik interaktif yang lengkap dengan informasi tentang setiap unsur, seperti nomor atom, konfigurasi elektron, dan titik leleh.
- Chem.libretexts.org: Situs web ini menyediakan sumber belajar kimia yang lengkap, termasuk materi tentang sistem periodik unsur, dengan penjelasan yang mudah dipahami dan dilengkapi dengan contoh soal.
- Wikipedia: Anda dapat mencari informasi tentang sistem periodik unsur dan unsur-unsur tertentu di Wikipedia. Situs web ini menyediakan informasi yang akurat dan terpercaya, yang disusun oleh para ahli.
Tips Mencari Informasi di Internet
Berikut beberapa tips untuk mencari informasi tentang sistem periodik unsur di internet:
- Gunakan kata kunci yang spesifik, seperti “sistem periodik unsur”, “sifat unsur”, atau “konfigurasi elektron”.
- Gunakan operator Boolean, seperti “AND”, “OR”, dan “NOT”, untuk mempersempit pencarian Anda.
- Perhatikan kredibilitas sumber informasi. Pastikan situs web yang Anda gunakan berasal dari sumber yang terpercaya, seperti lembaga pendidikan, organisasi ilmiah, atau situs web resmi pemerintah.
Tips Memahami Konsep Sulit
Sistem periodik unsur memang memiliki beberapa konsep yang cukup sulit dipahami. Berikut beberapa tips untuk memahami konsep-konsep tersebut.
- Visualisasi: Gunakan gambar, tabel, atau diagram untuk membantu Anda memvisualisasikan konsep yang sulit.
- Contoh: Cari contoh-contoh nyata yang berhubungan dengan konsep yang ingin Anda pahami. Misalnya, untuk memahami konsep elektronegativitas, Anda dapat melihat contoh ikatan kovalen polar dan nonpolar.
- Diskusi: Diskusikan konsep yang sulit dengan teman sekelas atau guru Anda. Bertukar ide dan perspektif dapat membantu Anda memahami konsep dengan lebih baik.
Terakhir
Dengan memahami sistem periodik unsur, kita membuka pintu menuju dunia kimia yang lebih luas. Latihan soal membantu kita mengasah pemahaman, menemukan pola, dan mengaplikasikan konsep kimia dalam berbagai situasi. Semoga contoh soal yang telah kita bahas memberikan Anda gambaran yang lebih jelas tentang sistem periodik dan mendorong Anda untuk terus menjelajahi dunia kimia yang menarik.





