Contoh soal struktur lewis – Struktur Lewis, sebuah representasi visual ikatan kimia dalam molekul, membuka pintu bagi pemahaman mendalam tentang bagaimana atom-atom saling berikatan. Dengan menggunakan simbol-simbol sederhana, struktur Lewis memungkinkan kita untuk memvisualisasikan distribusi elektron valensi dan memprediksi bentuk molekul.
Dalam artikel ini, kita akan menjelajahi dunia struktur Lewis melalui contoh soal dan pembahasannya. Anda akan mempelajari langkah-langkah menggambar struktur Lewis, aturan oktet, dan pengecualiannya, serta aplikasi struktur Lewis dalam memprediksi sifat-sifat molekul. Siapkan diri Anda untuk perjalanan menarik yang akan memperkaya pemahaman Anda tentang kimia.
Pengertian Struktur Lewis
Struktur Lewis, yang juga dikenal sebagai diagram titik elektron Lewis, adalah representasi visual dari ikatan kimia dalam molekul. Struktur ini menggambarkan bagaimana atom-atom dalam molekul terhubung satu sama lain dan menunjukkan jumlah elektron valensi yang terlibat dalam ikatan. Struktur Lewis membantu kita memahami bagaimana atom-atom berikatan dan membentuk molekul, serta sifat kimia molekul tersebut.
Konsep Struktur Lewis
Struktur Lewis didasarkan pada konsep elektron valensi, yaitu elektron yang berada di kulit terluar atom. Elektron valensi adalah yang paling aktif dalam pembentukan ikatan kimia. Dalam struktur Lewis, setiap atom direpresentasikan dengan simbolnya, dan elektron valensi digambarkan sebagai titik-titik di sekitar simbol atom.
Misalnya, atom oksigen (O) memiliki enam elektron valensi. Dalam struktur Lewis, atom oksigen akan digambarkan dengan simbol ‘O’ dan enam titik di sekitarnya, seperti ini:
O . . . . . .
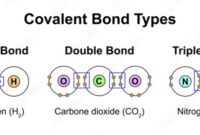
Titik-titik ini mewakili elektron valensi atom oksigen. Ketika atom-atom berikatan, elektron valensi mereka dapat dibagikan untuk membentuk ikatan kovalen. Setiap ikatan kovalen direpresentasikan dengan garis tunggal yang menghubungkan dua atom. Setiap garis mewakili dua elektron yang dibagikan.
Sebagai contoh, molekul air (H2O) memiliki dua atom hidrogen (H) dan satu atom oksigen (O). Struktur Lewis untuk air adalah:
H : O : H
Dalam struktur ini, setiap atom hidrogen memiliki satu elektron valensi, dan atom oksigen memiliki enam elektron valensi. Atom oksigen berbagi dua elektron valensinya dengan masing-masing atom hidrogen, membentuk dua ikatan kovalen.
Fungsi Utama Struktur Lewis
Struktur Lewis memiliki beberapa fungsi utama dalam kimia, antara lain:
- Memprediksi bentuk molekul.
- Menentukan jenis ikatan kimia dalam molekul (kovalen atau ionik).
- Memprediksi sifat kimia molekul, seperti polaritas dan reaktivitas.
- Membantu memahami mekanisme reaksi kimia.
Perbandingan Struktur Lewis dengan Struktur Kimia Lainnya
| Struktur | Keterangan |
|---|---|
| Struktur Lewis | Representasi visual sederhana ikatan kimia dalam molekul. Menunjukkan elektron valensi dan ikatan kovalen. |
| Struktur VSEPR | Model geometri molekul yang didasarkan pada tolakan antar pasangan elektron. Memprediksi bentuk molekul berdasarkan jumlah pasangan elektron di sekitar atom pusat. |
| Struktur Orbital Molekul | Representasi kompleks ikatan kimia yang mempertimbangkan interaksi orbital atom. Menjelaskan ikatan kimia dan sifat molekul berdasarkan interaksi orbital. |
Langkah-langkah Menggambar Struktur Lewis
Struktur Lewis, yang juga dikenal sebagai diagram titik elektron, merupakan representasi visual dari ikatan kimia dalam suatu molekul. Diagram ini menunjukkan bagaimana elektron valensi, elektron yang terlibat dalam pembentukan ikatan, disusun di sekitar atom-atom dalam molekul. Menggambar struktur Lewis membantu kita memahami bagaimana atom-atom saling berikatan, bentuk molekul, dan sifat-sifatnya.
Contoh soal struktur lewis bisa membantu kamu memahami bagaimana atom-atom dalam suatu molekul terikat. Nah, mirip dengan itu, contoh soal subnetting juga penting untuk memahami bagaimana jaringan komputer dibagi-bagi. Jika kamu ingin mempelajari lebih lanjut tentang contoh soal subnetting, kamu bisa mengunjungi link ini.
Setelah memahami konsep subnetting, kamu akan lebih mudah untuk memahami bagaimana contoh soal struktur lewis bisa diterapkan dalam konteks jaringan komputer, terutama dalam menentukan struktur jaringan yang efisien.
Langkah-langkah Menggambar Struktur Lewis
Berikut langkah-langkah lengkap untuk menggambar struktur Lewis:
- Tentukan jumlah total elektron valensi dalam molekul. Jumlah ini diperoleh dengan menjumlahkan elektron valensi dari setiap atom dalam molekul.
- Tentukan atom pusat dalam molekul. Atom pusat biasanya merupakan atom yang paling elektronegatif dalam molekul. Jika ada beberapa atom yang sama elektronegatif, atom pusat biasanya merupakan atom yang paling banyak jumlahnya.
- Letakkan atom-atom lainnya di sekitar atom pusat, dengan memperhatikan aturan oktet. Aturan oktet menyatakan bahwa atom-atom berusaha untuk memiliki delapan elektron valensi di kulit terluarnya. Atom-atom yang berada di periode kedua tabel periodik, seperti karbon, nitrogen, dan oksigen, biasanya mengikuti aturan oktet.
- Hubungkan atom-atom dengan garis tunggal, yang mewakili ikatan tunggal. Setiap garis tunggal mewakili dua elektron valensi, satu dari setiap atom yang berikatan.
- Selesaikan oktet setiap atom dengan menambahkan pasangan elektron bebas. Pasangan elektron bebas adalah elektron valensi yang tidak terlibat dalam ikatan. Letakkan pasangan elektron bebas di sekitar atom-atom, dengan memperhatikan aturan oktet.
- Jika perlu, buat ikatan rangkap atau rangkap tiga untuk memenuhi aturan oktet. Ikatan rangkap mewakili empat elektron valensi, dan ikatan rangkap tiga mewakili enam elektron valensi.
- Hitung jumlah elektron valensi yang digunakan dalam struktur Lewis. Jumlah ini harus sama dengan jumlah total elektron valensi yang dihitung pada langkah pertama.
Menentukan Atom Pusat
Menentukan atom pusat dalam molekul adalah langkah penting dalam menggambar struktur Lewis. Berikut beberapa panduan untuk menentukan atom pusat:
- Atom pusat biasanya merupakan atom yang paling elektronegatif dalam molekul. Elektronegativitas adalah kemampuan atom untuk menarik elektron dalam ikatan kimia. Semakin tinggi elektronegativitas atom, semakin kuat atom tersebut menarik elektron.
- Jika ada beberapa atom yang sama elektronegatif, atom pusat biasanya merupakan atom yang paling banyak jumlahnya. Misalnya, dalam molekul karbon dioksida (CO2), atom karbon (C) adalah atom pusat karena ada dua atom oksigen (O) yang berikatan dengannya.
- Atom hidrogen (H) jarang menjadi atom pusat karena hanya memiliki satu elektron valensi. Atom hidrogen biasanya berikatan dengan atom lain untuk memenuhi aturan duplet, yaitu memiliki dua elektron valensi di kulit terluarnya.
Flowchart Menggambar Struktur Lewis
Berikut adalah flowchart yang menunjukkan alur langkah-langkah menggambar struktur Lewis:
Aturan Oktet dan Pengecualiannya
Struktur Lewis adalah representasi diagramatik ikatan kovalen dalam molekul. Dalam struktur Lewis, titik-titik atau garis digunakan untuk mewakili elektron valensi atom, dan ikatan kovalen diwakili oleh garis yang menghubungkan atom-atom. Aturan oktet adalah salah satu konsep penting dalam memahami pembentukan ikatan kovalen dan penulisan struktur Lewis.
Aturan Oktet
Aturan oktet menyatakan bahwa atom-atom cenderung berikatan sedemikian rupa sehingga mereka memiliki delapan elektron di kulit terluarnya, yang mirip dengan konfigurasi elektron gas mulia yang stabil. Dengan memiliki delapan elektron di kulit terluarnya, atom mencapai keadaan elektronik yang stabil.
Sebagai contoh, atom oksigen memiliki enam elektron valensi. Untuk mencapai konfigurasi oktet, oksigen membutuhkan dua elektron lagi. Oksigen dapat mencapai hal ini dengan membentuk dua ikatan kovalen tunggal dengan dua atom hidrogen, seperti dalam molekul air (H2O). Struktur Lewis untuk air menunjukkan bahwa oksigen memiliki delapan elektron di kulit terluarnya.
Contoh lain adalah karbon yang memiliki empat elektron valensi. Untuk mencapai konfigurasi oktet, karbon dapat membentuk empat ikatan kovalen tunggal dengan empat atom hidrogen, seperti dalam molekul metana (CH4). Struktur Lewis untuk metana menunjukkan bahwa karbon memiliki delapan elektron di kulit terluarnya.
Pengecualian Aturan Oktet
Meskipun aturan oktet merupakan pedoman yang berguna untuk memahami ikatan kovalen, ada beberapa pengecualian penting. Berikut adalah beberapa pengecualian aturan oktet:
- Atom-atom dengan kurang dari delapan elektron di kulit terluarnya: Beberapa atom, seperti boron dan aluminium, cenderung memiliki kurang dari delapan elektron di kulit terluarnya. Misalnya, boron trifluorida (BF3) memiliki hanya enam elektron di sekitar atom boron.
- Atom-atom dengan lebih dari delapan elektron di kulit terluarnya: Atom-atom periode ketiga dan seterusnya dapat memiliki lebih dari delapan elektron di kulit terluarnya, karena kulit terluarnya dapat menampung lebih dari delapan elektron. Misalnya, sulfur heksafluorida (SF6) memiliki 12 elektron di sekitar atom sulfur.
- Atom-atom dengan jumlah elektron ganjil: Atom-atom dengan jumlah elektron ganjil, seperti nitrogen monoksida (NO), tidak dapat memiliki delapan elektron di kulit terluarnya. Misalnya, nitrogen monoksida memiliki 11 elektron valensi, sehingga salah satu atom nitrogen memiliki tujuh elektron di kulit terluarnya.
Alasan Pengecualian Aturan Oktet
Pengecualian aturan oktet terjadi karena beberapa faktor, termasuk:
- Stabilitas energi: Atom-atom berusaha mencapai konfigurasi elektron yang paling stabil, yang tidak selalu melibatkan oktet penuh. Misalnya, boron trifluorida (BF3) lebih stabil dengan enam elektron di sekitar atom boron daripada dengan delapan elektron.
- Ukuran atom: Atom-atom yang lebih besar, seperti sulfur dan fosfor, dapat menampung lebih dari delapan elektron di kulit terluarnya karena kulit terluarnya lebih besar. Ini memungkinkan mereka untuk membentuk ikatan kovalen dengan lebih banyak atom.
- Elektronegativitas: Atom-atom dengan elektronegativitas tinggi, seperti oksigen dan fluor, cenderung menarik elektron ke arah mereka, sehingga mereka dapat memiliki lebih dari delapan elektron di kulit terluarnya.
Contoh Soal Struktur Lewis dan Pembahasannya
Struktur Lewis merupakan representasi visual dari ikatan kimia dalam suatu molekul. Struktur ini menunjukkan bagaimana atom-atom dalam molekul terhubung satu sama lain melalui ikatan kovalen, dan juga menunjukkan elektron-elektron valensi yang tidak berikatan. Struktur Lewis membantu kita memahami bagaimana molekul terbentuk, sifat-sifatnya, dan bagaimana mereka bereaksi dengan molekul lain.
Struktur Lewis dapat digunakan untuk menggambarkan molekul sederhana maupun kompleks. Untuk molekul sederhana, seperti H2O, CO2, dan NH3, struktur Lewis dapat digambar dengan mudah dengan mengikuti beberapa aturan sederhana. Namun, untuk molekul kompleks, struktur Lewis mungkin memerlukan pengecualian dari aturan oktet.
Contoh Soal Struktur Lewis untuk Molekul Sederhana
Berikut ini adalah contoh soal struktur Lewis untuk molekul sederhana, yaitu H2O, CO2, dan NH3:
- H2O (Air)
- Hitung jumlah elektron valensi total. Atom hidrogen memiliki 1 elektron valensi, dan atom oksigen memiliki 6 elektron valensi. Jadi, jumlah total elektron valensi dalam H2O adalah 2(1) + 6 = 8 elektron valensi.
- Tentukan atom pusat. Dalam H2O, oksigen adalah atom pusat karena lebih elektronegatif daripada hidrogen.
- Hubungkan atom-atom dengan ikatan tunggal. Hubungkan atom hidrogen ke atom oksigen dengan ikatan tunggal.
- Tambahkan elektron valensi yang tersisa sebagai pasangan elektron bebas. Setelah menghubungkan atom-atom dengan ikatan tunggal, terdapat 4 elektron valensi yang tersisa. Tambahkan elektron-elektron ini sebagai pasangan elektron bebas pada atom oksigen.
- Verifikasi bahwa semua atom memenuhi aturan oktet. Dalam struktur Lewis H2O, atom oksigen memiliki 8 elektron valensi (2 dari ikatan dan 6 dari pasangan elektron bebas), dan masing-masing atom hidrogen memiliki 2 elektron valensi (1 dari ikatan). Semua atom memenuhi aturan oktet.
- CO2 (Karbon Dioksida)
- Hitung jumlah elektron valensi total. Atom karbon memiliki 4 elektron valensi, dan atom oksigen memiliki 6 elektron valensi. Jadi, jumlah total elektron valensi dalam CO2 adalah 4 + 2(6) = 16 elektron valensi.
- Tentukan atom pusat. Dalam CO2, karbon adalah atom pusat karena kurang elektronegatif daripada oksigen.
- Hubungkan atom-atom dengan ikatan tunggal. Hubungkan atom oksigen ke atom karbon dengan ikatan tunggal.
- Tambahkan elektron valensi yang tersisa sebagai pasangan elektron bebas. Setelah menghubungkan atom-atom dengan ikatan tunggal, terdapat 12 elektron valensi yang tersisa. Tambahkan elektron-elektron ini sebagai pasangan elektron bebas pada atom oksigen. Namun, atom karbon hanya memiliki 4 elektron valensi. Untuk memenuhi aturan oktet, kita perlu membentuk ikatan rangkap dua antara atom karbon dan masing-masing atom oksigen.
- Verifikasi bahwa semua atom memenuhi aturan oktet. Dalam struktur Lewis CO2, atom karbon memiliki 8 elektron valensi (4 dari ikatan rangkap dua), dan masing-masing atom oksigen memiliki 8 elektron valensi (2 dari ikatan rangkap dua dan 6 dari pasangan elektron bebas). Semua atom memenuhi aturan oktet.
- NH3 (Amonia)
- Hitung jumlah elektron valensi total. Atom nitrogen memiliki 5 elektron valensi, dan atom hidrogen memiliki 1 elektron valensi. Jadi, jumlah total elektron valensi dalam NH3 adalah 5 + 3(1) = 8 elektron valensi.
- Tentukan atom pusat. Dalam NH3, nitrogen adalah atom pusat karena lebih elektronegatif daripada hidrogen.
- Hubungkan atom-atom dengan ikatan tunggal. Hubungkan atom hidrogen ke atom nitrogen dengan ikatan tunggal.
- Tambahkan elektron valensi yang tersisa sebagai pasangan elektron bebas. Setelah menghubungkan atom-atom dengan ikatan tunggal, terdapat 2 elektron valensi yang tersisa. Tambahkan elektron-elektron ini sebagai pasangan elektron bebas pada atom nitrogen.
- Verifikasi bahwa semua atom memenuhi aturan oktet. Dalam struktur Lewis NH3, atom nitrogen memiliki 8 elektron valensi (3 dari ikatan dan 2 dari pasangan elektron bebas), dan masing-masing atom hidrogen memiliki 2 elektron valensi (1 dari ikatan). Semua atom memenuhi aturan oktet.
Contoh Soal Struktur Lewis untuk Molekul Kompleks dengan Pengecualian Aturan Oktet
Ada beberapa molekul yang tidak mengikuti aturan oktet, seperti molekul yang mengandung atom-atom periode 3 atau lebih tinggi, atau molekul yang memiliki jumlah elektron valensi ganjil. Untuk molekul-molekul ini, struktur Lewis perlu digambar dengan sedikit modifikasi.
- SF6 (Sulfur Heksafluorida)
- Hitung jumlah elektron valensi total. Atom sulfur memiliki 6 elektron valensi, dan atom fluor memiliki 7 elektron valensi. Jadi, jumlah total elektron valensi dalam SF6 adalah 6 + 6(7) = 48 elektron valensi.
- Tentukan atom pusat. Dalam SF6, sulfur adalah atom pusat karena kurang elektronegatif daripada fluor.
- Hubungkan atom-atom dengan ikatan tunggal. Hubungkan atom fluor ke atom sulfur dengan ikatan tunggal.
- Tambahkan elektron valensi yang tersisa sebagai pasangan elektron bebas. Setelah menghubungkan atom-atom dengan ikatan tunggal, terdapat 36 elektron valensi yang tersisa. Tambahkan elektron-elektron ini sebagai pasangan elektron bebas pada atom fluor. Namun, atom sulfur hanya memiliki 6 elektron valensi. Untuk memenuhi aturan oktet, kita perlu membentuk ikatan rangkap dua antara atom sulfur dan masing-masing atom fluor. Namun, dalam kasus ini, sulfur memiliki 12 elektron valensi, yang melebihi aturan oktet. Ini adalah pengecualian dari aturan oktet karena sulfur adalah atom periode 3 dan dapat memiliki lebih dari 8 elektron valensi.
- Verifikasi bahwa semua atom memenuhi aturan oktet. Dalam struktur Lewis SF6, atom sulfur memiliki 12 elektron valensi (6 dari ikatan tunggal), dan masing-masing atom fluor memiliki 8 elektron valensi (1 dari ikatan tunggal dan 3 dari pasangan elektron bebas). Semua atom memenuhi aturan oktet.
Aplikasi Struktur Lewis dalam Kimia: Contoh Soal Struktur Lewis
Struktur Lewis merupakan representasi visual ikatan kimia dalam molekul. Struktur ini membantu kita memahami bagaimana atom-atom saling berikatan dan bagaimana elektron terdistribusi dalam molekul. Struktur Lewis tidak hanya menggambarkan bagaimana atom-atom saling terhubung, tetapi juga memberikan informasi penting tentang bentuk molekul, polaritas ikatan, dan bahkan dapat membantu memprediksi reaksi kimia.
Memprediksi Bentuk Molekul
Struktur Lewis dapat digunakan untuk memprediksi bentuk molekul dengan menggunakan teori VSEPR (Valence Shell Electron Pair Repulsion). Teori ini menyatakan bahwa pasangan elektron valensi di sekitar atom pusat akan saling tolak-menolak, sehingga mengatur geometri molekul agar tolakan antarpasangan elektron diminimalkan.
Misalnya, molekul air (H2O) memiliki struktur Lewis dengan dua pasang elektron bebas di sekitar atom oksigen. Tolakan antarpasangan elektron bebas dan pasangan elektron ikatan menyebabkan molekul air memiliki bentuk bengkok atau V.
Menentukan Polaritas Ikatan dan Molekul
Struktur Lewis juga dapat digunakan untuk menentukan polaritas ikatan dan molekul. Polaritas ikatan ditentukan oleh perbedaan elektronegativitas antara dua atom yang berikatan. Jika perbedaan elektronegativitas cukup besar, maka ikatan tersebut bersifat polar, dengan elektron lebih tertarik ke atom yang lebih elektronegatif.
Misalnya, ikatan antara hidrogen dan oksigen dalam molekul air bersifat polar karena oksigen lebih elektronegatif daripada hidrogen. Ini menyebabkan atom oksigen memiliki muatan parsial negatif (δ-) dan atom hidrogen memiliki muatan parsial positif (δ+).
Polaritas molekul ditentukan oleh polaritas ikatan dan geometri molekul. Jika molekul memiliki ikatan polar dan geometri asimetris, maka molekul tersebut bersifat polar. Misalnya, molekul air bersifat polar karena memiliki ikatan polar dan geometri bengkok.
Aplikasi dalam Memahami Reaksi Kimia
Struktur Lewis dapat membantu memahami bagaimana reaksi kimia terjadi. Misalnya, struktur Lewis dapat menunjukkan bagaimana elektron bergerak selama reaksi, yang membantu memprediksi produk reaksi.
Contohnya, dalam reaksi antara metana (CH4) dan klorin (Cl2), struktur Lewis menunjukkan bahwa elektron dari ikatan C-H dalam metana ditransfer ke atom klorin, menghasilkan produk klorometana (CH3Cl) dan asam klorida (HCl).
Struktur Lewis juga dapat membantu dalam memahami stabilitas relatif dari molekul dan ion. Misalnya, struktur Lewis menunjukkan bahwa ion karbonat (CO32-) memiliki resonansi, yang meningkatkan stabilitasnya.
Struktur Lewis dan Resonansi
Struktur Lewis adalah representasi diagramatik dari ikatan kovalen dalam molekul, di mana titik-titik atau garis digunakan untuk mewakili elektron valensi dan ikatan antara atom. Namun, dalam beberapa kasus, struktur Lewis tunggal tidak dapat menggambarkan distribusi elektron secara akurat, karena elektron dapat terdelokalisasi di seluruh molekul. Di sinilah konsep resonansi muncul.
Konsep Resonansi dalam Struktur Lewis
Resonansi adalah konsep yang digunakan untuk menggambarkan distribusi elektron yang terdelokalisasi dalam molekul. Dalam resonansi, beberapa struktur Lewis dapat ditulis untuk menggambarkan molekul yang sama, tetapi tidak satu pun dari struktur ini dapat mewakili molekul secara akurat. Struktur Lewis ini disebut struktur resonansi, dan struktur sebenarnya dari molekul adalah hibrida resonansi dari semua struktur resonansi yang mungkin.
Contoh Molekul yang Menunjukkan Resonansi
Salah satu contoh klasik molekul yang menunjukkan resonansi adalah ion karbonat (CO32-).
- Struktur Lewis tunggal untuk ion karbonat menunjukkan bahwa satu ikatan C-O adalah ikatan rangkap, sementara dua ikatan C-O lainnya adalah ikatan tunggal.
- Namun, dalam kenyataannya, ketiga ikatan C-O identik, dengan panjang ikatan yang sama.
- Untuk menggambarkan ini, kita dapat menulis tiga struktur resonansi untuk ion karbonat, di mana ikatan rangkap bergantian di antara ketiga atom oksigen.
Pengaruh Resonansi terhadap Stabilitas dan Sifat Molekul
Resonansi memiliki pengaruh yang signifikan terhadap stabilitas dan sifat molekul.
- Molekul yang menunjukkan resonansi lebih stabil daripada molekul yang tidak menunjukkan resonansi.
- Ini karena elektron terdelokalisasi memiliki energi yang lebih rendah daripada elektron yang terlokalisasi.
- Resonansi juga dapat mempengaruhi sifat kimia molekul, seperti titik didih dan titik leleh.
- Sebagai contoh, ion karbonat lebih stabil daripada molekul karbon dioksida (CO2) karena resonansi.
- Hal ini tercermin dalam titik didih ion karbonat yang lebih tinggi dibandingkan dengan CO2.
Kesimpulan
Resonansi adalah konsep penting dalam kimia yang membantu kita memahami struktur dan sifat molekul. Dengan memahami konsep resonansi, kita dapat memprediksi stabilitas dan sifat kimia molekul dengan lebih akurat.
Struktur Lewis dan Bentuk Molekul

Struktur Lewis adalah representasi diagramatik dari ikatan kovalen dalam suatu molekul. Struktur Lewis menunjukkan bagaimana atom-atom dalam suatu molekul terhubung satu sama lain, serta bagaimana elektron-elektron valensi atom-atom tersebut didistribusikan. Struktur Lewis dapat digunakan untuk memprediksi bentuk molekul.
Teori VSEPR
Teori VSEPR (Valence Shell Electron Pair Repulsion) adalah teori yang menjelaskan bentuk molekul berdasarkan tolakan antara pasangan elektron valensi. Teori VSEPR menyatakan bahwa pasangan elektron valensi, baik ikatan maupun bebas, saling tolak-menolak dan akan mengatur diri sedemikian rupa sehingga tolakan antarpasangan elektron diminimalkan.
Bentuk Molekul
Bentuk molekul adalah susunan tiga dimensi dari atom-atom dalam suatu molekul. Bentuk molekul dapat ditentukan dengan menggunakan teori VSEPR.
Contoh Bentuk Molekul
Berikut adalah beberapa contoh molekul dengan bentuk linear, tetrahedral, dan piramida trigonal:
- Bentuk Linear: Molekul CO2 memiliki bentuk linear. Atom karbon pusat memiliki dua ikatan rangkap dengan atom oksigen. Karena tidak ada pasangan elektron bebas pada atom karbon, kedua ikatan rangkap berada pada sisi berlawanan dari atom karbon, menghasilkan bentuk linear.
- Bentuk Tetrahedral: Molekul CH4 memiliki bentuk tetrahedral. Atom karbon pusat memiliki empat ikatan tunggal dengan atom hidrogen. Keempat ikatan ini diarahkan ke empat sudut tetrahedron, yang menghasilkan bentuk tetrahedral.
- Bentuk Piramida Trigonal: Molekul NH3 memiliki bentuk piramida trigonal. Atom nitrogen pusat memiliki tiga ikatan tunggal dengan atom hidrogen dan satu pasangan elektron bebas. Tiga ikatan tunggal diarahkan ke tiga sudut segitiga, dan pasangan elektron bebas terletak di atas atom nitrogen, menghasilkan bentuk piramida trigonal.
Struktur Lewis dan Sifat Fisik Molekul
Struktur Lewis, yang menggambarkan bagaimana atom-atom dalam suatu molekul terikat satu sama lain, menjadi kunci untuk memahami sifat fisik molekul. Dengan melihat bagaimana elektron terdistribusi dalam suatu molekul, kita dapat memprediksi sifat-sifat seperti titik didih, titik leleh, dan kelarutan.
Titik Didih dan Titik Leleh
Titik didih dan titik leleh merupakan sifat fisik yang menunjukkan seberapa kuat ikatan antarmolekul. Semakin kuat ikatan antarmolekul, semakin tinggi titik didih dan titik lelehnya. Struktur Lewis membantu kita memahami kekuatan ikatan antarmolekul ini.
- Ikatan Hidrogen: Ikatan hidrogen merupakan jenis ikatan antarmolekul yang kuat, terjadi antara atom hidrogen yang terikat pada atom elektronegatif seperti oksigen, nitrogen, atau fluor, dengan pasangan elektron bebas pada atom elektronegatif lainnya. Molekul dengan ikatan hidrogen memiliki titik didih dan titik leleh yang tinggi. Sebagai contoh, air (H2O) memiliki titik didih yang relatif tinggi dibandingkan dengan hidrogen sulfida (H2S), karena adanya ikatan hidrogen dalam air. Struktur Lewis air menunjukkan atom hidrogen yang terikat pada atom oksigen dengan dua pasangan elektron bebas, memungkinkan pembentukan ikatan hidrogen.
- Ikatan Dipole-Dipole: Ikatan dipole-dipole terjadi antara molekul polar, di mana terdapat perbedaan elektronegativitas yang signifikan antara atom-atom dalam molekul tersebut. Molekul polar memiliki momen dipol, yaitu pemisahan muatan positif dan negatif. Ikatan dipole-dipole lebih lemah daripada ikatan hidrogen, tetapi masih cukup kuat untuk meningkatkan titik didih dan titik leleh. Sebagai contoh, metanol (CH3OH) memiliki titik didih yang lebih tinggi dibandingkan dengan etana (C2H6), karena adanya ikatan dipole-dipole dalam metanol. Struktur Lewis metanol menunjukkan atom oksigen yang lebih elektronegatif daripada atom karbon, menghasilkan momen dipol.
- Gaya London: Gaya London merupakan jenis ikatan antarmolekul yang paling lemah, terjadi antara semua molekul, baik polar maupun nonpolar. Gaya London timbul dari fluktuasi sementara dalam distribusi elektron, yang menciptakan dipol sementara. Semakin besar ukuran molekul, semakin kuat gaya London. Sebagai contoh, heksana (C6H14) memiliki titik didih yang lebih tinggi dibandingkan dengan metana (CH4), karena adanya gaya London yang lebih kuat dalam heksana. Struktur Lewis heksana menunjukkan molekul yang lebih besar dengan lebih banyak elektron, yang menyebabkan gaya London yang lebih kuat.
Kelarutan, Contoh soal struktur lewis
Kelarutan suatu zat dalam pelarut ditentukan oleh prinsip “like dissolves like”. Artinya, zat polar cenderung larut dalam pelarut polar, sedangkan zat nonpolar cenderung larut dalam pelarut nonpolar. Struktur Lewis dapat membantu kita memprediksi polaritas suatu molekul.
- Molekul Polar: Molekul polar memiliki distribusi elektron yang tidak merata, menghasilkan momen dipol. Molekul polar cenderung larut dalam pelarut polar seperti air. Sebagai contoh, gula (C12H22O11) larut dalam air karena gula merupakan molekul polar, sedangkan minyak (C16H34) tidak larut dalam air karena minyak merupakan molekul nonpolar. Struktur Lewis gula menunjukkan banyak gugus hidroksil (-OH) yang polar, sedangkan struktur Lewis minyak menunjukkan rantai hidrokarbon yang nonpolar.
- Molekul Nonpolar: Molekul nonpolar memiliki distribusi elektron yang merata, tidak memiliki momen dipol. Molekul nonpolar cenderung larut dalam pelarut nonpolar seperti heksana. Sebagai contoh, minyak larut dalam heksana karena keduanya merupakan molekul nonpolar.
Contoh Molekul dengan Sifat Fisik yang Berbeda
| Molekul | Struktur Lewis | Titik Didih (°C) | Titik Leleh (°C) | Kelarutan dalam Air | Alasan |
|---|---|---|---|---|---|
| Air (H2O) | [Gambar struktur Lewis air] | 100 | 0 | Larut | Ikatan hidrogen yang kuat antar molekul air menyebabkan titik didih dan titik leleh yang tinggi. Air adalah pelarut polar, sehingga larut dalam air. |
| Metana (CH4) | [Gambar struktur Lewis metana] | -161 | -182 | Tidak larut | Metana adalah molekul nonpolar, sehingga hanya memiliki gaya London yang lemah antar molekul. Titik didih dan titik lelehnya rendah. Metana tidak larut dalam air karena merupakan molekul nonpolar. |
| Etanol (C2H5OH) | [Gambar struktur Lewis etanol] | 78 | -114 | Larut | Etanol memiliki ikatan hidrogen, meskipun lebih lemah daripada air, yang menyebabkan titik didih yang lebih tinggi dibandingkan dengan metana. Etanol adalah molekul polar, sehingga larut dalam air. |
Ringkasan Penutup
Memahami struktur Lewis membuka cakrawala baru dalam memahami dunia kimia. Dari memprediksi bentuk molekul hingga menentukan polaritas ikatan, struktur Lewis memberikan alat yang ampuh untuk mengungkap misteri ikatan kimia. Dengan menguasai konsep ini, Anda akan memiliki kemampuan untuk menafsirkan perilaku molekul dan memahami reaksi kimia dengan lebih baik.