Contoh soal inti atom – Inti atom, pusat dari sebuah atom, merupakan bagian yang menyimpan rahasia besar tentang alam semesta. Di sana, proton dan neutron berdampingan, menentukan sifat-sifat unik dari setiap unsur. Bayangkan inti atom sebagai pusat tata surya, dengan proton dan neutron sebagai matahari dan planet-planetnya, sementara elektron-elektron mengelilinginya seperti planet-planet yang berputar.
Dari konsep dasar inti atom, kita dapat memahami bagaimana atom-atom saling berinteraksi, membentuk berbagai molekul dan materi yang kita temui sehari-hari. Nah, untuk menguji pemahamanmu tentang inti atom, mari kita selami contoh-contoh soal yang menarik dan menantang!
Pengertian Inti Atom
Atom merupakan unit terkecil dari suatu unsur yang masih memiliki sifat kimiawi unsur tersebut. Atom terdiri dari inti atom dan elektron yang mengelilinginya. Inti atom merupakan bagian terkecil dari atom yang bermuatan positif dan terletak di pusat atom. Inti atom tersusun atas proton dan neutron, yang keduanya memiliki massa yang hampir sama.
Struktur Inti Atom
Inti atom adalah bagian terkecil dari atom yang memiliki peran penting dalam menentukan sifat-sifat atom. Inti atom memiliki struktur yang padat dan bermuatan positif. Struktur inti atom terdiri dari proton dan neutron, yang keduanya memiliki massa yang hampir sama. Proton memiliki muatan positif, sedangkan neutron tidak bermuatan.
Jumlah proton dalam inti atom menentukan nomor atom suatu unsur. Nomor atom ini menunjukkan identitas suatu unsur. Misalnya, atom hidrogen memiliki satu proton, atom helium memiliki dua proton, dan atom karbon memiliki enam proton.
Jumlah neutron dalam inti atom menentukan isotop suatu unsur. Isotop adalah atom-atom dari unsur yang sama dengan jumlah proton yang sama, tetapi jumlah neutron yang berbeda. Misalnya, karbon-12 memiliki enam proton dan enam neutron, sedangkan karbon-14 memiliki enam proton dan delapan neutron.
Analogi Inti Atom
Untuk memahami konsep inti atom dengan lebih mudah, kita dapat menggunakan analogi sederhana. Bayangkan atom sebagai sebuah sistem tata surya. Inti atom merupakan matahari, yang merupakan pusat dari sistem tata surya. Proton dan neutron dalam inti atom merupakan planet-planet yang mengelilingi matahari. Elektron-elektron yang mengelilingi inti atom merupakan asteroid yang bergerak di sekitar planet-planet.
Perbandingan Inti Atom dengan Atom
| Fitur | Inti Atom | Atom |
|---|---|---|
| Ukuran | Sangat kecil | Relatif besar |
| Massa | Hampir seluruh massa atom | Massa total atom |
| Muatan | Positif | Netral |
| Komposisi | Proton dan neutron | Proton, neutron, dan elektron |
| Lokasi | Pusat atom | Seluruh ruang yang ditempati oleh atom |
Struktur Inti Atom
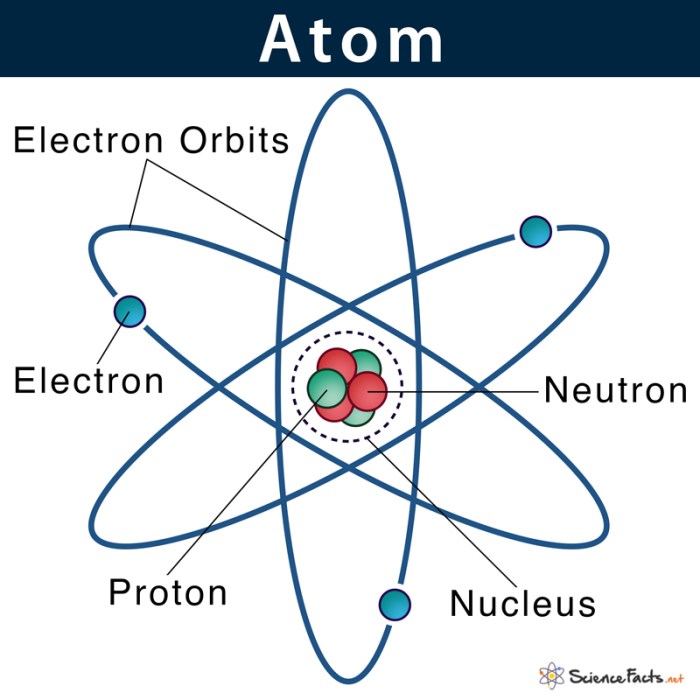
Inti atom, pusat dari sebuah atom, memegang peranan penting dalam menentukan sifat kimia dan fisika suatu unsur. Inti atom tersusun atas partikel subatomik yang dikenal sebagai proton dan neutron, yang secara kolektif disebut nukleon. Proton dan neutron, meskipun keduanya berada di inti atom, memiliki peran yang berbeda dalam menentukan sifat inti atom. Untuk memahami inti atom lebih dalam, mari kita bahas struktur dan komponen-komponennya.
Komponen Utama Inti Atom
Inti atom terdiri dari dua partikel subatomik utama:
- Proton: Proton memiliki muatan positif (+1) dan massa 1,6726 × 10-27 kg. Jumlah proton dalam inti atom menentukan nomor atom suatu unsur. Misalnya, atom karbon memiliki 6 proton, sehingga nomor atomnya adalah 6.
- Neutron: Neutron tidak memiliki muatan (netral) dan memiliki massa yang sedikit lebih besar daripada proton, yaitu 1,6749 × 10-27 kg. Jumlah neutron dalam inti atom, bersama dengan jumlah proton, menentukan nomor massa suatu unsur.
Peran Proton dan Neutron
Proton dan neutron memiliki peran yang berbeda dalam menentukan sifat inti atom:
- Proton: Proton menentukan identitas suatu unsur. Jumlah proton dalam inti atom menentukan nomor atom, yang merupakan ciri khas suatu unsur. Misalnya, semua atom karbon memiliki 6 proton, sedangkan semua atom oksigen memiliki 8 proton.
- Neutron: Neutron menentukan isotop suatu unsur. Isotop adalah atom-atom dari unsur yang sama yang memiliki jumlah proton yang sama tetapi jumlah neutron yang berbeda. Misalnya, karbon-12 dan karbon-14 adalah isotop karbon. Keduanya memiliki 6 proton, tetapi karbon-12 memiliki 6 neutron sedangkan karbon-14 memiliki 8 neutron.
Ilustrasi Struktur Inti Atom
Untuk mempermudah pemahaman, berikut ilustrasi sederhana struktur inti atom:
Bayangkan inti atom sebagai bola kecil yang berisi proton dan neutron yang berdekatan. Proton memiliki muatan positif dan neutron tidak bermuatan. Di sekitar inti atom, terdapat elektron yang bergerak mengelilingi inti pada lintasan tertentu. Elektron memiliki muatan negatif. Jumlah elektron yang mengelilingi inti sama dengan jumlah proton dalam inti atom.
Sifat Inti Atom
Inti atom, pusat dari atom, memegang peran penting dalam menentukan sifat atom tersebut. Inti atom tersusun atas proton dan neutron, yang disebut sebagai nukleon. Sifat inti atom, seperti massa, muatan, dan stabilitas, ditentukan oleh jumlah proton dan neutron di dalamnya. Mari kita bahas lebih lanjut tentang sifat-sifat inti atom.
Massa Inti Atom
Massa inti atom sebagian besar ditentukan oleh jumlah proton dan neutron di dalamnya. Proton dan neutron memiliki massa yang hampir sama, sekitar 1,67 x 10-27 kg. Massa inti atom dapat dihitung dengan menjumlahkan massa proton dan neutron. Misalnya, inti atom karbon-12 memiliki 6 proton dan 6 neutron, sehingga massa intinya sekitar 12 satuan massa atom (sma).
Contoh soal inti atom biasanya membahas tentang struktur atom, seperti jumlah proton, neutron, dan elektron. Soal-soal ini biasanya cukup mudah, tapi bisa jadi lebih menantang saat membahas konsep-konsep seperti isotop dan ion. Nah, kalau kamu butuh latihan soal yang lebih kompleks, coba deh cek contoh soal studi kasus dan jawabannya di link ini.
Soal-soal di sana lebih fokus pada penerapan konsep inti atom dalam kasus nyata, yang bisa membantu kamu memahami materi ini lebih dalam.
Muatan Inti Atom
Muatan inti atom ditentukan oleh jumlah proton di dalamnya. Proton memiliki muatan positif (+1), sedangkan neutron tidak memiliki muatan. Oleh karena itu, muatan inti atom sama dengan jumlah proton. Misalnya, inti atom karbon-12 memiliki 6 proton, sehingga muatan intinya adalah +6. Muatan inti atom ini menentukan sifat kimia suatu atom dan menentukan bagaimana atom berinteraksi dengan atom lainnya.
Stabilitas Inti Atom
Stabilitas inti atom dipengaruhi oleh perbandingan antara jumlah proton dan neutron. Inti atom yang stabil memiliki perbandingan proton dan neutron yang optimal. Jika perbandingan ini tidak optimal, inti atom akan menjadi tidak stabil dan mengalami peluruhan radioaktif. Peluruhan radioaktif adalah proses di mana inti atom yang tidak stabil melepaskan energi dan partikel untuk mencapai konfigurasi yang lebih stabil.
Hubungan Antara Jumlah Proton dan Neutron dengan Stabilitas Inti Atom
Jumlah proton dan neutron dalam inti atom menentukan stabilitas inti tersebut. Perbandingan yang ideal antara proton dan neutron untuk stabilitas inti adalah sekitar 1:1 untuk atom yang lebih ringan. Namun, untuk atom yang lebih berat, jumlah neutron yang dibutuhkan untuk menjaga stabilitas lebih banyak daripada jumlah proton.
- Inti atom dengan jumlah proton dan neutron yang seimbang cenderung lebih stabil. Contohnya, inti atom helium-4 (2 proton dan 2 neutron) sangat stabil.
- Inti atom dengan jumlah neutron yang berlebihan atau kekurangan cenderung tidak stabil dan mengalami peluruhan radioaktif. Contohnya, inti atom karbon-14 (6 proton dan 8 neutron) tidak stabil dan mengalami peluruhan radioaktif menjadi nitrogen-14.
Diagram Hubungan Antara Jumlah Proton dan Neutron dengan Jenis Inti Atom
Berikut adalah diagram yang menunjukkan hubungan antara jumlah proton dan neutron dengan jenis inti atom:
Gambar diagram dengan sumbu X menunjukkan jumlah proton dan sumbu Y menunjukkan jumlah neutron. Titik-titik pada diagram mewakili berbagai jenis inti atom. Inti atom yang stabil terletak di sepanjang “sabuk stabilitas,” sedangkan inti atom yang tidak stabil terletak di luar sabuk stabilitas.
Model Inti Atom: Contoh Soal Inti Atom
Setelah penemuan inti atom oleh Rutherford, para ilmuwan terus berupaya untuk memahami struktur inti atom lebih dalam. Model inti atom Rutherford, yang menggambarkan inti atom sebagai bola padat bermuatan positif, memiliki beberapa kelemahan. Model inti atom Bohr kemudian muncul, mencoba menjelaskan struktur inti atom lebih lanjut. Berikut adalah penjelasan tentang model inti atom Rutherford dan model inti atom Bohr, serta keterbatasan model Bohr dan bagaimana model inti atom modern mengatasi keterbatasan tersebut.
Model Inti Atom Rutherford
Model inti atom Rutherford, yang dikenal juga sebagai model atom planet, menggambarkan atom sebagai sistem tata surya mini. Inti atom, yang bermuatan positif, berada di pusat atom, sedangkan elektron bermuatan negatif mengitari inti pada lintasan melingkar seperti planet mengelilingi matahari. Model ini didasarkan pada percobaan hamburan sinar alfa oleh Rutherford, yang menunjukkan bahwa sebagian besar atom terdiri dari ruang kosong, dengan inti yang sangat kecil dan padat.
Model Inti Atom Bohr
Model inti atom Bohr adalah pengembangan dari model Rutherford. Bohr mengemukakan bahwa elektron dalam atom hanya dapat berada pada tingkat energi tertentu, yang disebut kulit elektron. Elektron dapat berpindah dari satu kulit ke kulit lainnya dengan menyerap atau melepaskan energi dalam bentuk foton. Model Bohr dapat menjelaskan spektrum atom hidrogen dengan baik, tetapi tidak dapat menjelaskan spektrum atom yang lebih kompleks.
Perbandingan Model Inti Atom Rutherford dan Bohr
| Fitur | Model Rutherford | Model Bohr |
|---|---|---|
| Struktur Atom | Inti atom bermuatan positif di pusat, dikelilingi elektron yang bergerak bebas pada lintasan melingkar. | Inti atom bermuatan positif di pusat, dikelilingi elektron yang bergerak pada tingkat energi tertentu (kulit elektron). |
| Lintasan Elektron | Elektron bergerak bebas pada lintasan melingkar. | Elektron hanya dapat berada pada tingkat energi tertentu. |
| Spektrum Atom | Tidak dapat menjelaskan spektrum atom. | Dapat menjelaskan spektrum atom hidrogen. |
| Keterbatasan | Tidak dapat menjelaskan spektrum atom dan stabilitas atom. | Tidak dapat menjelaskan spektrum atom yang lebih kompleks dan efek spin elektron. |
Keterbatasan Model Inti Atom Bohr dan Model Inti Atom Modern
Model inti atom Bohr memiliki beberapa keterbatasan, seperti tidak dapat menjelaskan spektrum atom yang lebih kompleks, efek spin elektron, dan tidak dapat menjelaskan mengapa atom-atom tertentu dapat membentuk ikatan kimia. Model inti atom modern, yang dikenal sebagai model mekanika kuantum, mengatasi keterbatasan ini. Model mekanika kuantum menggambarkan elektron dalam atom sebagai gelombang probabilitas, bukan sebagai partikel klasik. Model ini dapat menjelaskan spektrum atom dengan sangat akurat, serta menjelaskan sifat kimia dan fisika atom secara lebih lengkap.
Isotop
Setelah membahas struktur inti atom, kita akan menjelajahi dunia isotop. Isotop adalah varian atom dari unsur yang sama, yang memiliki jumlah proton yang sama tetapi jumlah neutron yang berbeda. Ini berarti bahwa isotop memiliki nomor atom yang sama, tetapi nomor massanya berbeda. Meskipun isotop memiliki sifat kimia yang mirip, perbedaan jumlah neutron memengaruhi sifat fisik mereka, seperti massa dan stabilitas.
Pengertian Isotop
Isotop adalah atom-atom dari unsur yang sama yang memiliki jumlah proton yang sama tetapi jumlah neutron yang berbeda. Ini berarti bahwa isotop memiliki nomor atom yang sama, tetapi nomor massanya berbeda. Sebagai contoh, karbon-12 dan karbon-14 adalah isotop karbon. Keduanya memiliki 6 proton, tetapi karbon-12 memiliki 6 neutron, sedangkan karbon-14 memiliki 8 neutron.
Contoh Isotop
Berikut adalah beberapa contoh isotop:
- Karbon-12 (12C) dan karbon-14 (14C)
- Hidrogen-1 (1H, protium), hidrogen-2 (2H, deuterium), dan hidrogen-3 (3H, tritium)
- Uranium-235 (235U) dan uranium-238 (238U)
Tabel Isotop
Berikut adalah tabel yang menampilkan data tentang beberapa isotop:
| Isotop | Jumlah Proton | Jumlah Neutron | Nomor Massa |
|---|---|---|---|
| Karbon-12 (12C) | 6 | 6 | 12 |
| Karbon-14 (14C) | 6 | 8 | 14 |
| Hidrogen-1 (1H) | 1 | 0 | 1 |
| Hidrogen-2 (2H) | 1 | 1 | 2 |
| Uranium-235 (235U) | 92 | 143 | 235 |
| Uranium-238 (238U) | 92 | 146 | 238 |
Penggunaan Isotop
Isotop memiliki berbagai macam aplikasi dalam berbagai bidang, seperti kedokteran, industri, dan penelitian ilmiah. Berikut adalah beberapa contoh:
- Kedokteran: Isotop radioaktif digunakan dalam pencitraan medis, seperti PET scan (Positron Emission Tomography), untuk mendiagnosis penyakit dan memantau efek pengobatan. Isotop juga digunakan dalam terapi radiasi untuk mengobati kanker.
- Industri: Isotop digunakan dalam berbagai proses industri, seperti penanggalan radiokarbon untuk menentukan usia fosil dan artefak, serta dalam proses industri seperti pembuatan bahan kimia dan pengolahan logam.
- Penelitian Ilmiah: Isotop digunakan dalam berbagai penelitian ilmiah, seperti penentuan usia batuan dan fosil, serta dalam studi tentang metabolisme dan reaksi kimia.
Reaksi Inti Atom
Reaksi inti atom merupakan proses perubahan yang terjadi pada inti atom, yang melibatkan pelepasan energi dalam jumlah besar. Reaksi ini dapat terjadi secara alami, seperti dalam proses pembentukan bintang, atau secara buatan manusia, seperti dalam reaktor nuklir. Terdapat dua jenis reaksi inti atom utama, yaitu fisi dan fusi.
Fisi Nuklir
Fisi nuklir adalah proses pembelahan inti atom berat menjadi inti atom yang lebih ringan, dengan pelepasan energi yang sangat besar. Proses ini terjadi ketika inti atom berat, seperti uranium-235, ditembak dengan neutron. Neutron tersebut akan diserap oleh inti uranium, sehingga menjadi tidak stabil dan terbelah menjadi dua inti atom yang lebih ringan, seperti barium dan kripton, serta beberapa neutron lainnya. Neutron-neutron ini kemudian dapat menyebabkan reaksi fisi lainnya, yang mengakibatkan reaksi berantai.
Contoh reaksi fisi nuklir:
235U + 1n → 141Ba + 92Kr + 31n + energi
Energi yang dilepaskan dalam reaksi fisi ini berasal dari perbedaan massa antara inti atom sebelum dan sesudah reaksi. Massa inti atom sebelum reaksi lebih besar daripada massa inti atom sesudah reaksi, sehingga selisih massa tersebut diubah menjadi energi sesuai dengan persamaan Einstein E=mc2.
Fisi nuklir memiliki beberapa aplikasi, seperti:
- Pembangkitan listrik di pembangkit listrik tenaga nuklir (PLTN).
- Pembuatan senjata nuklir.
- Penelitian ilmiah.
Fusi Nuklir
Fusi nuklir adalah proses penggabungan dua inti atom ringan menjadi inti atom yang lebih berat, dengan pelepasan energi yang sangat besar. Proses ini terjadi pada suhu dan tekanan yang sangat tinggi, seperti yang terjadi di dalam matahari. Pada suhu dan tekanan tinggi, inti atom ringan, seperti deuterium dan tritium, memiliki energi kinetik yang cukup untuk mengatasi gaya tolak menolak antar inti dan bergabung membentuk inti atom yang lebih berat, seperti helium, dengan pelepasan energi.
Contoh reaksi fusi nuklir:
2H + 3H → 4He + 1n + energi
Energi yang dilepaskan dalam reaksi fusi ini berasal dari perbedaan massa antara inti atom sebelum dan sesudah reaksi. Massa inti atom sebelum reaksi lebih besar daripada massa inti atom sesudah reaksi, sehingga selisih massa tersebut diubah menjadi energi sesuai dengan persamaan Einstein E=mc2.
Fusi nuklir memiliki beberapa potensi aplikasi, seperti:
- Pembangkitan listrik di pembangkit listrik tenaga fusi.
- Pengembangan senjata fusi.
- Penelitian ilmiah.
Perbedaan Fisi dan Fusi
| Karakteristik | Fisi | Fusi |
|---|---|---|
| Proses | Pembelahan inti atom berat | Penggabungan inti atom ringan |
| Bahan baku | Uranium, plutonium | Deuterium, tritium |
| Suhu dan tekanan | Relatif rendah | Sangat tinggi |
| Energi yang dilepaskan | Besar | Sangat besar |
| Sisa radioaktif | Ada | Sedikit |
| Aplikasi | Pembangkit listrik, senjata nuklir | Pembangkit listrik, senjata fusi |
Aplikasi Inti Atom
Inti atom, pusat atom yang mengandung proton dan neutron, menyimpan energi yang sangat besar. Energi ini dapat dilepaskan melalui proses fisi nuklir atau fusi nuklir. Kemampuan melepaskan energi yang luar biasa ini membuka jalan bagi aplikasi inti atom dalam berbagai bidang, seperti energi nuklir, kedokteran, dan industri.
Energi Nuklir
Energi nuklir memanfaatkan reaksi fisi nuklir untuk menghasilkan energi listrik. Reaktor nuklir merupakan jantung dari pembangkit listrik tenaga nuklir. Di dalam reaktor, inti atom uranium atau plutonium dipecah menjadi inti atom yang lebih kecil, melepaskan energi panas yang digunakan untuk menghasilkan uap dan menggerakkan turbin pembangkit listrik.
Selain pembangkit listrik, inti atom juga digunakan dalam bom atom. Bom atom memanfaatkan reaksi fisi nuklir yang terjadi secara cepat dan tidak terkendali, melepaskan energi yang sangat besar dalam waktu singkat. Contohnya, bom atom yang dijatuhkan di Hiroshima dan Nagasaki selama Perang Dunia II merupakan bukti kekuatan destruktif dari inti atom.
Kedokteran, Contoh soal inti atom
Aplikasi inti atom dalam bidang kedokteran sangat luas, khususnya dalam terapi kanker dan pencitraan medis.
- Terapi kanker: Isotop radioaktif seperti kobalt-60 dan iodin-131 digunakan dalam terapi radiasi untuk membunuh sel kanker. Radiasi yang dipancarkan oleh isotop radioaktif ini dapat merusak DNA sel kanker, menghentikan pertumbuhan dan perkembangannya.
- Pencitraan medis: Isotop radioaktif juga digunakan dalam pencitraan medis untuk mendiagnosis penyakit. Contohnya, teknik pencitraan seperti PET (Positron Emission Tomography) dan SPECT (Single Photon Emission Computed Tomography) menggunakan isotop radioaktif untuk menghasilkan gambar organ dan jaringan tubuh, membantu dokter dalam mendiagnosis penyakit dan memantau efektivitas pengobatan.
Industri
Inti atom juga memiliki aplikasi penting dalam industri, seperti:
- Sterilisasi: Radiasi dari isotop radioaktif digunakan untuk mensterilkan peralatan medis, makanan, dan produk lainnya. Proses sterilisasi ini membunuh mikroorganisme berbahaya, meningkatkan keamanan dan umur simpan produk.
- Pengujian bahan: Teknik neutron activation analysis (NAA) menggunakan neutron untuk menganalisis komposisi kimia material. NAA sangat bermanfaat dalam berbagai bidang, seperti arkeologi, geologi, dan forensik.
Soal-Soal Inti Atom
Inti atom, sebagai pusat atom, memiliki peran penting dalam menentukan sifat kimia dan fisika suatu unsur. Pemahaman tentang struktur dan sifat inti atom menjadi dasar untuk mempelajari berbagai fenomena nuklir, seperti reaksi fusi dan fisi, yang memiliki aplikasi luas dalam berbagai bidang, mulai dari energi hingga kedokteran. Untuk menguji pemahaman Anda tentang konsep inti atom, berikut ini beberapa contoh soal yang dapat Anda pelajari.
Soal Pilihan Ganda
Soal pilihan ganda merupakan salah satu bentuk soal yang sering digunakan untuk menguji pemahaman tentang konsep dasar. Berikut beberapa contoh soal pilihan ganda tentang inti atom:
- Partikel penyusun inti atom adalah ….
- Proton dan neutron
- Elektron dan proton
- Neutron dan elektron
- Proton, neutron, dan elektron
- Neutron dan positron
- Jumlah proton dalam inti atom disebut ….
- Nomor atom
- Nomor massa
- Nomor neutron
- Nomor elektron
- Nomor nukleon
- Isotop adalah atom-atom dari unsur yang sama yang memiliki ….
- Jumlah proton yang sama, tetapi jumlah neutron yang berbeda
- Jumlah neutron yang sama, tetapi jumlah proton yang berbeda
- Jumlah proton dan neutron yang sama
- Jumlah elektron yang sama, tetapi jumlah proton yang berbeda
- Jumlah elektron dan proton yang sama
- Inti atom yang stabil memiliki ….
- Perbandingan proton dan neutron yang ideal
- Jumlah proton lebih banyak daripada neutron
- Jumlah neutron lebih banyak daripada proton
- Jumlah proton dan neutron yang sama
- Jumlah proton dan neutron yang tidak seimbang
- Reaksi fusi adalah reaksi inti atom yang ….
- Menggabungkan dua inti atom menjadi satu inti atom yang lebih berat
- Memecah satu inti atom menjadi dua inti atom yang lebih ringan
- Menggabungkan dua atom menjadi satu molekul
- Memecah satu molekul menjadi dua atom
- Menggabungkan dua elektron menjadi satu atom
Soal Uraian
Soal uraian menuntut Anda untuk menjelaskan konsep dengan lebih detail dan menunjukkan pemahaman Anda yang lebih dalam tentang materi. Berikut beberapa contoh soal uraian tentang inti atom:
- Jelaskan struktur inti atom, termasuk partikel penyusunnya dan gaya yang mengikatnya!
- Uraikan sifat-sifat inti atom, seperti nomor atom, nomor massa, dan kestabilan inti!
- Jelaskan perbedaan antara reaksi fusi dan fisi! Berikan contoh masing-masing reaksi!
Soal Essay
Soal essay mendorong Anda untuk menganalisis, mengevaluasi, dan menyintesis informasi yang Anda pelajari. Berikut beberapa contoh soal essay yang mengkaji aplikasi inti atom dalam kehidupan sehari-hari:
- Jelaskan bagaimana inti atom digunakan dalam bidang kedokteran, dengan memberikan contoh-contoh konkret!
- Bagaimana inti atom berperan dalam pembangkitan energi nuklir? Jelaskan prosesnya dan dampaknya terhadap lingkungan!
Pemungkas
Memahami inti atom tidak hanya penting untuk memahami ilmu kimia dan fisika, tetapi juga membuka pintu menuju pemahaman yang lebih dalam tentang alam semesta. Dengan memahami inti atom, kita dapat menjelajahi dunia energi nuklir, teknologi medis yang canggih, dan bahkan misteri asal-usul alam semesta. Jadi, teruslah bertanya, teruslah belajar, dan jangan pernah berhenti untuk menjelajahi keajaiban inti atom!