Contoh soal isomer – Pernahkah Anda membayangkan dua zat yang memiliki rumus kimia sama, namun memiliki sifat dan struktur yang berbeda? Inilah keajaiban dunia kimia, yaitu isomer. Isomer adalah molekul yang memiliki rumus kimia yang sama, tetapi memiliki susunan atom yang berbeda dalam ruang. Konsep ini mungkin terdengar rumit, tetapi sebenarnya sangat menarik dan penting untuk memahami sifat kimia suatu zat.
Dalam artikel ini, kita akan menjelajahi dunia isomer, mulai dari definisi dasar hingga penerapannya dalam kehidupan sehari-hari. Kita akan mempelajari berbagai jenis isomer, rumus strukturnya, sifat fisika dan kimianya, dan bagaimana mereka berperan dalam berbagai bidang seperti farmasi, industri, dan lainnya. Siap untuk menyelami dunia molekul yang menakjubkan ini?
Pengertian Isomer: Contoh Soal Isomer
Isomer adalah senyawa yang memiliki rumus molekul yang sama, tetapi memiliki struktur dan sifat kimia yang berbeda. Bayangkan dua kue yang terbuat dari bahan yang sama, tetapi memiliki bentuk dan rasa yang berbeda. Itulah konsep dasar dari isomer.
Contoh Sederhana Isomer
Sebagai contoh, perhatikan rumus molekul C2H6O. Rumus ini bisa merepresentasikan dua senyawa berbeda, yaitu etanol dan dimetil eter.
Contoh soal isomer biasanya membahas tentang senyawa dengan rumus molekul sama namun struktur berbeda. Nah, untuk memahami konsep prototype, kamu bisa cek contoh soal prototype beserta jawaban di situs ini. Setelah memahami prototype, kamu bisa lebih mudah mengidentifikasi dan membedakan berbagai isomer.
- Etanol (C2H5OH) adalah alkohol yang kita kenal sebagai minuman keras.
- Dimetil eter (CH3OCH3) adalah eter yang merupakan gas pada suhu kamar.
Kedua senyawa ini memiliki rumus molekul yang sama, tetapi struktur dan sifat kimianya berbeda. Etanol memiliki gugus hidroksil (-OH) yang terikat pada atom karbon, sedangkan dimetil eter memiliki atom oksigen yang terikat pada dua atom karbon. Perbedaan struktur ini menyebabkan perbedaan sifat kimia, seperti titik didih dan kelarutan dalam air.
Perbedaan Isomer dan Senyawa yang Bukan Isomer
| Aspek | Isomer | Senyawa yang Bukan Isomer |
|---|---|---|
| Rumus Molekul | Sama | Berbeda |
| Struktur | Berbeda | Berbeda |
| Sifat Kimia | Berbeda | Berbeda |
Tabel di atas menunjukkan perbedaan utama antara isomer dan senyawa yang bukan isomer. Isomer memiliki rumus molekul yang sama, tetapi struktur dan sifat kimianya berbeda. Senyawa yang bukan isomer memiliki rumus molekul, struktur, dan sifat kimia yang berbeda.
Jenis-jenis Isomer
Isomer merupakan senyawa yang memiliki rumus molekul yang sama, namun memiliki struktur dan sifat kimia yang berbeda. Perbedaan struktur ini dapat menyebabkan perbedaan sifat fisik dan kimia yang signifikan, seperti titik leleh, titik didih, dan reaktivitas. Jenis-jenis isomer dibedakan berdasarkan perbedaan struktur yang dimiliki.
Isomer Konstitusional
Isomer konstitusional, juga dikenal sebagai isomer struktur, adalah isomer yang memiliki atom-atom yang terhubung dalam urutan yang berbeda. Dengan kata lain, ikatan antar atomnya berbeda. Isomer konstitusional memiliki rumus molekul yang sama, tetapi memiliki struktur dan sifat kimia yang berbeda.
- Isomer Rantai: Isomer rantai memiliki rantai karbon yang berbeda. Contohnya, butana (C4H10) memiliki dua isomer rantai: n-butana dan isobutana.
- Isomer Posisi: Isomer posisi memiliki gugus fungsi yang terikat pada atom karbon yang berbeda dalam rantai karbon. Contohnya, 1-propanol dan 2-propanol memiliki rumus molekul yang sama (C3H8O), tetapi gugus hidroksil (-OH) terikat pada atom karbon yang berbeda.
- Isomer Fungsi: Isomer fungsi memiliki gugus fungsi yang berbeda. Contohnya, etanol (C2H5OH) dan dimetil eter (CH3OCH3) memiliki rumus molekul yang sama (C2H6O), tetapi memiliki gugus fungsi yang berbeda: etanol memiliki gugus hidroksil, sedangkan dimetil eter memiliki gugus eter.
Isomer Stereoisomer
Isomer stereoisomer adalah isomer yang memiliki atom-atom yang terhubung dalam urutan yang sama, tetapi memiliki pengaturan spasial yang berbeda. Dengan kata lain, ikatan antar atomnya sama, tetapi orientasinya berbeda dalam ruang.
- Isomer Geometri: Isomer geometri terjadi ketika rotasi di sekitar ikatan tunggal terhalang, biasanya karena adanya ikatan rangkap atau siklus. Contohnya, cis-2-butena dan trans-2-butena memiliki rumus molekul yang sama (C4H8), tetapi gugus metil (CH3) terletak pada sisi yang sama (cis) atau sisi yang berlawanan (trans) dari ikatan rangkap.
- Enantiomer: Enantiomer adalah isomer stereoisomer yang merupakan bayangan cermin satu sama lain dan tidak dapat ditimpa. Enantiomer memiliki sifat fisik dan kimia yang hampir sama, tetapi berinteraksi dengan cahaya terpolarisasi bidang secara berbeda. Contohnya, asam laktat memiliki dua enantiomer: L-asam laktat dan D-asam laktat.
- Diastereomer: Diastereomer adalah isomer stereoisomer yang bukan enantiomer. Diastereomer memiliki sifat fisik dan kimia yang berbeda. Contohnya, cis-1,2-diklorosikloheksana dan trans-1,2-diklorosikloheksana adalah diastereomer.
Tabel Ringkasan
| Jenis Isomer | Contoh | Struktur |
|---|---|---|
| Isomer Konstitusional |
|
|
| Isomer Stereoisomer |
|
|
Rumus Struktur Isomer
Isomer adalah senyawa yang memiliki rumus molekul yang sama tetapi memiliki rumus struktur yang berbeda. Rumus struktur isomer menunjukkan bagaimana atom-atom dalam molekul terhubung satu sama lain. Penentuan rumus struktur isomer penting untuk memahami sifat dan perilaku suatu senyawa.
Penentuan Rumus Struktur Isomer
Untuk menentukan rumus struktur isomer, kita perlu memahami bagaimana atom-atom terhubung dalam molekul. Ada beberapa langkah yang dapat kita ikuti:
- Tentukan jumlah atom karbon dalam molekul.
- Tentukan jumlah atom hidrogen dalam molekul.
- Gambarlah rantai karbon utama dengan jumlah atom karbon yang telah ditentukan.
- Tambahkan atom hidrogen ke setiap atom karbon hingga memenuhi valensi karbon (4).
- Periksa apakah ada kemungkinan untuk mengatur atom karbon dalam rantai yang berbeda.
- Jika ada kemungkinan, gambarlah semua kemungkinan rantai karbon.
- Tambahkan atom hidrogen ke setiap atom karbon hingga memenuhi valensi karbon (4).
- Tentukan apakah ada kemungkinan untuk mengatur atom hidrogen dalam posisi yang berbeda pada rantai karbon.
- Jika ada kemungkinan, gambarlah semua kemungkinan posisi atom hidrogen.
Contoh Soal
Misalnya, kita ingin menentukan rumus struktur isomer dari senyawa dengan rumus molekul C4H10.
- Jumlah atom karbon: 4
- Jumlah atom hidrogen: 10
- Gambarlah rantai karbon utama dengan 4 atom karbon: C-C-C-C
- Tambahkan atom hidrogen ke setiap atom karbon hingga memenuhi valensi karbon (4): CH3-CH2-CH2-CH3
- Periksa apakah ada kemungkinan untuk mengatur atom karbon dalam rantai yang berbeda. Ya, ada kemungkinan untuk mengatur atom karbon dalam rantai yang bercabang: CH3-CH(CH3)-CH3
- Gambarlah semua kemungkinan rantai karbon:
- CH3-CH2-CH2-CH3 (n-butana)
- CH3-CH(CH3)-CH3 (isobutana)
- Tambahkan atom hidrogen ke setiap atom karbon hingga memenuhi valensi karbon (4).
- Tentukan apakah ada kemungkinan untuk mengatur atom hidrogen dalam posisi yang berbeda pada rantai karbon. Tidak ada kemungkinan pengaturan atom hidrogen yang berbeda pada kedua isomer ini.
Tabel Langkah-Langkah
| Langkah | Penjelasan |
|---|---|
| 1 | Tentukan jumlah atom karbon dalam molekul. |
| 2 | Tentukan jumlah atom hidrogen dalam molekul. |
| 3 | Gambarlah rantai karbon utama dengan jumlah atom karbon yang telah ditentukan. |
| 4 | Tambahkan atom hidrogen ke setiap atom karbon hingga memenuhi valensi karbon (4). |
| 5 | Periksa apakah ada kemungkinan untuk mengatur atom karbon dalam rantai yang berbeda. |
| 6 | Jika ada kemungkinan, gambarlah semua kemungkinan rantai karbon. |
| 7 | Tambahkan atom hidrogen ke setiap atom karbon hingga memenuhi valensi karbon (4). |
| 8 | Tentukan apakah ada kemungkinan untuk mengatur atom hidrogen dalam posisi yang berbeda pada rantai karbon. |
| 9 | Jika ada kemungkinan, gambarlah semua kemungkinan posisi atom hidrogen. |
Sifat Fisika dan Kimia Isomer
Isomer adalah senyawa kimia yang memiliki rumus molekul yang sama tetapi memiliki struktur kimia yang berbeda. Perbedaan struktur ini menyebabkan perbedaan dalam sifat fisika dan kimia dari isomer. Sifat fisika mengacu pada karakteristik yang dapat diamati tanpa mengubah komposisi kimia zat, seperti titik leleh, titik didih, densitas, dan kelarutan. Sementara sifat kimia mengacu pada bagaimana suatu zat bereaksi dengan zat lain, seperti bagaimana zat terbakar, bereaksi dengan asam atau basa, dan seberapa cepat zat tersebut bereaksi.
Perbedaan Sifat Fisika dan Kimia Isomer
Isomer dapat memiliki sifat fisika dan kimia yang berbeda karena perbedaan dalam struktur molekulnya. Perbedaan struktur ini dapat menyebabkan perbedaan dalam gaya antarmolekul, bentuk molekul, dan distribusi elektron.
- Titik Leleh dan Titik Didih: Isomer dengan gaya antarmolekul yang lebih kuat memiliki titik leleh dan titik didih yang lebih tinggi. Misalnya, isomer rantai lurus memiliki titik leleh dan titik didih yang lebih tinggi daripada isomer bercabang karena gaya Van der Waals yang lebih kuat di antara rantai lurus.
- Densitas: Isomer dengan struktur yang lebih padat memiliki densitas yang lebih tinggi. Misalnya, isomer siklik biasanya memiliki densitas yang lebih tinggi daripada isomer rantai lurus.
- Kelarutan: Kelarutan isomer dapat dipengaruhi oleh polaritas molekul. Isomer polar lebih larut dalam pelarut polar, sedangkan isomer nonpolar lebih larut dalam pelarut nonpolar.
- Reaktivitas: Isomer dapat memiliki reaktivitas yang berbeda karena perbedaan dalam distribusi elektron dan kerentanan terhadap serangan elektrofilik atau nukleofilik. Misalnya, isomer dengan gugus fungsional yang lebih reaktif akan lebih mudah bereaksi.
Contoh Soal, Contoh soal isomer
Perhatikan contoh soal berikut untuk memahami perbedaan sifat fisika dan kimia isomer:
Senyawa dengan rumus molekul C4H10 memiliki dua isomer: butana dan isobutana. Jelaskan perbedaan sifat fisika dan kimia antara kedua isomer tersebut!
Butana adalah isomer rantai lurus, sedangkan isobutana adalah isomer bercabang. Karena struktur yang berbeda, kedua isomer ini memiliki sifat fisika dan kimia yang berbeda.
- Titik Didih: Butana memiliki titik didih yang lebih tinggi (0 °C) daripada isobutana (-12 °C) karena gaya Van der Waals yang lebih kuat di antara molekul butana.
- Densitas: Butana memiliki densitas yang lebih tinggi daripada isobutana karena struktur rantai lurus yang lebih padat.
- Kelarutan: Baik butana maupun isobutana tidak larut dalam air karena keduanya adalah senyawa nonpolar.
- Reaktivitas: Butana dan isobutana memiliki reaktivitas yang mirip karena keduanya memiliki struktur alkana sederhana. Namun, isobutana dapat mengalami reaksi substitusi alkana lebih mudah daripada butana karena gugus metil yang lebih terhalang.
Tabel Perbedaan Sifat Fisika dan Kimia Isomer
| Sifat | Butana (rantai lurus) | Isobutana (bercabang) |
|---|---|---|
| Titik Didih (°C) | 0 | -12 |
| Densitas (g/mL) | 0,601 | 0,558 |
| Kelarutan dalam Air | Tidak Larut | Tidak Larut |
| Reaktivitas | Sedang | Lebih Reaktif (gugus metil terhalang) |
Penerapan Isomer dalam Kehidupan Sehari-hari
Isomer, senyawa dengan rumus molekul yang sama tetapi dengan struktur berbeda, ternyata memiliki peran penting dalam berbagai aspek kehidupan kita. Mulai dari obat-obatan yang kita konsumsi hingga bahan bakar yang kita gunakan, isomer hadir dengan sifat dan fungsi yang unik.
Penerapan Isomer dalam Bidang Farmasi
Isomer memainkan peran penting dalam industri farmasi. Perbedaan struktur isomer dapat menghasilkan efek yang sangat berbeda pada tubuh manusia. Sebagai contoh, ibuprofen dan naproxen, keduanya merupakan obat pereda nyeri, memiliki struktur isomer yang berbeda, yang mengakibatkan perbedaan dalam efek samping dan cara kerja obat tersebut.
- Ibuprofen adalah isomer yang memiliki efek antiinflamasi dan pereda nyeri yang kuat. Ia digunakan untuk meredakan nyeri ringan hingga sedang, seperti nyeri otot, nyeri kepala, dan nyeri menstruasi.
- Naproxen adalah isomer ibuprofen yang memiliki efek yang lebih kuat dan jangka waktu yang lebih lama. Ia digunakan untuk mengobati kondisi yang lebih serius, seperti radang sendi dan osteoarthritis.
Penerapan Isomer dalam Industri Kimia
Isomer juga memiliki peran penting dalam industri kimia. Misalnya, dalam produksi plastik, isomer polimer tertentu menghasilkan sifat yang berbeda. Beberapa isomer menghasilkan plastik yang lebih kuat, lebih fleksibel, atau lebih tahan panas.
- Polietilena (PE) adalah contoh plastik yang memiliki beberapa isomer, masing-masing dengan sifat yang berbeda. PE dengan rantai lurus lebih kuat dan lebih tahan lama, sedangkan PE dengan rantai bercabang lebih fleksibel dan lebih mudah dibentuk.
- Polipropilena (PP) adalah plastik lain yang memiliki isomer, yang menghasilkan sifat yang berbeda. PP dengan struktur isotaktik lebih kuat dan lebih tahan panas, sedangkan PP dengan struktur ataktik lebih fleksibel dan lebih mudah dibentuk.
Penerapan Isomer dalam Bidang Lainnya
Isomer juga memiliki peran penting dalam berbagai bidang lainnya, seperti:
| Bidang | Contoh Penerapan | Keterangan |
|---|---|---|
| Industri Pangan | Isomer lemak (asam lemak trans) | Isomer lemak trans ditemukan dalam margarin dan beberapa produk makanan olahan. Isomer trans memiliki efek negatif pada kesehatan jantung. |
| Industri Minyak dan Gas | Isomer hidrokarbon | Isomer hidrokarbon digunakan dalam produksi bahan bakar, seperti bensin dan solar. Isomer dengan rantai bercabang memiliki sifat pembakaran yang lebih baik, yang menghasilkan emisi yang lebih rendah. |
| Industri Parfum | Isomer minyak atsiri | Isomer minyak atsiri menghasilkan aroma yang berbeda. Misalnya, isomer limonene memiliki aroma jeruk, sedangkan isomer alfa-pinen memiliki aroma pinus. |
Contoh Soal Ujian Isomer
Isomer merupakan senyawa yang memiliki rumus molekul sama, tetapi struktur dan sifatnya berbeda. Isomer merupakan konsep penting dalam kimia organik karena mempengaruhi sifat dan reaktivitas suatu senyawa. Untuk menguji pemahaman tentang konsep isomer, berikut ini contoh soal ujian yang menantang.
Contoh Soal Ujian Isomer
Berikut ini contoh soal ujian isomer yang dapat digunakan untuk menguji pemahaman konsep:
- Tuliskan rumus struktur dan nama IUPAC untuk semua isomer dengan rumus molekul C4H8.
- Jelaskan perbedaan antara isomer struktur dan isomer geometri. Berikan contoh masing-masing.
- Bagaimana pengaruh isomer pada sifat fisika dan kimia suatu senyawa? Jelaskan dengan contoh.
Tabel Soal Ujian Isomer
Berikut tabel yang menunjukkan soal ujian isomer dengan kunci jawaban:
| No. | Soal | Kunci Jawaban |
|---|---|---|
| 1 | Tuliskan rumus struktur dan nama IUPAC untuk semua isomer dengan rumus molekul C4H8. |
|
| 2 | Jelaskan perbedaan antara isomer struktur dan isomer geometri. Berikan contoh masing-masing. |
|
| 3 | Bagaimana pengaruh isomer pada sifat fisika dan kimia suatu senyawa? Jelaskan dengan contoh. | Isomer dapat memiliki sifat fisika dan kimia yang berbeda karena struktur molekulnya berbeda.
|
Pembahasan Soal Ujian Isomer
Berikut pembahasan lengkap untuk setiap soal ujian isomer:
Soal 1: Rumus Struktur dan Nama IUPAC untuk Isomer C4H8
Rumus molekul C4H8 menunjukkan bahwa terdapat 5 isomer:
- Butana: Merupakan alkana dengan rantai lurus 4 karbon.
- 2-Metilpropana: Merupakan alkana bercabang dengan 3 karbon pada rantai utama dan 1 karbon pada cabang.
- 1-Butena: Merupakan alkena dengan ikatan rangkap pada karbon pertama.
- 2-Butena: Merupakan alkena dengan ikatan rangkap pada karbon kedua. Terdapat 2 isomer geometri, yaitu cis-2-butena dan trans-2-butena.
- Siklobutana: Merupakan sikloalkana dengan 4 karbon dalam bentuk siklus.
Soal 2: Perbedaan Isomer Struktur dan Isomer Geometri
- Isomer struktur memiliki perbedaan dalam susunan atom-atom dalam molekul. Artinya, atom-atom terhubung dalam urutan yang berbeda. Contoh: Butana dan 2-metilpropana memiliki rumus molekul yang sama (C4H8), tetapi susunan atom-atomnya berbeda.
- Isomer geometri memiliki perbedaan dalam susunan spasial atom-atom dalam molekul, terutama pada ikatan rangkap. Artinya, atom-atom terhubung dalam urutan yang sama, tetapi posisinya dalam ruang berbeda. Contoh: cis-2-butena dan trans-2-butena memiliki rumus molekul yang sama (C4H8) dan susunan atom yang sama, tetapi posisi gugus metil (CH3) pada ikatan rangkap berbeda.
Soal 3: Pengaruh Isomer pada Sifat Fisika dan Kimia
Isomer dapat memiliki sifat fisika dan kimia yang berbeda karena struktur molekulnya berbeda.
- Titik didih: Isomer dengan rantai lurus memiliki titik didih yang lebih tinggi daripada isomer bercabang. Hal ini karena isomer dengan rantai lurus memiliki luas permukaan yang lebih besar, sehingga gaya antarmolekul lebih kuat.
- Kelarutan: Isomer dengan rantai lurus lebih mudah larut dalam air daripada isomer bercabang. Hal ini karena isomer dengan rantai lurus lebih mudah membentuk ikatan hidrogen dengan molekul air.
- Reaktivitas: Isomer dapat memiliki reaktivitas yang berbeda karena perbedaan dalam susunan atom-atomnya. Contoh: cis-2-butena lebih reaktif daripada trans-2-butena karena ikatan rangkapnya lebih mudah diputus.
Penjelasan Isomer Berdasarkan Teori Ikatan Valensi
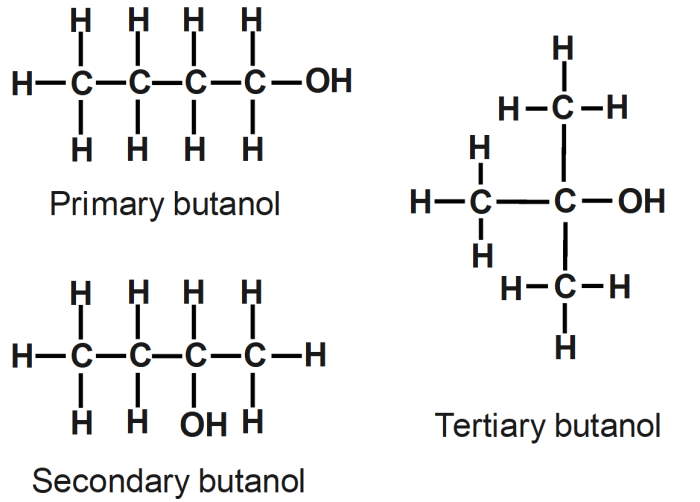
Teori ikatan valensi merupakan konsep yang mendasari pemahaman tentang bagaimana atom-atom saling berikatan untuk membentuk molekul. Teori ini membantu kita menjelaskan bentuk molekul, sifat kimia, dan keberadaan isomer. Isomer sendiri adalah molekul yang memiliki rumus molekul yang sama, namun memiliki struktur dan susunan atom yang berbeda, sehingga menghasilkan sifat kimia yang berbeda pula.
Penerapan Teori Ikatan Valensi dalam Menentukan Isomer
Teori ikatan valensi membantu kita memahami bagaimana atom-atom saling berikatan dan membentuk molekul. Dalam teori ini, ikatan kimia dibentuk oleh pemakaian bersama pasangan elektron antara dua atom. Jumlah ikatan yang dapat dibentuk oleh suatu atom ditentukan oleh jumlah elektron valensi yang dimilikinya. Berdasarkan jumlah ikatan dan susunan atom, kita dapat menentukan kemungkinan isomer yang dapat terbentuk.
- Jumlah Ikatan: Jumlah ikatan yang dapat dibentuk oleh suatu atom menentukan jumlah atom lain yang dapat berikatan dengannya. Misalnya, atom karbon memiliki empat elektron valensi, sehingga dapat membentuk empat ikatan kovalen.
- Susunan Atom: Susunan atom dalam molekul menentukan bentuk molekul dan sifat kimianya. Isomer memiliki rumus molekul yang sama, tetapi susunan atomnya berbeda, sehingga menghasilkan bentuk molekul yang berbeda dan sifat kimia yang berbeda.
Contoh Soal Isomer Berdasarkan Teori Ikatan Valensi
Berikut contoh soal untuk mengilustrasikan penerapan teori ikatan valensi dalam menentukan isomer:
Tentukan kemungkinan isomer untuk senyawa dengan rumus molekul C4H10.
Penyelesaian:
- Atom karbon memiliki empat elektron valensi, sehingga dapat membentuk empat ikatan kovalen.
- Atom hidrogen memiliki satu elektron valensi, sehingga dapat membentuk satu ikatan kovalen.
- Dengan menggunakan teori ikatan valensi, kita dapat menyusun berbagai kemungkinan struktur molekul untuk C4H10.
| Struktur Molekul | Nama | Keterangan |
|---|---|---|
 |
Butana | Rantai lurus dengan empat atom karbon. |
 |
Isobutana | Rantai bercabang dengan tiga atom karbon pada rantai utama dan satu atom karbon terikat pada atom karbon kedua. |
Dari tabel di atas, terlihat bahwa C4H10 memiliki dua isomer: butana dan isobutana. Keduanya memiliki rumus molekul yang sama, tetapi susunan atomnya berbeda, sehingga menghasilkan bentuk molekul dan sifat kimia yang berbeda.
Isomer dan Spektroskopi
Isomer adalah molekul yang memiliki rumus kimia yang sama tetapi memiliki struktur dan sifat yang berbeda. Karena memiliki struktur yang berbeda, isomer dapat dibedakan dengan menggunakan teknik spektroskopi. Spektroskopi adalah studi tentang interaksi antara materi dan radiasi elektromagnetik.
Spektroskopi dan Isomer
Spektroskopi merupakan alat yang sangat berguna untuk membedakan isomer. Hal ini karena setiap isomer memiliki spektrum yang unik, yang mencerminkan struktur molekulnya.
Contoh Spektrum Isomer
Sebagai contoh, perhatikan spektrum inframerah (IR) dari dua isomer butana, yaitu n-butana dan isobutana.
Spektrum IR n-butana menunjukkan puncak serapan yang berbeda dari spektrum IR isobutana. Hal ini karena perbedaan struktur kedua isomer tersebut.
n-butana memiliki rantai lurus, sedangkan isobutana memiliki struktur bercabang. Perbedaan ini menghasilkan perbedaan dalam getaran molekul, yang kemudian terlihat dalam spektrum IR.
Teknik Spektroskopi untuk Identifikasi Isomer
- Spektroskopi Inframerah (IR): Teknik ini mengukur serapan radiasi inframerah oleh molekul. Serapan ini unik untuk setiap jenis ikatan dan gugus fungsi dalam molekul. Perbedaan dalam struktur isomer akan menghasilkan perbedaan dalam spektrum IR.
- Spektroskopi Resonansi Magnetik Inti (NMR): Teknik ini mempelajari interaksi inti atom dengan medan magnet. Spektrum NMR sangat sensitif terhadap lingkungan kimia atom dalam molekul. Isomer memiliki lingkungan kimia yang berbeda, yang menghasilkan perbedaan dalam spektrum NMR.
- Spektroskopi Massa (MS): Teknik ini melibatkan ionisasi molekul dan pengukuran rasio massa terhadap muatan ion yang dihasilkan. Spektrum massa memberikan informasi tentang massa molekul dan fragmen molekul. Isomer dapat dibedakan berdasarkan pola fragmentasi mereka dalam spektrum massa.
Isomer dalam Kimia Organik
Isomer adalah senyawa kimia yang memiliki rumus molekul yang sama tetapi memiliki struktur kimia yang berbeda. Hal ini berarti bahwa isomer memiliki jumlah atom yang sama dari setiap elemen, tetapi atom-atom tersebut disusun dalam urutan yang berbeda. Perbedaan struktur ini dapat menyebabkan perbedaan sifat kimia dan fisik antara isomer.
Peran Isomer dalam Kimia Organik
Isomer memainkan peran penting dalam kimia organik, khususnya dalam reaksi dan sintesis organik. Berikut adalah beberapa peran penting isomer:
- Reaktivitas: Isomer dapat memiliki reaktivitas yang berbeda karena struktur kimianya yang berbeda. Misalnya, isomer alkana rantai lurus lebih reaktif daripada isomer alkana rantai bercabang. Hal ini karena ikatan C-H dalam alkana rantai lurus lebih mudah diputus dibandingkan dengan ikatan C-H dalam alkana rantai bercabang.
- Sifat Fisik: Isomer juga dapat memiliki sifat fisik yang berbeda, seperti titik didih, titik leleh, dan kelarutan. Misalnya, isomer alkana rantai lurus memiliki titik didih yang lebih tinggi daripada isomer alkana rantai bercabang. Hal ini karena gaya Van der Waals yang lebih kuat antara molekul alkana rantai lurus.
- Sintesis Organik: Isomer digunakan dalam sintesis organik untuk membuat senyawa organik baru. Misalnya, reaksi Diels-Alder dapat digunakan untuk mensintesis senyawa siklik dari diena dan dienofil. Reaksi ini dapat menghasilkan berbagai isomer, tergantung pada struktur diena dan dienofil.
Contoh Reaksi Organik yang Melibatkan Isomer
Berikut adalah beberapa contoh reaksi organik yang melibatkan isomer:
- Isomerisasi: Isomerisasi adalah proses perubahan struktur kimia suatu senyawa menjadi isomernya. Misalnya, reaksi isomerisasi alkana dapat menghasilkan isomer rantai lurus menjadi isomer rantai bercabang. Reaksi ini biasanya dikatalisis oleh asam atau basa.
- Reaksi Adisi: Reaksi adisi adalah reaksi di mana dua atau lebih molekul bergabung untuk membentuk molekul yang lebih besar. Reaksi adisi dapat menghasilkan isomer, tergantung pada tempat adisi terjadi. Misalnya, reaksi adisi HBr ke alkena dapat menghasilkan dua isomer, yaitu isomer markovnikov dan isomer anti-markovnikov.
- Reaksi Eliminasi: Reaksi eliminasi adalah reaksi di mana suatu molekul kecil, seperti air atau HCl, dihilangkan dari molekul yang lebih besar. Reaksi eliminasi dapat menghasilkan isomer, tergantung pada posisi gugus yang dihilangkan. Misalnya, reaksi eliminasi alkohol dapat menghasilkan alkena, yang dapat berupa isomer cis atau trans.
Tabel Contoh Reaksi Organik yang Melibatkan Isomer
Berikut adalah tabel yang menunjukkan contoh reaksi organik yang melibatkan isomer:
| Reaksi | Reaktan | Produk | Jenis Isomer |
|---|---|---|---|
| Isomerisasi | n-butana | iso-butana | Isomer struktur |
| Adisi | Etena + HBr | Bromoetana | Isomer markovnikov dan anti-markovnikov |
| Eliminasi | 2-butanol | 2-butena | Isomer cis dan trans |
Penutupan Akhir
Memahami konsep isomer sangat penting dalam kimia, terutama dalam kimia organik. Dengan memahami bagaimana struktur molekul memengaruhi sifatnya, kita dapat merancang dan mengembangkan berbagai macam senyawa baru dengan fungsi yang spesifik. Dari obat-obatan yang menyelamatkan jiwa hingga bahan bakar yang efisien, isomer memainkan peran penting dalam kemajuan ilmu pengetahuan dan teknologi. Jadi, mari kita terus mempelajari keajaiban isomer dan bagaimana mereka membentuk dunia kita.



