Contoh soal perhitungan kimia – Dunia kimia penuh dengan angka dan rumus, dan menguasai perhitungan kimia merupakan kunci untuk memahami berbagai reaksi dan proses kimia yang terjadi di sekitar kita. Dari menentukan jumlah bahan yang tepat untuk membuat kue hingga memahami reaksi kimia dalam tubuh kita, perhitungan kimia memiliki peran penting dalam kehidupan sehari-hari.
Dalam artikel ini, kita akan menjelajahi berbagai konsep dasar perhitungan kimia, mulai dari stoikiometri hingga termokimia. Siapkan pena dan kertas, karena kita akan menjelajahi berbagai contoh soal perhitungan kimia dan langkah-langkah penyelesaiannya yang mudah dipahami.
Pengertian Perhitungan Kimia
Perhitungan kimia merupakan cabang ilmu kimia yang mempelajari tentang perhitungan kuantitatif dalam reaksi kimia. Dengan kata lain, perhitungan kimia adalah cara untuk menghitung jumlah zat, massa, volume, dan konsentrasi yang terlibat dalam reaksi kimia.
Contoh Penerapan Perhitungan Kimia dalam Kehidupan Sehari-hari
Perhitungan kimia memiliki peran penting dalam berbagai aspek kehidupan sehari-hari. Misalnya, dalam memasak, perhitungan kimia membantu menentukan jumlah bahan yang tepat untuk menghasilkan hidangan yang lezat. Perhitungan kimia juga digunakan dalam industri farmasi untuk memastikan dosis obat yang tepat dan aman bagi pasien.
Perbandingan Perhitungan Kimia dengan Bidang Lain
Perhitungan kimia memiliki kesamaan dan perbedaan dengan konsep perhitungan di bidang lain, seperti matematika dan fisika. Berikut tabel yang membandingkan ketiganya:
| Aspek | Perhitungan Kimia | Matematika | Fisika |
|---|---|---|---|
| Fokus | Kuantifikasi reaksi kimia | Hubungan antar kuantitas abstrak | Hukum-hukum alam dan fenomena fisik |
| Metode | Stoikiometri, kimia analitik | Aljabar, kalkulus, statistika | Kinematika, dinamika, termodinamika |
| Aplikasi | Sintesis kimia, analisis kimia | Pemrograman, keuangan, sains data | Teknik, kedokteran, astronomi |
Stoikiometri
Stoikiometri merupakan cabang ilmu kimia yang mempelajari tentang kuantitas zat yang terlibat dalam reaksi kimia. Secara sederhana, stoikiometri membahas tentang perhitungan kimia yang berhubungan dengan jumlah zat, baik berupa massa, mol, volume, atau konsentrasi. Konsep ini sangat penting dalam kimia karena membantu kita memahami dan memprediksi hasil reaksi kimia, serta menghitung jumlah zat yang dibutuhkan atau dihasilkan dalam suatu reaksi.
Konsep Dasar Stoikiometri
Stoikiometri didasarkan pada hukum-hukum dasar kimia, seperti hukum kekekalan massa, hukum perbandingan tetap, dan hukum perbandingan berganda. Hukum kekekalan massa menyatakan bahwa massa total zat sebelum dan sesudah reaksi kimia tetap sama. Hukum perbandingan tetap menyatakan bahwa suatu senyawa selalu tersusun atas unsur-unsur yang sama dalam perbandingan massa yang tetap. Sedangkan hukum perbandingan berganda menyatakan bahwa jika dua unsur membentuk lebih dari satu senyawa, maka perbandingan massa salah satu unsur terhadap massa unsur lainnya dalam senyawa tersebut merupakan bilangan bulat sederhana.
Konsep utama dalam stoikiometri adalah mol. Mol merupakan satuan jumlah zat yang setara dengan 6,022 x 1023 partikel (atom, molekul, ion, atau entitas lainnya). Mol merupakan satuan yang sangat penting dalam stoikiometri karena memungkinkan kita untuk membandingkan jumlah zat yang berbeda dalam reaksi kimia.
Contoh Soal Perhitungan Stoikiometri
Sebagai contoh, perhatikan reaksi pembakaran metana (CH4) berikut:
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (g)
Persamaan reaksi tersebut menunjukkan bahwa 1 mol metana bereaksi dengan 2 mol oksigen untuk menghasilkan 1 mol karbon dioksida dan 2 mol air.
Misalkan kita ingin menghitung massa karbon dioksida (CO2) yang dihasilkan dari pembakaran 16 gram metana (CH4). Langkah-langkah penyelesaiannya adalah sebagai berikut:
1. Hitung mol metana (CH4):
Massa molar CH4 = 12,01 g/mol + 4 x 1,01 g/mol = 16,05 g/mol
Mol CH4 = Massa CH4 / Massa molar CH4 = 16 g / 16,05 g/mol = 0,997 mol
2. Hitung mol karbon dioksida (CO2):
Berdasarkan persamaan reaksi, 1 mol CH4 menghasilkan 1 mol CO2.
Maka, 0,997 mol CH4 menghasilkan 0,997 mol CO2.
3. Hitung massa karbon dioksida (CO2):
Massa molar CO2 = 12,01 g/mol + 2 x 16,00 g/mol = 44,01 g/mol
Massa CO2 = Mol CO2 x Massa molar CO2 = 0,997 mol x 44,01 g/mol = 43,88 g
Jadi, massa karbon dioksida (CO2) yang dihasilkan dari pembakaran 16 gram metana (CH4) adalah 43,88 gram.
Rumus-rumus Penting dalam Stoikiometri, Contoh soal perhitungan kimia
Berikut adalah tabel yang berisi rumus-rumus penting dalam stoikiometri dan contoh penggunaannya:
| Rumus | Keterangan | Contoh Penggunaan |
|---|---|---|
| n = m/M | n = jumlah mol, m = massa, M = massa molar | Hitung mol 10 gram NaOH (massa molar NaOH = 40 g/mol): n = 10 g / 40 g/mol = 0,25 mol |
| n = V/Vm | n = jumlah mol, V = volume gas, Vm = volume molar gas (22,4 L/mol pada STP) | Hitung mol 5,6 L gas nitrogen (N2) pada STP: n = 5,6 L / 22,4 L/mol = 0,25 mol |
| n = c x V | n = jumlah mol, c = konsentrasi, V = volume larutan | Hitung mol NaCl dalam 250 mL larutan NaCl 0,1 M: n = 0,1 mol/L x 0,25 L = 0,025 mol |
| n = N/NA | n = jumlah mol, N = jumlah partikel, NA = bilangan Avogadro (6,022 x 1023 partikel/mol) | Hitung mol 1,2044 x 1024 molekul air (H2O): n = 1,2044 x 1024 / 6,022 x 1023 mol-1 = 2 mol |
Larutan
Larutan merupakan campuran homogen yang terdiri dari zat terlarut (solute) dan pelarut (solvent). Zat terlarut adalah zat yang dilarutkan dalam pelarut, sedangkan pelarut adalah zat yang melarutkan zat terlarut. Konsentrasi larutan menyatakan jumlah zat terlarut dalam larutan.
Konsep Konsentrasi Larutan
Konsentrasi larutan merupakan ukuran yang menunjukkan banyaknya zat terlarut yang terkandung dalam suatu larutan. Semakin banyak zat terlarut dalam suatu larutan, semakin tinggi konsentrasinya. Konsentrasi larutan penting dalam berbagai aplikasi, seperti dalam kimia, biologi, dan farmasi.
Satuan Konsentrasi Larutan
Ada beberapa satuan yang digunakan untuk menyatakan konsentrasi larutan, di antaranya:
- Persentase (%): Persentase menyatakan jumlah zat terlarut dalam 100 bagian larutan. Terdapat beberapa jenis persentase, yaitu persentase massa/massa (%), persentase volume/volume (%), dan persentase massa/volume (%).
- Molaritas (M): Molaritas menyatakan jumlah mol zat terlarut dalam 1 liter larutan. Satuan molaritas adalah mol/L atau M.
- Molalitas (m): Molalitas menyatakan jumlah mol zat terlarut dalam 1 kg pelarut. Satuan molalitas adalah mol/kg atau m.
- Fraksi mol (X): Fraksi mol menyatakan perbandingan jumlah mol zat terlarut terhadap jumlah mol total zat dalam larutan. Fraksi mol tidak memiliki satuan.
- Parts per million (ppm): Parts per million menyatakan jumlah zat terlarut dalam 1 juta bagian larutan. Satuan ppm sering digunakan untuk menyatakan konsentrasi zat pencemar dalam air atau udara.
Contoh Soal Perhitungan Konsentrasi Larutan
Soal:
Seorang siswa melarutkan 5,85 gram NaCl (Mr = 58,5 g/mol) dalam air hingga volume larutan menjadi 250 mL. Hitunglah konsentrasi larutan NaCl dalam satuan molaritas!
Penyelesaian:
1. Hitung jumlah mol NaCl:
“`
mol NaCl = massa NaCl / Mr NaCl
mol NaCl = 5,85 g / 58,5 g/mol
mol NaCl = 0,1 mol
“`
2. Hitung konsentrasi larutan NaCl dalam molaritas:
“`
Molaritas = mol NaCl / volume larutan (L)
Molaritas = 0,1 mol / 0,25 L
Molaritas = 0,4 M
“`
Jadi, konsentrasi larutan NaCl adalah 0,4 M.
Tabel Rumus Perhitungan Konsentrasi Larutan
| Satuan Konsentrasi | Rumus | Contoh Penggunaan |
|---|---|---|
| Persentase (%) | % = (massa zat terlarut / massa larutan) x 100% | Menghitung persentase kadar gula dalam minuman |
| Molaritas (M) | M = mol zat terlarut / volume larutan (L) | Menghitung konsentrasi larutan HCl dalam reaksi kimia |
| Molalitas (m) | m = mol zat terlarut / massa pelarut (kg) | Menghitung penurunan titik beku larutan |
| Fraksi mol (X) | X = mol zat terlarut / mol total zat dalam larutan | Menghitung tekanan uap larutan |
| Parts per million (ppm) | ppm = (massa zat terlarut / massa larutan) x 10^6 | Menghitung konsentrasi logam berat dalam air minum |
Stoikiometri Larutan
Stoikiometri larutan merupakan cabang ilmu kimia yang mempelajari hubungan kuantitatif antara zat-zat yang terlibat dalam reaksi kimia dalam larutan. Stoikiometri larutan memungkinkan kita untuk menghitung jumlah zat yang bereaksi, produk yang dihasilkan, dan konsentrasi larutan yang terlibat dalam reaksi kimia.
Konsep Stoikiometri Larutan
Konsep stoikiometri larutan didasarkan pada prinsip-prinsip dasar stoikiometri, yang menghubungkan jumlah mol zat dengan massa, volume, dan konsentrasi. Dalam reaksi kimia dalam larutan, konsentrasi larutan menjadi faktor penting yang menentukan jumlah zat yang bereaksi.
Stoikiometri larutan membantu kita memahami hubungan antara konsentrasi larutan, volume larutan, dan jumlah mol zat yang terlibat dalam reaksi. Dengan memahami konsep ini, kita dapat menghitung jumlah zat yang dibutuhkan untuk menghasilkan produk tertentu, menentukan konsentrasi larutan yang diperlukan, dan memprediksi hasil reaksi kimia dalam larutan.
Contoh Soal Perhitungan Stoikiometri Larutan
Soal:
Sebuah larutan 0,5 M NaOH direaksikan dengan larutan HCl 0,25 M. Jika volume larutan NaOH adalah 25 mL, berapa volume larutan HCl yang dibutuhkan untuk menetralkan NaOH tersebut?
Penyelesaian:
1. Tuliskan persamaan reaksi:
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O (l)
2. Hitung mol NaOH:
Mol NaOH = Konsentrasi NaOH x Volume NaOH
Mol NaOH = 0,5 M x 0,025 L = 0,0125 mol
3. Tentukan perbandingan mol NaOH dan HCl:
Dari persamaan reaksi, terlihat bahwa perbandingan mol NaOH dan HCl adalah 1:1. Artinya, untuk menetralkan 0,0125 mol NaOH, dibutuhkan 0,0125 mol HCl.
4. Hitung volume larutan HCl:
Volume HCl = Mol HCl / Konsentrasi HCl
Volume HCl = 0,0125 mol / 0,25 M = 0,05 L = 50 mL
Jadi, volume larutan HCl yang dibutuhkan untuk menetralkan NaOH adalah 50 mL.
Perhitungan Volume Larutan
Untuk mereaksikan sejumlah tertentu zat, volume larutan yang diperlukan dapat dihitung dengan menggunakan rumus:
Volume larutan = (Jumlah mol zat / Konsentrasi larutan)
Rumus ini berlaku untuk reaksi kimia dalam larutan, di mana kita mengetahui jumlah mol zat yang ingin direaksikan dan konsentrasi larutan yang tersedia. Dengan menggunakan rumus ini, kita dapat menentukan volume larutan yang tepat untuk mereaksikan sejumlah tertentu zat.
Titrasi
Titrasi adalah teknik analisis kimia yang digunakan untuk menentukan konsentrasi zat terlarut yang tidak diketahui dengan cara mereaksikan zat tersebut dengan larutan standar yang konsentrasinya telah diketahui. Dalam titrasi, larutan standar, yang disebut titran, ditambahkan secara bertahap ke dalam larutan yang akan dianalisis, yang disebut analit, hingga reaksi antara titran dan analit selesai. Titik akhir titrasi, yaitu saat reaksi selesai, ditandai dengan perubahan warna indikator yang ditambahkan ke dalam larutan analit.
Jenis-jenis Titrasi
Titrasi dapat diklasifikasikan berdasarkan jenis reaksi yang terjadi antara titran dan analit. Berikut adalah beberapa jenis titrasi yang umum digunakan dalam perhitungan kimia:
- Titrasi Asam-Basa: Titrasi ini melibatkan reaksi antara asam dan basa. Contohnya, titrasi asam kuat (HCl) dengan basa kuat (NaOH) atau titrasi asam lemah (CH3COOH) dengan basa kuat (NaOH).
- Titrasi Redoks: Titrasi ini melibatkan reaksi redoks, yaitu reaksi yang melibatkan perpindahan elektron. Contohnya, titrasi larutan Fe2+ dengan larutan KMnO4.
- Titrasi Presipitasi: Titrasi ini melibatkan reaksi yang menghasilkan endapan. Contohnya, titrasi larutan Ag+ dengan larutan Cl- untuk membentuk endapan AgCl.
- Titrasi Kompleksometri: Titrasi ini melibatkan reaksi pembentukan kompleks antara ion logam dan ligan. Contohnya, titrasi larutan Ca2+ dengan larutan EDTA.
Contoh Soal Perhitungan Titrasi
Misalkan kita ingin menentukan konsentrasi larutan asam cuka (CH3COOH) yang tidak diketahui dengan menggunakan larutan NaOH standar 0,1 M.
Langkah-langkah Penyelesaian:
1. Menentukan persamaan reaksi:
“`
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
“`
2. Menentukan volume NaOH yang dibutuhkan untuk menetralkan larutan asam cuka.
Misalnya, 25 mL larutan asam cuka direaksikan dengan 15 mL larutan NaOH 0,1 M hingga mencapai titik ekivalen.
3. Menghitung mol NaOH yang digunakan:
“`
mol NaOH = konsentrasi NaOH x volume NaOH
mol NaOH = 0,1 M x 15 mL = 1,5 mmol
“`
4. Menentukan mol asam cuka yang bereaksi dengan NaOH:
Dari persamaan reaksi, perbandingan mol CH3COOH dan NaOH adalah 1:1. Jadi, mol CH3COOH = mol NaOH = 1,5 mmol.
5. Menghitung konsentrasi asam cuka:
“`
konsentrasi CH3COOH = mol CH3COOH / volume CH3COOH
konsentrasi CH3COOH = 1,5 mmol / 25 mL = 0,06 M
“`
Jadi, konsentrasi larutan asam cuka yang tidak diketahui adalah 0,06 M.
Rumus Perhitungan Titrasi
| Rumus | Keterangan | Contoh Penggunaan |
|—|—|—|
| `mol = konsentrasi x volume` | Menghitung mol zat terlarut | Menghitung mol NaOH yang digunakan dalam titrasi |
| `mol = massa / massa molar` | Menghitung mol zat terlarut dari massa dan massa molarnya | Menghitung mol asam cuka yang bereaksi dengan NaOH |
| `konsentrasi = mol / volume` | Menghitung konsentrasi zat terlarut | Menghitung konsentrasi asam cuka yang tidak diketahui |
| `titik ekivalen = mol titran = mol analit` | Menunjukkan kondisi saat titran dan analit habis bereaksi | Menentukan mol asam cuka yang bereaksi dengan NaOH |
| `titik akhir = titik ekivalen + kesalahan titrasi` | Titik akhir titrasi yang ditandai dengan perubahan warna indikator | Menentukan volume titran yang digunakan untuk mencapai titik akhir titrasi |
Termokimia: Contoh Soal Perhitungan Kimia
Termokimia merupakan cabang ilmu kimia yang mempelajari tentang perubahan kalor yang menyertai reaksi kimia. Kalor yang terlibat dalam reaksi kimia disebut dengan entalpi, yang merupakan jumlah energi internal suatu sistem pada tekanan tetap. Perubahan entalpi, dilambangkan dengan ΔH, menunjukkan perubahan energi dalam suatu reaksi kimia. Nilai ΔH dapat bernilai positif atau negatif, yang mengindikasikan apakah reaksi tersebut melepaskan atau menyerap kalor.
Perubahan Entalpi Reaksi
Perubahan entalpi reaksi adalah jumlah kalor yang diserap atau dilepas pada tekanan tetap ketika reaksi kimia berlangsung. Jika ΔH bernilai negatif, maka reaksi tersebut melepaskan kalor (eksotermik), dan jika ΔH bernilai positif, maka reaksi tersebut menyerap kalor (endotermik).
Perubahan entalpi reaksi dapat dihitung dengan beberapa metode, seperti:
- Menggunakan data entalpi pembentukan standar (ΔHf°) dari reaktan dan produk.
- Menggunakan hukum Hess, yaitu prinsip bahwa perubahan entalpi total suatu reaksi adalah sama, terlepas dari jumlah tahap yang terlibat dalam reaksi tersebut.
- Menggunakan data entalpi ikatan, yaitu energi yang dibutuhkan untuk memutuskan ikatan kimia dalam satu mol zat.
Kinetika Kimia
Kinetika kimia mempelajari laju dan mekanisme reaksi kimia. Laju reaksi merupakan ukuran seberapa cepat reaksi berlangsung, yang dapat didefinisikan sebagai perubahan konsentrasi reaktan atau produk per satuan waktu. Kinetika kimia sangat penting dalam berbagai bidang, seperti industri kimia, biologi, dan lingkungan, untuk memahami dan mengontrol reaksi kimia.
Contoh soal perhitungan kimia bisa beragam, mulai dari menghitung massa molar hingga menentukan konsentrasi larutan. Salah satu contoh yang sering dijumpai adalah soal konversi satuan massa, seperti mengubah kilogram ke gram. Untuk lebih memahami konversi ini, kamu bisa mempelajari contoh soal yang tersedia di contoh soal kg ke gram.
Setelah menguasai konversi satuan, kamu akan lebih mudah menyelesaikan soal-soal perhitungan kimia lainnya.
Konsep Kinetika Kimia dan Hubungannya dengan Laju Reaksi
Kinetika kimia membahas faktor-faktor yang memengaruhi laju reaksi dan bagaimana laju reaksi dapat diukur. Salah satu konsep penting dalam kinetika kimia adalah orde reaksi. Orde reaksi menunjukkan bagaimana laju reaksi dipengaruhi oleh perubahan konsentrasi reaktan. Orde reaksi ditentukan secara eksperimen dan dapat berupa bilangan bulat, pecahan, atau bahkan nol.
Misalnya, reaksi A + B → C memiliki orde reaksi 1 terhadap A dan 2 terhadap B. Ini berarti bahwa laju reaksi akan berlipat ganda jika konsentrasi A digandakan, dan akan berlipat empat jika konsentrasi B digandakan. Orde reaksi total untuk reaksi ini adalah 3 (1 + 2).
Contoh Soal Perhitungan Kinetika Kimia
Berikut adalah contoh soal perhitungan kinetika kimia:
Reaksi dekomposisi N2O5 menjadi NO2 dan O2 memiliki persamaan laju berikut:
Laju = k[N2O5]
di mana k adalah konstanta laju reaksi. Jika konsentrasi awal N2O5 adalah 0,1 M dan konstanta laju reaksi adalah 1,5 x 10-5 s-1, hitunglah konsentrasi N2O5 setelah 100 detik.
Berikut langkah-langkah penyelesaiannya:
- Tuliskan persamaan laju reaksi: Laju = k[N2O5]
- Tentukan orde reaksi terhadap N2O5. Berdasarkan persamaan laju, orde reaksi terhadap N2O5 adalah 1.
- Gunakan persamaan laju terintegrasi untuk menghitung konsentrasi N2O5 setelah 100 detik. Persamaan laju terintegrasi untuk reaksi orde pertama adalah:
ln[N2O5]t – ln[N2O5]0 = -kt
di mana:
- [N2O5]t adalah konsentrasi N2O5 pada waktu t
- [N2O5]0 adalah konsentrasi awal N2O5
- k adalah konstanta laju reaksi
- t adalah waktu
- Substitusikan nilai yang diketahui ke dalam persamaan laju terintegrasi:
ln[N2O5]100 – ln(0,1) = -(1,5 x 10-5 s-1)(100 s)
- Selesaikan persamaan untuk mencari [N2O5]100:
ln[N2O5]100 = -1,5 x 10-3 + ln(0,1)
[N2O5]100 = e(-1,5 x 10-3 + ln(0,1)) = 0,0985 M
Jadi, konsentrasi N2O5 setelah 100 detik adalah 0,0985 M.
Faktor-faktor yang Memengaruhi Laju Reaksi
Laju reaksi dipengaruhi oleh beberapa faktor, yaitu:
- Konsentrasi reaktan: Semakin tinggi konsentrasi reaktan, semakin tinggi laju reaksi. Hal ini karena lebih banyak molekul reaktan yang bertabrakan, sehingga peluang terjadinya reaksi semakin besar.
- Suhu: Semakin tinggi suhu, semakin tinggi laju reaksi. Hal ini karena energi kinetik molekul meningkat, sehingga lebih banyak molekul yang memiliki energi aktivasi yang cukup untuk bereaksi.
- Luas permukaan: Semakin luas permukaan kontak antara reaktan, semakin tinggi laju reaksi. Hal ini karena lebih banyak molekul reaktan yang bertabrakan, sehingga peluang terjadinya reaksi semakin besar.
- Keberadaan katalis: Katalis adalah zat yang mempercepat laju reaksi tanpa dikonsumsi dalam reaksi. Katalis bekerja dengan menurunkan energi aktivasi reaksi.
Kesetimbangan Kimia
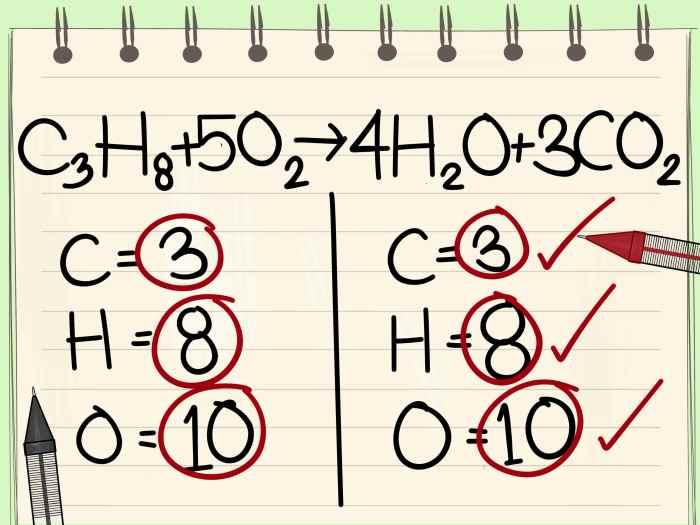
Kesetimbangan kimia adalah keadaan di mana laju reaksi maju sama dengan laju reaksi balik, sehingga konsentrasi reaktan dan produk tetap konstan. Dalam keadaan ini, reaksi berlangsung terus menerus, tetapi perubahan konsentrasi tidak terdeteksi secara makroskopis. Konsep kesetimbangan kimia sangat penting dalam kimia karena memungkinkan kita untuk memprediksi arah dan tingkat reaksi kimia, serta mengontrol reaksi untuk mendapatkan hasil yang diinginkan.Konsep Kesetimbangan Kimia dan Kaitannya dengan Konstanta Kesetimbangan
Kesetimbangan kimia dapat digambarkan dengan konstanta kesetimbangan (Kc), yang merupakan ukuran relatif konsentrasi reaktan dan produk pada kesetimbangan. Konstanta kesetimbangan didefinisikan sebagai rasio produk dari konsentrasi produk dibagi dengan produk dari konsentrasi reaktan, masing-masing dipangkatkan dengan koefisien stoikiometrinya dalam persamaan reaksi setimbang.
Misalnya, untuk reaksi kesetimbangan berikut:
aA + bB ⇌ cC + dD
Konstanta kesetimbangan (Kc) dapat dinyatakan sebagai:
Kc = [C]c[D]d / [A]a[B]b
Dimana:
* [A], [B], [C], dan [D] adalah konsentrasi molar dari reaktan A, B, dan produk C, D pada kesetimbangan.
* a, b, c, dan d adalah koefisien stoikiometri dari reaktan dan produk dalam persamaan reaksi setimbang.Nilai Kc menunjukkan arah reaksi kesetimbangan. Jika Kc > 1, kesetimbangan lebih bergeser ke arah produk, sedangkan jika Kc < 1, kesetimbangan lebih bergeser ke arah reaktan. Jika Kc = 1, maka reaksi berada dalam keadaan kesetimbangan yang sama.
Contoh Soal Perhitungan Kesetimbangan Kimia
Soal:
Perhatikan reaksi kesetimbangan berikut:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Pada suhu tertentu, konsentrasi kesetimbangan N2, H2, dan NH3 masing-masing adalah 0,1 M, 0,2 M, dan 0,3 M. Hitunglah konstanta kesetimbangan (Kc) untuk reaksi ini.
Penyelesaian:
1. Tuliskan persamaan reaksi setimbang.
N2(g) + 3H2(g) ⇌ 2NH3(g)
2. Tuliskan ekspresi konstanta kesetimbangan (Kc).
Kc = [NH3]2 / [N2][H2]3
3. Substitusikan konsentrasi kesetimbangan ke dalam ekspresi Kc.
Kc = (0,3)2 / (0,1)(0,2)3 = 22,5
Jadi, konstanta kesetimbangan (Kc) untuk reaksi ini adalah 22,5.
Tabel Rumus-Rumus Perhitungan Kesetimbangan Kimia
Rumus Contoh Penggunaan Kc = [C]c[D]d / [A]a[B]b Menghitung konstanta kesetimbangan (Kc) dari konsentrasi kesetimbangan reaktan dan produk. Kp = Kc(RT)Δn Menghitung konstanta kesetimbangan tekanan (Kp) dari Kc, suhu (T), dan perubahan jumlah mol gas (Δn). Q = [C]c[D]d / [A]a[B]b Menghitung hasil reaksi (Q) untuk menentukan arah reaksi yang terjadi. ΔG° = -RTlnK Menghitung perubahan energi bebas Gibbs standar (ΔG°) dari konstanta kesetimbangan (K) dan suhu (T). Penutupan Akhir
Melalui contoh soal dan penjelasan yang diberikan, diharapkan Anda dapat memahami konsep dasar perhitungan kimia dan mengaplikasikannya dalam berbagai situasi. Ingatlah bahwa kunci keberhasilan dalam perhitungan kimia terletak pada pemahaman yang kuat terhadap konsep dasar dan kemampuan dalam mengaplikasikan rumus yang tepat. Selamat belajar!