Pernahkah kamu bertanya-tanya bagaimana atom, partikel terkecil penyusun materi, sebenarnya tersusun? Bagaimana atom-atom yang berbeda dapat membentuk berbagai macam zat yang kita temui sehari-hari? Dunia atom memang penuh misteri, namun dengan mempelajari struktur atom, kita dapat mengungkap rahasia di baliknya. Dalam artikel ini, kita akan menjelajahi contoh soal struktur atom yang akan menguji pemahamanmu tentang konsep-konsep penting dalam kimia, seperti nomor atom, nomor massa, isotop, dan konfigurasi elektron.
Contoh soal struktur atom tidak hanya membantu kamu memahami konsep, tetapi juga melatih kemampuan berpikir kritis dan memecahkan masalah. Dengan memahami struktur atom, kamu akan lebih mudah memahami sifat-sifat kimia suatu unsur dan bagaimana atom-atom berinteraksi membentuk ikatan kimia. Jadi, bersiaplah untuk menyelami dunia atom dan temukan jawaban atas pertanyaan-pertanyaan yang mungkin selama ini kamu penasaran!
Pengertian Struktur Atom
Atom merupakan unit terkecil dari suatu unsur yang masih memiliki sifat kimiawi unsur tersebut. Atom terdiri dari inti atom dan elektron yang mengelilinginya. Inti atom merupakan bagian terkecil dari atom yang mengandung proton dan neutron. Atom sendiri merupakan bagian terkecil dari suatu unsur yang masih memiliki sifat kimiawi unsur tersebut.
Struktur Atom
Struktur atom terdiri dari inti atom dan elektron yang mengelilinginya. Inti atom merupakan bagian terkecil dari atom yang mengandung proton dan neutron. Proton bermuatan positif, neutron tidak bermuatan, dan elektron bermuatan negatif.
Berikut ilustrasi sederhana struktur atom:
Bayangkan sebuah bola kecil yang disebut inti atom, bola ini berisi proton dan neutron. Di sekitar bola ini terdapat elektron yang berputar seperti planet mengelilingi matahari. Jarak antara inti atom dan elektron jauh lebih besar dibandingkan dengan ukuran inti atom itu sendiri.
Peran Utama Komponen Penyusun Atom
- Proton: Proton merupakan partikel subatomik yang bermuatan positif. Jumlah proton dalam inti atom menentukan jenis unsur atom tersebut. Misalnya, atom hidrogen memiliki 1 proton, atom helium memiliki 2 proton, dan atom karbon memiliki 6 proton.
- Neutron: Neutron merupakan partikel subatomik yang tidak bermuatan. Jumlah neutron dalam inti atom dapat bervariasi, meskipun jumlah protonnya sama. Atom-atom yang memiliki jumlah proton sama tetapi jumlah neutron berbeda disebut isotop. Misalnya, karbon-12 dan karbon-14 adalah isotop karbon, keduanya memiliki 6 proton, tetapi karbon-12 memiliki 6 neutron, sedangkan karbon-14 memiliki 8 neutron.
- Elektron: Elektron merupakan partikel subatomik yang bermuatan negatif. Elektron mengelilingi inti atom dalam kulit-kulit elektron. Jumlah elektron dalam atom sama dengan jumlah proton dalam inti atom, sehingga atom bersifat netral secara keseluruhan.
Model Atom
Atom merupakan unit terkecil dari suatu unsur yang masih memiliki sifat kimiawi unsur tersebut. Untuk memahami struktur atom, para ilmuwan telah mengembangkan berbagai model atom, mulai dari model sederhana hingga model yang lebih kompleks. Perjalanan panjang para ilmuwan dalam mengungkap rahasia atom telah menghasilkan berbagai model atom, masing-masing dengan ciri khas dan kelemahannya.
Sejarah Perkembangan Model Atom, Contoh soal struktur atom
Model atom telah berkembang seiring dengan kemajuan teknologi dan penemuan-penemuan baru. Berikut adalah sejarah singkat perkembangan model atom:
- Model Atom Dalton (1803): John Dalton mengajukan model atom yang menggambarkan atom sebagai bola pejal yang sangat kecil dan tidak dapat dibagi lagi. Model ini berdasarkan hukum kekekalan massa dan hukum perbandingan tetap. Kelemahan model ini adalah tidak dapat menjelaskan sifat listrik atom dan tidak dapat menjelaskan spektrum atom.
- Model Atom Thomson (1897): Joseph John Thomson menemukan elektron dan mengajukan model atom yang disebut “model atom roti kismis”. Model ini menggambarkan atom sebagai bola bermuatan positif yang di dalamnya tersebar elektron bermuatan negatif seperti kismis dalam roti. Model ini dapat menjelaskan sifat listrik atom, tetapi tidak dapat menjelaskan percobaan hamburan sinar alfa oleh Rutherford.
- Model Atom Rutherford (1911): Ernest Rutherford melakukan percobaan hamburan sinar alfa dan menemukan bahwa sebagian besar atom adalah ruang kosong, dengan inti atom yang kecil dan bermuatan positif di tengahnya. Model ini menggambarkan atom sebagai sistem tata surya mini, dengan inti atom sebagai matahari dan elektron mengelilinginya seperti planet. Model ini dapat menjelaskan percobaan hamburan sinar alfa, tetapi tidak dapat menjelaskan spektrum atom.
- Model Atom Bohr (1913): Niels Bohr memperbaiki model atom Rutherford dengan memasukkan konsep kuantum. Model ini menyatakan bahwa elektron bergerak dalam orbit tertentu yang disebut kulit elektron, dan elektron dapat berpindah dari satu kulit ke kulit lain dengan menyerap atau memancarkan energi dalam bentuk foton. Model ini dapat menjelaskan spektrum atom hidrogen, tetapi tidak dapat menjelaskan spektrum atom yang lebih kompleks.
- Model Atom Mekanika Kuantum (1920-an): Model ini merupakan model atom yang paling modern dan paling akurat. Model ini didasarkan pada teori kuantum, yang menyatakan bahwa posisi dan momentum elektron tidak dapat ditentukan secara pasti secara bersamaan. Model ini menggambarkan atom sebagai sistem probabilistik, di mana elektron berada dalam awan elektron yang disebut orbital atom. Model ini dapat menjelaskan spektrum atom yang kompleks dan banyak fenomena kimia lainnya.
Perbandingan Model Atom
Berikut adalah tabel perbandingan dari model atom Dalton, Thomson, Rutherford, dan Bohr:
| Model Atom | Ciri Khas | Kelemahan |
|---|---|---|
| Dalton | Atom sebagai bola pejal yang tidak dapat dibagi lagi | Tidak dapat menjelaskan sifat listrik atom dan spektrum atom |
| Thomson | Atom sebagai bola bermuatan positif dengan elektron tersebar di dalamnya | Tidak dapat menjelaskan percobaan hamburan sinar alfa |
| Rutherford | Atom sebagai sistem tata surya mini dengan inti atom di tengahnya | Tidak dapat menjelaskan spektrum atom |
| Bohr | Elektron bergerak dalam orbit tertentu dan dapat berpindah kulit dengan menyerap atau memancarkan energi | Tidak dapat menjelaskan spektrum atom yang kompleks |
Perbedaan Model Atom Bohr dan Model Atom Mekanika Kuantum
Model atom Bohr dan model atom mekanika kuantum memiliki perbedaan mendasar dalam cara mereka menggambarkan gerakan elektron dalam atom.
- Model Atom Bohr: Model ini menggambarkan elektron bergerak dalam orbit tertentu yang disebut kulit elektron, dan elektron dapat berpindah dari satu kulit ke kulit lain dengan menyerap atau memancarkan energi dalam bentuk foton. Model ini bersifat deterministik, artinya posisi dan momentum elektron dapat ditentukan secara pasti pada suatu waktu tertentu.
- Model Atom Mekanika Kuantum: Model ini menggambarkan elektron sebagai awan probabilitas yang disebut orbital atom. Posisi dan momentum elektron tidak dapat ditentukan secara pasti secara bersamaan, hanya probabilitas keberadaan elektron di suatu titik ruang yang dapat ditentukan. Model ini bersifat probabilistik, artinya posisi dan momentum elektron tidak dapat ditentukan secara pasti, hanya probabilitas keberadaan elektron di suatu titik ruang yang dapat ditentukan.
Konfigurasi Elektron
Konfigurasi elektron merupakan gambaran susunan elektron dalam suatu atom. Susunan elektron ini menentukan sifat kimia suatu unsur. Konfigurasi elektron dapat digunakan untuk menjelaskan mengapa unsur-unsur tertentu memiliki sifat kimia yang serupa, dan mengapa unsur-unsur lain memiliki sifat yang sangat berbeda.
Konsep Konfigurasi Elektron
Konfigurasi elektron menggambarkan bagaimana elektron-elektron dalam suatu atom menempati orbital-orbital yang berbeda. Orbital adalah ruang di sekitar inti atom di mana elektron kemungkinan besar ditemukan. Setiap orbital dapat menampung maksimal dua elektron, dan elektron-elektron dalam orbital yang sama memiliki energi yang sama.
Orbital-orbital atom disusun dalam tingkat energi yang berbeda. Tingkat energi terendah (n=1) berada paling dekat dengan inti atom, sedangkan tingkat energi tertinggi (n=7) berada paling jauh dari inti. Setiap tingkat energi terdiri dari satu atau lebih sub-tingkat energi, yang ditandai dengan huruf s, p, d, dan f.
Contoh Konfigurasi Elektron
- Hidrogen (H): 1s1. Atom hidrogen hanya memiliki satu elektron, yang menempati orbital 1s.
- Karbon (C): 1s2 2s2 2p2. Atom karbon memiliki enam elektron, yang menempati orbital 1s, 2s, dan 2p.
- Oksigen (O): 1s2 2s2 2p4. Atom oksigen memiliki delapan elektron, yang menempati orbital 1s, 2s, dan 2p.
- Nitrogen (N): 1s2 2s2 2p3. Atom nitrogen memiliki tujuh elektron, yang menempati orbital 1s, 2s, dan 2p.
Hubungan Konfigurasi Elektron dengan Sifat Kimia
Konfigurasi elektron sangat berpengaruh terhadap sifat kimia suatu unsur. Misalnya, jumlah elektron valensi (elektron pada kulit terluar) menentukan kemampuan suatu unsur untuk membentuk ikatan kimia. Unsur-unsur dengan jumlah elektron valensi yang sama cenderung memiliki sifat kimia yang serupa.
Contohnya, unsur-unsur golongan 1 (alkali) memiliki satu elektron valensi, dan semuanya bersifat reaktif dan mudah bereaksi dengan air. Unsur-unsur golongan 17 (halogen) memiliki tujuh elektron valensi, dan semuanya bersifat reaktif dan mudah bereaksi dengan logam. Konfigurasi elektron juga menentukan sifat-sifat lain, seperti titik leleh, titik didih, dan daya hantar listrik.
Nomor Atom dan Nomor Massa
Nomor atom dan nomor massa adalah dua konsep penting dalam memahami struktur atom. Kedua konsep ini membantu kita untuk mengidentifikasi dan membedakan berbagai jenis atom, serta memberikan informasi tentang jumlah partikel subatomik yang menyusunnya.
Perbedaan Nomor Atom dan Nomor Massa
Nomor atom dan nomor massa memiliki perbedaan yang signifikan. Nomor atom mengacu pada jumlah proton dalam inti atom, sedangkan nomor massa mengacu pada jumlah total proton dan neutron dalam inti atom.
- Nomor Atom: Jumlah proton dalam inti atom. Nomor atom menentukan identitas suatu unsur kimia. Contohnya, semua atom hidrogen memiliki nomor atom 1, karena mengandung satu proton. Semua atom karbon memiliki nomor atom 6, karena mengandung enam proton.
- Nomor Massa: Jumlah total proton dan neutron dalam inti atom. Nomor massa menunjukkan total massa inti atom. Contohnya, atom karbon-12 memiliki nomor massa 12, karena mengandung 6 proton dan 6 neutron.
Contoh Perhitungan Nomor Atom dan Nomor Massa
Berikut adalah beberapa contoh perhitungan nomor atom dan nomor massa untuk beberapa unsur kimia:
| Unsur | Simbol | Jumlah Proton | Jumlah Neutron | Nomor Atom | Nomor Massa |
|---|---|---|---|---|---|
| Hidrogen | H | 1 | 0 | 1 | 1 |
| Helium | He | 2 | 2 | 2 | 4 |
| Karbon | C | 6 | 6 | 6 | 12 |
| Oksigen | O | 8 | 8 | 8 | 16 |
Hubungan Nomor Atom dan Nomor Massa dengan Jumlah Proton, Neutron, dan Elektron
Nomor atom, nomor massa, dan jumlah proton, neutron, dan elektron dalam atom saling terkait. Berikut adalah hubungannya:
- Nomor Atom = Jumlah Proton: Nomor atom menentukan jumlah proton dalam inti atom. Jumlah proton ini juga sama dengan jumlah elektron dalam atom yang netral.
- Nomor Massa = Jumlah Proton + Jumlah Neutron: Nomor massa memberikan informasi tentang jumlah total proton dan neutron dalam inti atom.
- Jumlah Neutron = Nomor Massa – Nomor Atom: Dengan mengetahui nomor massa dan nomor atom, kita dapat menghitung jumlah neutron dalam atom.
Isotop
Isotop adalah atom-atom dari unsur yang sama yang memiliki jumlah proton yang sama tetapi jumlah neutron yang berbeda. Ini berarti bahwa isotop memiliki nomor atom yang sama, tetapi nomor massanya berbeda. Sebagai contoh, karbon memiliki nomor atom 6, yang berarti bahwa setiap atom karbon memiliki 6 proton. Namun, karbon memiliki beberapa isotop, seperti karbon-12 (12C) dan karbon-14 (14C). Karbon-12 memiliki 6 neutron, sedangkan karbon-14 memiliki 8 neutron. Oleh karena itu, nomor massa karbon-12 adalah 12 (6 proton + 6 neutron), sedangkan nomor massa karbon-14 adalah 14 (6 proton + 8 neutron).
Contoh Isotop
Berikut adalah beberapa contoh isotop untuk beberapa unsur kimia:
- Karbon: Karbon-12 (12C) dan karbon-14 (14C). Karbon-12 adalah isotop karbon yang paling umum, sedangkan karbon-14 adalah isotop radioaktif yang digunakan untuk penanggalan radiokarbon.
- Hidrogen: Hidrogen-1 (1H) atau protium, hidrogen-2 (2H) atau deuterium, dan hidrogen-3 (3H) atau tritium. Protium adalah isotop hidrogen yang paling umum, sedangkan deuterium dan tritium adalah isotop radioaktif.
- Uranium: Uranium-235 (235U) dan uranium-238 (238U). Uranium-235 adalah isotop radioaktif yang dapat dibelah untuk menghasilkan energi nuklir, sedangkan uranium-238 adalah isotop yang paling umum.
Perbedaan Sifat Fisika dan Kimia Isotop
Meskipun isotop dari suatu unsur memiliki jumlah proton yang sama, jumlah neutron yang berbeda dapat menyebabkan perbedaan dalam sifat fisika dan kimia mereka. Perbedaan ini terutama disebabkan oleh perbedaan massa antara isotop.
- Sifat Fisika: Isotop memiliki massa yang berbeda, yang dapat mempengaruhi sifat fisika seperti titik leleh, titik didih, dan densitas. Sebagai contoh, deuterium (2H) memiliki massa yang lebih besar daripada protium (1H), sehingga memiliki titik leleh dan titik didih yang lebih tinggi.
- Sifat Kimia: Meskipun isotop memiliki jumlah proton yang sama, jumlah neutron yang berbeda dapat mempengaruhi interaksi mereka dengan atom lain. Sebagai contoh, isotop radioaktif seperti karbon-14 (14C) dapat mengalami peluruhan radioaktif, yang dapat mengubah sifat kimianya. Namun, dalam banyak kasus, perbedaan sifat kimia antara isotop relatif kecil.
Penentuan Jumlah Proton, Neutron, dan Elektron: Contoh Soal Struktur Atom
Dalam mempelajari struktur atom, memahami jumlah proton, neutron, dan elektron dalam suatu atom sangat penting. Jumlah partikel subatomik ini menentukan sifat kimia dan fisika suatu unsur. Penentuan jumlah proton, neutron, dan elektron dapat dilakukan dengan mudah berdasarkan nomor atom dan nomor massa.
Cara Menentukan Jumlah Proton, Neutron, dan Elektron
Untuk menentukan jumlah proton, neutron, dan elektron dalam atom, kita perlu memahami konsep nomor atom dan nomor massa.
- Nomor atom (Z): Nomor atom menunjukkan jumlah proton dalam inti atom. Nomor atom merupakan identitas unik suatu unsur dan terletak di atas simbol unsur dalam tabel periodik.
- Nomor massa (A): Nomor massa menunjukkan jumlah proton dan neutron dalam inti atom. Nomor massa umumnya ditulis di sebelah kiri atas simbol unsur.
Berdasarkan definisi nomor atom dan nomor massa, kita dapat menentukan jumlah proton, neutron, dan elektron dengan rumus berikut:
Jumlah proton = Nomor atom (Z)
Jumlah neutron = Nomor massa (A) – Nomor atom (Z)
Jumlah elektron = Jumlah proton (dalam atom netral)
Contoh Soal dan Penyelesaian
Berikut adalah contoh soal dan penyelesaiannya untuk menentukan jumlah proton, neutron, dan elektron dalam atom:
- Tentukan jumlah proton, neutron, dan elektron dalam atom karbon (C) yang memiliki nomor atom 6 dan nomor massa 12.
Penyelesaian:
- Jumlah proton = Nomor atom (Z) = 6
- Jumlah neutron = Nomor massa (A) – Nomor atom (Z) = 12 – 6 = 6
- Jumlah elektron = Jumlah proton = 6
Jadi, atom karbon memiliki 6 proton, 6 neutron, dan 6 elektron.
Ikatan Kimia
Ikatan kimia merupakan gaya tarik-menarik yang kuat yang mengikat atom-atom bersama untuk membentuk molekul atau senyawa. Ikatan kimia ini terbentuk akibat interaksi antara elektron-elektron di kulit terluar atom, yang dikenal sebagai elektron valensi. Interaksi ini dapat melibatkan pemindahan atau pemakaian bersama elektron valensi, menghasilkan ikatan yang berbeda. Jenis ikatan kimia yang terbentuk akan memengaruhi sifat fisik dan kimia suatu zat.
Jenis-Jenis Ikatan Kimia
Secara umum, ikatan kimia dapat dibedakan menjadi tiga jenis utama, yaitu:
- Ikatan Ion: Ikatan ion terbentuk ketika atom-atom saling melepaskan dan menerima elektron untuk mencapai konfigurasi elektron stabil seperti gas mulia. Atom yang melepaskan elektron akan menjadi ion positif (kation), sedangkan atom yang menerima elektron akan menjadi ion negatif (anion). Gaya tarik-menarik elektrostatik antara ion positif dan ion negatif inilah yang membentuk ikatan ion. Contohnya, natrium klorida (NaCl) terbentuk dari ion natrium (Na+) dan ion klorida (Cl-).
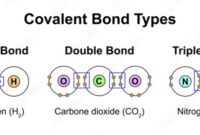
- Ikatan Kovalen: Ikatan kovalen terbentuk ketika dua atom berbagi satu atau lebih pasang elektron. Atom-atom yang berikatan kovalen biasanya memiliki keelektronegatifan yang mirip, sehingga tidak ada atom yang cukup kuat untuk menarik elektron dari atom lainnya. Contohnya, molekul air (H2O) terbentuk dari dua atom hidrogen (H) yang berbagi elektron dengan satu atom oksigen (O).
- Ikatan Logam: Ikatan logam terbentuk antara atom-atom logam. Elektron valensi dalam atom logam terdelokalisasi, artinya mereka bebas bergerak di antara atom-atom logam. Kebebasan elektron ini membuat logam memiliki sifat konduktivitas listrik dan panas yang tinggi, serta sifat mudah ditempa dan ductile. Contohnya, logam tembaga (Cu) memiliki ikatan logam yang kuat, sehingga memiliki sifat konduktivitas listrik yang baik.
Contoh Pembentukan Ikatan Kimia
Berikut adalah beberapa contoh pembentukan ikatan kimia untuk beberapa senyawa sederhana:
- NaCl (Natrium Klorida): Natrium (Na) memiliki satu elektron valensi, sedangkan klorin (Cl) memiliki tujuh elektron valensi. Natrium melepaskan satu elektronnya untuk membentuk ion Na+, sedangkan klorin menerima elektron tersebut untuk membentuk ion Cl-. Kedua ion ini kemudian saling tarik-menarik secara elektrostatik membentuk ikatan ion.
- H2O (Air): Oksigen (O) memiliki enam elektron valensi, sedangkan hidrogen (H) memiliki satu elektron valensi. Oksigen membutuhkan dua elektron lagi untuk mencapai konfigurasi elektron stabil, sehingga berbagi satu elektron dengan masing-masing atom hidrogen. Pembagian elektron ini membentuk dua ikatan kovalen antara oksigen dan hidrogen, membentuk molekul air.
- CO2 (Karbon Dioksida): Karbon (C) memiliki empat elektron valensi, sedangkan oksigen (O) memiliki enam elektron valensi. Karbon berbagi dua elektron dengan masing-masing atom oksigen, membentuk dua ikatan kovalen rangkap. Ikatan kovalen rangkap ini menghasilkan molekul CO2 yang linear.
Pengaruh Struktur Atom terhadap Jenis Ikatan Kimia
Struktur atom, khususnya jumlah elektron valensi, sangat memengaruhi jenis ikatan kimia yang terbentuk. Atom dengan jumlah elektron valensi yang sedikit cenderung melepaskan elektron untuk membentuk ion positif, sehingga membentuk ikatan ion. Atom dengan jumlah elektron valensi yang banyak cenderung menerima elektron untuk membentuk ion negatif, juga membentuk ikatan ion. Atom-atom dengan jumlah elektron valensi yang sama atau mirip cenderung berbagi elektron untuk membentuk ikatan kovalen. Atom-atom logam memiliki elektron valensi yang terdelokalisasi, sehingga membentuk ikatan logam.
Contoh Soal Struktur Atom
Struktur atom adalah konsep dasar dalam kimia yang menjelaskan bagaimana atom tersusun. Atom terdiri dari inti atom yang mengandung proton dan neutron, serta elektron yang mengelilingi inti. Memahami struktur atom sangat penting untuk memahami sifat kimia suatu zat dan bagaimana atom berinteraksi satu sama lain. Dalam artikel ini, kita akan membahas beberapa contoh soal yang menguji pemahaman konsep struktur atom, konfigurasi elektron, nomor atom, nomor massa, dan isotop.
Struktur Atom
Struktur atom menggambarkan susunan partikel subatomik yang menyusun atom. Berikut beberapa contoh soal yang menguji pemahaman konsep struktur atom.
- Atom karbon memiliki nomor atom 6. Berapa jumlah proton, neutron, dan elektron dalam atom karbon?
- Atom magnesium memiliki 12 proton dan 12 neutron. Berapa nomor atom dan nomor massa atom magnesium?
- Atom nitrogen memiliki nomor atom 7 dan nomor massa 14. Berapa jumlah proton, neutron, dan elektron dalam atom nitrogen?
Konfigurasi Elektron
Konfigurasi elektron menggambarkan bagaimana elektron tersusun dalam atom. Pengetahuan tentang konfigurasi elektron membantu memahami sifat kimia suatu atom dan bagaimana atom berinteraksi dengan atom lainnya.
- Tulis konfigurasi elektron untuk atom natrium (Na), yang memiliki nomor atom 11.
- Tulis konfigurasi elektron untuk atom klorin (Cl), yang memiliki nomor atom 17.
- Jelaskan bagaimana konfigurasi elektron atom oksigen (O), yang memiliki nomor atom 8, menentukan kemampuannya untuk membentuk ikatan kimia.
Nomor Atom dan Nomor Massa
Nomor atom dan nomor massa adalah dua besaran penting yang menggambarkan karakteristik atom. Nomor atom menunjukkan jumlah proton dalam inti atom, sedangkan nomor massa menunjukkan jumlah total proton dan neutron dalam inti atom.
Contoh soal struktur atom bisa berupa menentukan jumlah proton, neutron, dan elektron pada suatu atom. Soal seperti ini biasanya melibatkan pemahaman tentang nomor atom dan nomor massa. Nah, ketika mempelajari struktur atom, kita juga perlu memahami konsep faktor persekutuan terbesar (FPB) dan kelipatan persekutuan terkecil (KPK) yang diajarkan di kelas 5.
Contoh soal FPB dan KPK bisa membantu kita memahami konsep perhitungan yang dibutuhkan untuk menentukan jumlah partikel subatomik pada atom. Contoh soal FPB dan KPK kelas 5 bisa ditemukan di berbagai sumber online, seperti website dan blog edukasi. Dengan mempelajari contoh soal struktur atom dan FPB dan KPK, kita bisa memahami konsep dasar kimia dan matematika dengan lebih baik.
- Atom kalium memiliki nomor atom 19 dan nomor massa 39. Berapa jumlah proton, neutron, dan elektron dalam atom kalium?
- Atom sulfur memiliki 16 proton dan 16 neutron. Berapa nomor atom dan nomor massa atom sulfur?
- Atom besi memiliki nomor atom 26 dan nomor massa 56. Berapa jumlah proton, neutron, dan elektron dalam atom besi?
Isotop
Isotop adalah atom dari unsur yang sama dengan jumlah proton yang sama, tetapi jumlah neutron yang berbeda. Isotop memiliki sifat kimia yang serupa, tetapi sifat fisika yang berbeda.
- Jelaskan perbedaan antara isotop karbon-12 dan karbon-14.
- Sebutkan tiga isotop hidrogen dan jelaskan perbedaannya.
- Bagaimana isotop digunakan dalam bidang kedokteran?
Penerapan Struktur Atom
Struktur atom, dengan komponen-komponen penyusunnya seperti proton, neutron, dan elektron, bukan hanya konsep abstrak dalam buku pelajaran. Pemahaman tentang struktur atom punya peran penting dalam berbagai bidang, mewarnai kehidupan kita sehari-hari dengan cara yang mungkin tak kita sadari.
Kimia
Struktur atom adalah fondasi kimia. Pengetahuan tentang susunan elektron dalam atom, khususnya elektron valensi, memungkinkan kita memahami bagaimana atom berikatan membentuk molekul. Berdasarkan struktur atom, kita bisa memprediksi sifat-sifat suatu zat, seperti titik leleh, titik didih, dan reaktivitas. Misalnya, kita dapat mengetahui bahwa natrium (Na) sangat reaktif karena hanya memiliki satu elektron valensi, sehingga mudah melepaskan elektron tersebut untuk membentuk ikatan ionik.
Fisika
Struktur atom juga memainkan peran penting dalam fisika, khususnya dalam bidang fisika nuklir. Pengetahuan tentang inti atom, yang terdiri dari proton dan neutron, membantu kita memahami reaksi nuklir seperti fisi dan fusi. Fisi nuklir, misalnya, merupakan proses pembelahan inti atom menjadi atom yang lebih kecil, melepaskan energi yang luar biasa besar. Energi ini dimanfaatkan dalam pembangkit listrik tenaga nuklir.
Teknologi
Struktur atom memiliki aplikasi yang luas dalam teknologi. Misalnya, dalam pengembangan semikonduktor, pemahaman tentang struktur atom silikon dan germanium memungkinkan kita mengendalikan sifat elektronik material tersebut. Semikonduktor ini menjadi komponen penting dalam perangkat elektronik seperti komputer, smartphone, dan televisi.
Kehidupan Sehari-hari
Aplikasi struktur atom juga terasa dalam kehidupan sehari-hari. Misalnya, dalam bidang kedokteran, teknik pencitraan seperti Magnetic Resonance Imaging (MRI) memanfaatkan sifat magnetik inti atom hidrogen untuk menghasilkan gambar organ tubuh.
- Penggunaan lampu neon memanfaatkan emisi cahaya dari atom-atom gas mulia, seperti neon, argon, dan kripton, yang tereksitasi oleh arus listrik.
- Dalam bidang pertanian, penggunaan pupuk kimia didasarkan pada pemahaman tentang struktur atom unsur hara seperti nitrogen, fosfor, dan kalium yang dibutuhkan tanaman untuk tumbuh.
Simulasi Struktur Atom
Struktur atom merupakan dasar dalam memahami sifat dan perilaku suatu unsur kimia. Dengan berkembangnya teknologi, simulasi komputer memungkinkan kita untuk visualisasikan dan mempelajari struktur atom secara lebih mendalam. Artikel ini akan membahas cara melakukan simulasi struktur atom menggunakan software dan aplikasi tertentu, memberikan contoh simulasi untuk beberapa unsur kimia, serta membahas manfaat dan keterbatasannya.
Cara Melakukan Simulasi Struktur Atom
Simulasi struktur atom dapat dilakukan menggunakan berbagai software dan aplikasi yang dirancang khusus untuk keperluan kimia komputasi. Beberapa software populer yang digunakan untuk simulasi struktur atom antara lain:
- Gaussian: Software ini memungkinkan simulasi struktur atom, sifat elektronik, dan reaksi kimia menggunakan metode kimia kuantum.
- Spartan: Software ini menyediakan antarmuka yang ramah pengguna untuk simulasi struktur atom, sifat molekul, dan reaksi kimia.
- Chem3D: Software ini dirancang untuk visualisasi dan manipulasi struktur molekul, termasuk simulasi struktur atom dan interaksi antar molekul.
Langkah-langkah umum dalam melakukan simulasi struktur atom menggunakan software ini meliputi:
- Membangun Model Atom: Anda perlu membangun model atom yang ingin Anda simulasikan. Model ini biasanya berupa struktur 3D yang menggambarkan posisi inti atom dan elektronnya.
- Menentukan Parameter Simulasi: Anda perlu menentukan parameter simulasi, seperti metode kimia kuantum yang digunakan, tingkat teori, dan basis set. Parameter ini akan menentukan akurasi dan kompleksitas simulasi.
- Melakukan Simulasi: Setelah model atom dan parameter simulasi ditentukan, Anda dapat menjalankan simulasi menggunakan software yang dipilih.
- Menganalisis Hasil Simulasi: Setelah simulasi selesai, Anda dapat menganalisis hasil simulasi untuk mendapatkan informasi tentang struktur atom, sifat elektronik, dan perilaku atom tersebut.
Contoh Simulasi Struktur Atom
Berikut beberapa contoh simulasi struktur atom untuk beberapa unsur kimia:
- Hidrogen (H): Simulasi struktur atom hidrogen akan menunjukkan inti atom tunggal yang mengandung satu proton dan satu elektron yang mengorbit di sekitarnya. Simulasi ini dapat menggambarkan bentuk orbital elektron, energi elektron, dan momen dipol atom.
- Oksigen (O): Simulasi struktur atom oksigen akan menunjukkan inti atom yang mengandung 8 proton dan 8 neutron, serta 8 elektron yang mengorbit di sekitarnya. Simulasi ini dapat menggambarkan bentuk orbital elektron, energi elektron, dan bagaimana elektron-elektron tersebut berinteraksi satu sama lain.
- Natrium (Na): Simulasi struktur atom natrium akan menunjukkan inti atom yang mengandung 11 proton dan 12 neutron, serta 11 elektron yang mengorbit di sekitarnya. Simulasi ini dapat menggambarkan bagaimana elektron-elektron tersebut tersusun dalam berbagai tingkat energi dan bagaimana mereka berinteraksi dengan inti atom.
Manfaat Simulasi Struktur Atom
Simulasi struktur atom memiliki banyak manfaat, antara lain:
- Memvisualisasikan Struktur Atom: Simulasi memungkinkan kita untuk memvisualisasikan struktur atom yang tidak dapat dilihat dengan mata telanjang. Hal ini membantu kita untuk memahami konsep-konsep atomik secara lebih intuitif.
- Mempelajari Sifat Atom: Simulasi dapat digunakan untuk mempelajari sifat-sifat atom, seperti energi elektron, momen dipol, dan bentuk orbital elektron. Informasi ini sangat penting dalam memahami sifat kimia dan fisika suatu unsur.
- Memprediksi Reaksi Kimia: Simulasi dapat digunakan untuk memprediksi bagaimana atom-atom akan berinteraksi satu sama lain dalam reaksi kimia. Hal ini membantu kita untuk memahami mekanisme reaksi dan merancang reaksi kimia baru.
- Mengembangkan Material Baru: Simulasi dapat digunakan untuk merancang dan mengembangkan material baru dengan sifat yang diinginkan. Misalnya, simulasi dapat digunakan untuk merancang material yang kuat, ringan, dan tahan panas.
Keterbatasan Simulasi Struktur Atom
Meskipun bermanfaat, simulasi struktur atom memiliki beberapa keterbatasan:
- Kompleksitas Perhitungan: Simulasi struktur atom sering kali melibatkan perhitungan yang kompleks dan membutuhkan waktu komputasi yang lama. Hal ini membatasi kemampuan kita untuk mensimulasikan sistem atom yang besar dan kompleks.
- Akurasi Simulasi: Akurasi simulasi bergantung pada metode kimia kuantum yang digunakan, tingkat teori, dan basis set yang dipilih. Akurasi simulasi dapat dipengaruhi oleh faktor-faktor tersebut.
- Model Sederhana: Simulasi sering kali menggunakan model sederhana untuk menggambarkan struktur atom. Model ini mungkin tidak sepenuhnya akurat dalam menggambarkan interaksi yang kompleks antara inti atom dan elektron.
Ringkasan Terakhir

Memahami struktur atom merupakan kunci untuk membuka pintu menuju pemahaman kimia yang lebih dalam. Melalui contoh soal yang menantang, kamu dapat menguji dan memperdalam pengetahuanmu tentang atom. Dengan mempelajari struktur atom, kamu tidak hanya memahami materi di sekitar kita, tetapi juga membuka peluang untuk mengaplikasikan ilmu ini dalam berbagai bidang, seperti pengembangan teknologi dan industri kimia.