Asam kuat, dengan kemampuannya melepaskan ion hidrogen (H+) dalam jumlah besar, memegang peran penting dalam berbagai reaksi kimia dan aplikasi praktis. Namun, memahami konsep asam kuat dan mengaplikasikannya dalam soal-soal kimia bisa menjadi tantangan tersendiri. Nah, untuk itu, mari kita bahas beberapa contoh soal asam kuat beserta jawabannya yang akan membantu Anda memahami sifat dan reaksi asam kuat dengan lebih baik.
Contoh soal yang akan kita bahas mencakup berbagai aspek tentang asam kuat, mulai dari penentuan pH, reaksi netralisasi, hingga perhitungan konsentrasi. Dengan mempelajari contoh soal ini, Anda akan lebih percaya diri dalam menghadapi soal-soal sejenis dan memahami bagaimana asam kuat berperan dalam kehidupan sehari-hari.
Ciri-ciri Asam Kuat
Asam kuat adalah senyawa yang terionisasi sempurna dalam larutan air, menghasilkan ion hidrogen (H+) dalam jumlah besar. Ciri-ciri asam kuat yang membedakannya dari asam lemah adalah kemampuannya untuk melepaskan semua ion hidrogennya dalam larutan, sehingga menghasilkan larutan yang sangat asam.
Ciri-ciri Umum Asam Kuat
Asam kuat memiliki ciri-ciri umum yang dapat membantu kita dalam mengidentifikasi dan membedakannya dari asam lemah. Berikut adalah beberapa ciri-ciri umum asam kuat:
- Terionisasi sempurna dalam larutan air.
- Memiliki nilai konstanta disosiasi asam (Ka) yang sangat besar.
- Memiliki pH rendah (biasanya kurang dari 1).
- Bereaksi hebat dengan basa, menghasilkan garam dan air.
Contoh Senyawa Asam Kuat
Beberapa contoh senyawa asam kuat yang umum dijumpai dalam kehidupan sehari-hari antara lain:
- Asam klorida (HCl): Asam klorida merupakan asam kuat yang banyak digunakan dalam berbagai industri, seperti pembuatan plastik, pupuk, dan obat-obatan. Asam klorida memiliki bau yang menyengat dan bersifat korosif. Ketika HCl dilarutkan dalam air, ia akan terionisasi sempurna menjadi ion hidrogen (H+) dan ion klorida (Cl-).
- Asam sulfat (H2SO4): Asam sulfat merupakan asam kuat yang sangat penting dalam industri kimia. Asam sulfat memiliki sifat korosif yang kuat dan dapat menyebabkan luka bakar yang serius jika terkena kulit. Ketika H2SO4 dilarutkan dalam air, ia akan terionisasi sempurna menjadi 2 ion hidrogen (H+) dan 1 ion sulfat (SO42-).
- Asam nitrat (HNO3): Asam nitrat merupakan asam kuat yang digunakan dalam pembuatan pupuk, bahan peledak, dan zat warna. Asam nitrat memiliki sifat korosif dan mudah meledak jika tidak ditangani dengan benar. Ketika HNO3 dilarutkan dalam air, ia akan terionisasi sempurna menjadi ion hidrogen (H+) dan ion nitrat (NO3-).
Persamaan Reaksi Ionisasi Asam Kuat
Proses ionisasi asam kuat dapat digambarkan dengan persamaan reaksi kimia. Misalnya, reaksi ionisasi asam klorida (HCl) dalam air adalah sebagai berikut:
HCl(aq) → H+(aq) + Cl-(aq)
Persamaan ini menunjukkan bahwa ketika HCl dilarutkan dalam air, ia akan terionisasi sempurna menjadi ion hidrogen (H+) dan ion klorida (Cl-).
Proses Ionisasi Asam Kuat
Proses ionisasi asam kuat terjadi karena ikatan kovalen antara atom hidrogen dan atom non-logam dalam molekul asam kuat sangat lemah. Ketika asam kuat dilarutkan dalam air, molekul air akan menarik atom hidrogen dari molekul asam kuat, sehingga menghasilkan ion hidrogen (H+) dan ion negatif dari asam kuat.
- Molekul air memiliki sifat polar, dengan atom oksigen memiliki muatan negatif parsial dan atom hidrogen memiliki muatan positif parsial.
- Atom hidrogen dalam molekul asam kuat memiliki muatan positif parsial.
- Atom oksigen dalam molekul air akan tertarik ke atom hidrogen dalam molekul asam kuat, sehingga menarik atom hidrogen tersebut dan membentuk ion hidrogen (H+).
- Sisa molekul asam kuat akan menjadi ion negatif.
Contoh Soal Asam Kuat
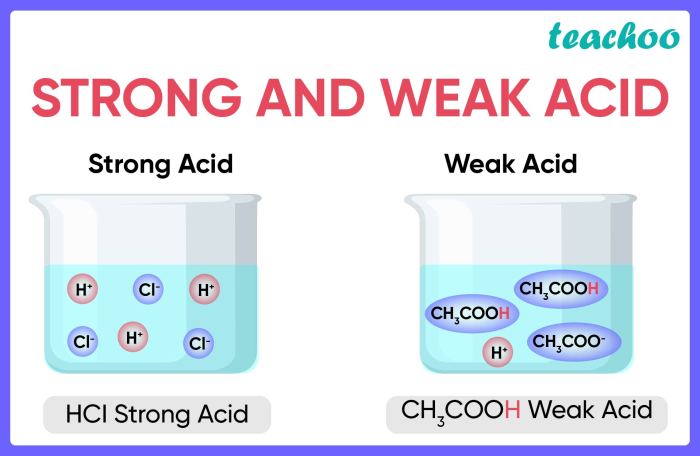
Asam kuat adalah asam yang terionisasi sempurna dalam larutan. Artinya, semua molekul asam kuat akan terurai menjadi ion hidrogen (H+) dan anionnya. Hal ini menyebabkan larutan asam kuat memiliki pH yang rendah, yaitu di bawah 7. Contoh asam kuat antara lain HCl (asam klorida), HNO3 (asam nitrat), dan H2SO4 (asam sulfat).
Untuk memahami konsep asam kuat lebih lanjut, mari kita bahas beberapa contoh soal beserta jawabannya. Soal-soal berikut ini mencakup berbagai aspek tentang asam kuat, seperti penentuan pH, reaksi netralisasi, dan perhitungan konsentrasi.
Nah, ngomongin soal contoh soal, nggak cuma contoh soal asam kuat beserta jawabannya aja lho yang bisa kamu temuin. Ada juga contoh soal perencanaan dan pengendalian produksi, kayak misalnya ngitungin berapa banyak bahan baku yang dibutuhkan buat produksi tertentu, atau gimana cara ngatur alur produksi biar lancar.
Kamu bisa cek contoh soal perencanaan dan pengendalian produksi di sini: contoh soal perencanaan dan pengendalian produksi. Nah, setelah belajar contoh soal perencanaan dan pengendalian produksi, kamu bisa balik lagi ke contoh soal asam kuat beserta jawabannya buat ngetes pemahaman kamu soal asam kuat, hehe.
Contoh Soal Asam Kuat
Berikut adalah beberapa contoh soal asam kuat beserta jawabannya yang dapat membantu Anda memahami konsep asam kuat dengan lebih baik.
| No | Soal | Pembahasan | Jawaban |
|---|---|---|---|
| 1 | Hitunglah pH larutan HCl 0,1 M! | HCl adalah asam kuat, sehingga terionisasi sempurna dalam larutan. Persamaan reaksinya adalah: HCl(aq) → H+(aq) + Cl-(aq). Konsentrasi H+ sama dengan konsentrasi HCl awal, yaitu 0,1 M. pH dapat dihitung dengan rumus pH = -log[H+]. | pH = -log(0,1) = 1 |
| 2 | Berapa mL larutan NaOH 0,2 M yang dibutuhkan untuk menetralkan 25 mL larutan HCl 0,1 M? | Reaksi netralisasi antara HCl dan NaOH adalah: HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l). Jumlah mol HCl = 0,025 L x 0,1 mol/L = 0,0025 mol. Jumlah mol NaOH yang dibutuhkan untuk menetralkan HCl adalah 0,0025 mol. Volume NaOH yang dibutuhkan adalah 0,0025 mol / 0,2 mol/L = 0,0125 L = 12,5 mL. | 12,5 mL |
| 3 | Larutan H2SO4 0,5 M diencerkan dengan air hingga volumenya menjadi 500 mL. Berapakah konsentrasi H2SO4 setelah pengenceran? | Pengenceran tidak mengubah jumlah mol zat terlarut. Jumlah mol H2SO4 sebelum pengenceran = 0,5 mol/L x V1 (volume awal). Jumlah mol H2SO4 setelah pengenceran = C2 (konsentrasi setelah pengenceran) x V2 (volume akhir). Karena jumlah mol tetap sama, maka C1V1 = C2V2. | C2 = (C1V1)/V2 = (0,5 mol/L x V1) / 500 mL = 0,1 mol/L |
Pengaruh Asam Kuat terhadap Indikator
Asam kuat memiliki kemampuan untuk mengubah warna indikator, karena sifatnya yang sangat reaktif. Hal ini terjadi karena asam kuat dapat memberikan banyak ion hidrogen (H+) dalam larutan, yang kemudian bereaksi dengan molekul indikator dan mengubah strukturnya. Perubahan struktur ini menyebabkan perubahan warna yang dapat diamati.
Contoh Indikator dan Perubahan Warnanya
Indikator adalah zat yang dapat mengubah warna dalam larutan asam atau basa. Perubahan warna ini terjadi karena perubahan struktur molekul indikator akibat interaksi dengan ion H+ atau OH- dalam larutan. Berikut adalah beberapa contoh indikator dan perubahan warnanya dalam larutan asam kuat:
- Lakmus: Merah dalam larutan asam kuat dan biru dalam larutan basa kuat.
- Fenolftalein: Tidak berwarna dalam larutan asam kuat dan merah muda dalam larutan basa kuat.
- Metil jingga: Merah dalam larutan asam kuat dan kuning dalam larutan basa kuat.
- Bromtimol biru: Kuning dalam larutan asam kuat dan biru dalam larutan basa kuat.
Tabel Indikator, Warna dalam Asam Kuat, dan Warna dalam Basa Kuat
Berikut tabel yang berisi nama indikator, warna dalam asam kuat, dan warna dalam basa kuat:
| Indikator | Warna dalam Asam Kuat | Warna dalam Basa Kuat |
|---|---|---|
| Lakmus | Merah | Biru |
| Fenolftalein | Tidak berwarna | Merah muda |
| Metil jingga | Merah | Kuning |
| Bromtimol biru | Kuning | Biru |
Contoh Aplikasi Asam Kuat dalam Kehidupan Sehari-hari
Asam kuat memiliki banyak aplikasi dalam kehidupan sehari-hari, mulai dari industri makanan hingga obat-obatan dan pembersih. Kemampuan asam kuat untuk melepaskan ion hidrogen (H+) dalam larutan membuat mereka sangat reaktif dan berguna dalam berbagai proses kimia. Namun, penting untuk diingat bahwa asam kuat juga sangat korosif dan berbahaya jika tidak ditangani dengan benar.
Industri Makanan
Asam kuat digunakan dalam industri makanan untuk berbagai keperluan, seperti:
- Pengaturan pH: Asam kuat seperti asam sitrat (C6H8O7) dan asam tartarat (C4H6O6) sering digunakan untuk mengatur pH makanan dan minuman. Misalnya, asam sitrat ditambahkan ke minuman ringan untuk memberikan rasa asam dan membantu menjaga stabilitasnya.
- Pembuatan Bahan Pengawet: Asam kuat dapat digunakan untuk membuat bahan pengawet makanan seperti asam benzoat (C7H6O2) dan asam sorbat (C6H8O2). Bahan pengawet ini membantu memperpanjang umur simpan makanan dengan menghambat pertumbuhan bakteri dan jamur.
- Pembuatan Perasa: Asam kuat juga digunakan untuk membuat perasa makanan seperti asam asetat (CH3COOH) yang digunakan untuk membuat cuka.
Obat-obatan
Asam kuat memiliki peran penting dalam pembuatan obat-obatan. Beberapa contohnya:
- Pembuatan Obat-obatan: Asam kuat seperti asam klorida (HCl) digunakan dalam pembuatan berbagai obat-obatan, termasuk aspirin (C9H8O4) dan ibuprofen (C13H18O2).
- Pengaturan pH: Asam kuat juga digunakan untuk mengatur pH obat-obatan, memastikan stabilitas dan efektivitasnya.
- Pembuatan Bahan Baku: Asam kuat digunakan sebagai bahan baku dalam pembuatan beberapa bahan kimia yang digunakan dalam industri farmasi.
Pembersih
Asam kuat banyak digunakan dalam produk pembersih karena kemampuannya untuk melarutkan kotoran dan karat:
- Pembersih Rumah Tangga: Asam klorida (HCl) merupakan bahan utama dalam beberapa produk pembersih rumah tangga, seperti pembersih toilet dan lantai.
- Pembersih Industri: Asam sulfat (H2SO4) digunakan dalam industri untuk membersihkan logam dan peralatan.
- Pembersih Karat: Asam kuat digunakan dalam produk pembersih karat karena kemampuannya untuk melarutkan oksida besi.
Manfaat dan Risiko
Penggunaan asam kuat dalam kehidupan sehari-hari memberikan banyak manfaat, namun juga memiliki risiko yang perlu diwaspadai.
- Manfaat:
- Membantu meningkatkan kualitas dan umur simpan makanan.
- Meningkatkan efektivitas obat-obatan.
- Membuat produk pembersih lebih efektif dalam menghilangkan kotoran dan karat.
- Risiko:
- Asam kuat sangat korosif dan dapat menyebabkan luka bakar serius jika terkena kulit atau mata.
- Asam kuat dapat bereaksi dengan bahan lain dan menghasilkan gas berbahaya.
- Penggunaan asam kuat yang tidak tepat dapat menyebabkan kerusakan lingkungan.
Asam Kuat dan Kesehatan: Contoh Soal Asam Kuat Beserta Jawabannya
Asam kuat, meskipun memiliki peran penting dalam berbagai bidang seperti industri dan laboratorium, dapat menjadi ancaman serius bagi kesehatan manusia jika tidak ditangani dengan benar. Sifat korosifnya yang tinggi dapat menyebabkan berbagai masalah kesehatan, mulai dari iritasi ringan hingga kerusakan organ yang serius.
Pengaruh Asam Kuat terhadap Kesehatan Manusia
Asam kuat, dengan sifat korosifnya yang tinggi, dapat bereaksi dengan jaringan tubuh dan menyebabkan kerusakan yang signifikan. Tingkat keparahan kerusakan tergantung pada konsentrasi asam, lama kontak, dan area tubuh yang terkena.
Efek Negatif Asam Kuat terhadap Tubuh
- Iritasi Kulit: Kontak langsung dengan asam kuat dapat menyebabkan iritasi kulit, kemerahan, rasa terbakar, dan bahkan luka bakar kimiawi yang serius. Luka bakar kimiawi dapat meninggalkan bekas luka permanen dan memerlukan perawatan medis yang intensif.
- Kerusakan Organ: Jika tertelan, asam kuat dapat merusak saluran pencernaan, menyebabkan luka bakar di mulut, tenggorokan, lambung, dan usus. Hal ini dapat menyebabkan muntah darah, kesulitan menelan, dan bahkan perforasi organ pencernaan. Paparan asam kuat juga dapat merusak organ dalam lainnya seperti paru-paru, jika terhirup dalam jumlah yang signifikan.
- Gangguan Pencernaan: Asam kuat dapat menyebabkan gangguan pencernaan, seperti mual, muntah, diare, dan nyeri perut. Kondisi ini dapat terjadi jika asam kuat tertelan atau jika terjadi kontak dengan kulit di sekitar mulut.
Langkah-langkah Penanganan Kontak dengan Asam Kuat
- Penanganan Darurat: Jika terjadi kontak dengan asam kuat, segera singkirkan sumber asam dan pindahkan korban ke area yang aman. Lepaskan pakaian yang terkena asam dan bilas area yang terkena dengan air mengalir selama 15-20 menit. Jika tertelan, jangan muntahkan, segera hubungi pusat racun atau layanan darurat medis.
- Pertolongan Pertama: Setelah membilas area yang terkena, tutupi luka bakar dengan kain bersih dan kering. Segera hubungi tenaga medis untuk mendapatkan penanganan yang tepat. Jika terhirup, pindahkan korban ke area yang berventilasi baik dan hubungi layanan darurat medis.
- Perlindungan Diri: Saat menangani asam kuat, selalu gunakan alat pelindung diri (APD) yang sesuai, seperti sarung tangan, kacamata pengaman, masker, dan jas laboratorium. Selalu ikuti prosedur keselamatan yang telah ditetapkan dan hindari kontak langsung dengan asam kuat.
Perbedaan Asam Kuat dan Asam Lemah
Asam merupakan senyawa yang memiliki sifat khas, yaitu kemampuannya untuk melepaskan ion hidrogen (H+) ketika dilarutkan dalam air. Namun, tidak semua asam memiliki kemampuan yang sama dalam melepaskan ion hidrogen. Berdasarkan kemampuan ionisasinya, asam dibedakan menjadi dua jenis, yaitu asam kuat dan asam lemah.
Perbedaan Asam Kuat dan Asam Lemah Berdasarkan Kemampuan Ionisasi
Asam kuat merupakan asam yang terionisasi sempurna dalam air, artinya semua molekul asam akan terurai menjadi ion hidrogen (H+) dan anionnya. Sebaliknya, asam lemah hanya terionisasi sebagian dalam air, artinya hanya sebagian kecil molekul asam yang terurai menjadi ion hidrogen (H+) dan anionnya.
Contoh Asam Kuat dan Asam Lemah Beserta Persamaan Reaksi Ionisasinya
Berikut adalah beberapa contoh asam kuat dan asam lemah beserta persamaan reaksi ionisasinya:
- Asam Kuat
- Asam klorida (HCl): HCl(aq) → H+(aq) + Cl-(aq)
- Asam nitrat (HNO3): HNO3(aq) → H+(aq) + NO3-(aq)
- Asam sulfat (H2SO4): H2SO4(aq) → 2H+(aq) + SO42-(aq)
- Asam Lemah
- Asam asetat (CH3COOH): CH3COOH(aq) ⇌ H+(aq) + CH3COO-(aq)
- Asam karbonat (H2CO3): H2CO3(aq) ⇌ H+(aq) + HCO3-(aq)
- Asam benzoat (C6H5COOH): C6H5COOH(aq) ⇌ H+(aq) + C6H5COO-(aq)
Perbandingan pH Larutan Asam Kuat dan Asam Lemah dengan Konsentrasi yang Sama, Contoh soal asam kuat beserta jawabannya
pH merupakan ukuran keasaman suatu larutan. Semakin rendah nilai pH, semakin asam larutan tersebut. Larutan asam kuat memiliki pH yang lebih rendah dibandingkan dengan larutan asam lemah dengan konsentrasi yang sama. Hal ini disebabkan karena asam kuat terionisasi sempurna, sehingga menghasilkan konsentrasi ion hidrogen (H+) yang lebih tinggi.
Sebagai contoh, larutan HCl 0,1 M akan memiliki pH yang lebih rendah dibandingkan dengan larutan CH3COOH 0,1 M.
Contoh Soal Asam Lemah
Asam lemah adalah asam yang tidak terionisasi sempurna dalam larutan. Artinya, hanya sebagian kecil molekul asam yang terurai menjadi ion hidrogen (H+) dan anionnya. Karena sifatnya yang tidak terionisasi sepenuhnya, asam lemah memiliki kekuatan asam yang lebih rendah dibandingkan dengan asam kuat. Untuk memahami konsep asam lemah, berikut beberapa contoh soal yang dapat membantu Anda.
Contoh Soal Asam Lemah dan Jawabannya
Berikut adalah beberapa contoh soal asam lemah beserta jawabannya yang mencakup berbagai aspek, seperti penentuan pH, reaksi netralisasi, dan perhitungan derajat ionisasi.
| No | Soal | Pembahasan | Jawaban |
|---|---|---|---|
| 1 | Hitunglah pH larutan asam asetat (CH3COOH) 0,1 M jika Ka asam asetat = 1,8 x 10-5. | Asam asetat merupakan asam lemah yang terionisasi sebagian dalam air. Untuk menghitung pH, kita dapat menggunakan rumus Ka dan persamaan kesetimbangan asam asetat. | pH = 2,87 |
| 2 | Berapa volume larutan NaOH 0,1 M yang dibutuhkan untuk menetralkan 25 mL larutan asam benzoat (C6H5COOH) 0,2 M jika Ka asam benzoat = 6,3 x 10-5? | Reaksi netralisasi antara asam benzoat dan NaOH menghasilkan garam natrium benzoat dan air. Untuk menghitung volume NaOH yang dibutuhkan, kita dapat menggunakan persamaan stoikiometri reaksi. | Volume NaOH = 50 mL |
| 3 | Tentukan derajat ionisasi asam lemah HX 0,1 M jika pH larutannya adalah 3. | Derajat ionisasi (α) adalah perbandingan antara konsentrasi asam yang terionisasi dengan konsentrasi asam mula-mula. Kita dapat menghitung α dengan menggunakan persamaan Ka dan pH larutan. | α = 0,01 |
Penetralan Asam Kuat
Penetralan asam kuat merupakan reaksi kimia yang terjadi ketika asam kuat bereaksi dengan basa, menghasilkan garam dan air. Reaksi ini merupakan reaksi eksotermis, yang berarti melepaskan panas ke lingkungan. Penetralan asam kuat dapat digunakan untuk menetralkan asam kuat yang berbahaya, seperti asam sulfat (H2SO4) atau asam klorida (HCl), menjadi garam yang lebih aman.
Proses Penetralan Asam Kuat dengan Basa
Penetralan asam kuat dengan basa terjadi ketika ion hidrogen (H+) dari asam kuat bereaksi dengan ion hidroksida (OH-) dari basa, membentuk air (H2O). Ion positif dari basa dan ion negatif dari asam kemudian bereaksi membentuk garam.
Contoh Reaksi Penetralan Asam Kuat dengan Basa
Contoh reaksi penetralan asam kuat dengan basa adalah reaksi antara asam klorida (HCl) dengan natrium hidroksida (NaOH). Persamaan reaksinya adalah sebagai berikut:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Dalam reaksi ini, ion hidrogen (H+) dari asam klorida (HCl) bereaksi dengan ion hidroksida (OH-) dari natrium hidroksida (NaOH), membentuk air (H2O). Ion natrium (Na+) dari natrium hidroksida (NaOH) dan ion klorida (Cl-) dari asam klorida (HCl) kemudian bereaksi membentuk garam natrium klorida (NaCl).
Produk yang Dihasilkan dari Reaksi Penetralan Asam Kuat dengan Basa
Produk yang dihasilkan dari reaksi penetralan asam kuat dengan basa adalah garam dan air. Garam yang dihasilkan merupakan senyawa ionik yang terdiri dari kation dari basa dan anion dari asam. Air yang dihasilkan merupakan senyawa kovalen yang terbentuk dari ion hidrogen (H+) dan ion hidroksida (OH-).
Perhitungan pH Larutan Asam Kuat
Asam kuat adalah asam yang terionisasi sempurna dalam larutan. Artinya, semua molekul asam kuat akan terionisasi menjadi ion hidrogen (H+) dan ion negatifnya. Hal ini menyebabkan konsentrasi ion hidrogen dalam larutan asam kuat sangat tinggi, sehingga pH larutan menjadi rendah.
Cara Menghitung pH Larutan Asam Kuat
Perhitungan pH larutan asam kuat dapat dilakukan dengan menggunakan rumus pH = -log[H+], di mana [H+] adalah konsentrasi ion hidrogen dalam larutan. Karena asam kuat terionisasi sempurna, konsentrasi ion hidrogen sama dengan konsentrasi asam kuat.
Contoh Perhitungan pH Larutan Asam Kuat
Misalnya, kita ingin menghitung pH larutan HCl 0,1 M. Karena HCl adalah asam kuat, maka konsentrasi ion hidrogen [H+] sama dengan 0,1 M. Dengan menggunakan rumus pH = -log[H+], maka pH larutan HCl 0,1 M adalah:
pH = -log(0,1) = 1
Jadi, pH larutan HCl 0,1 M adalah 1.
Hubungan Antara Konsentrasi Asam Kuat dan pH Larutannya
Terdapat hubungan terbalik antara konsentrasi asam kuat dan pH larutannya. Semakin tinggi konsentrasi asam kuat, semakin rendah pH larutannya. Hal ini karena semakin banyak ion hidrogen yang dihasilkan dalam larutan, sehingga konsentrasi ion hidrogen menjadi lebih tinggi dan pH menjadi lebih rendah.
Pemungkas
Melalui pembahasan contoh soal asam kuat beserta jawabannya, kita telah memahami bahwa asam kuat merupakan senyawa yang memiliki sifat khas, seperti kemampuan melepaskan ion hidrogen dan menghasilkan pH rendah. Dengan memahami sifat dan reaksi asam kuat, kita dapat memprediksi perilaku mereka dalam berbagai kondisi dan memanfaatkannya dengan bijak dalam berbagai aplikasi.