Contoh soal elektrokimia – Pernahkah kamu membayangkan bagaimana baterai bekerja atau mengapa besi berkarat? Itulah keajaiban elektrokimia, cabang ilmu kimia yang mempelajari hubungan antara reaksi kimia dan aliran listrik. Di sini, kita akan menjelajahi dunia elektrokimia melalui contoh soal yang menarik, menantang kamu untuk menguji pemahamanmu tentang reaksi redoks, sel volta, dan sel elektrolisis.
Mulai dari menghitung potensial sel standar hingga menentukan massa zat yang dihasilkan dalam elektrolisis, contoh soal ini akan membantumu memahami konsep-konsep kunci dalam elektrokimia. Yuk, kita mulai petualangan ilmiah ini dan temukan bagaimana elektrokimia berperan penting dalam kehidupan kita sehari-hari!
Pengertian Elektrokimia
Elektrokimia adalah cabang ilmu kimia yang mempelajari hubungan antara reaksi kimia dan energi listrik. Sederhananya, elektrokimia mempelajari bagaimana reaksi kimia dapat menghasilkan arus listrik dan bagaimana arus listrik dapat memicu reaksi kimia.
Hubungan Elektrokimia dengan Reaksi Redoks
Elektrokimia erat kaitannya dengan reaksi redoks. Reaksi redoks adalah reaksi kimia yang melibatkan transfer elektron. Dalam reaksi redoks, satu zat mengalami oksidasi (kehilangan elektron) dan zat lainnya mengalami reduksi (mendapatkan elektron). Proses transfer elektron ini merupakan inti dari reaksi elektrokimia, yang dapat menghasilkan arus listrik atau dipicu oleh arus listrik.
Contoh Fenomena Elektrokimia dalam Kehidupan Sehari-hari
Elektrokimia berperan penting dalam berbagai aspek kehidupan sehari-hari, berikut beberapa contohnya:
- Baterai: Baterai merupakan contoh paling umum dari aplikasi elektrokimia. Baterai mengubah energi kimia menjadi energi listrik melalui reaksi redoks. Dalam baterai, reaksi redoks terjadi di elektroda, yang menghasilkan arus listrik yang dapat digunakan untuk menyalakan perangkat elektronik.
- Elektrolisis: Elektrolisis adalah proses penggunaan arus listrik untuk memicu reaksi kimia. Contohnya adalah elektrolisis air untuk menghasilkan hidrogen dan oksigen. Proses ini digunakan dalam berbagai industri, seperti produksi logam, pemurnian air, dan pembuatan bahan kimia.
- Korosi: Korosi adalah proses elektrokimia yang menyebabkan kerusakan material akibat reaksi dengan lingkungan. Contohnya adalah karat pada besi, yang terjadi akibat reaksi redoks antara besi dengan oksigen dan air.
- Sel Elektrokimia: Sel elektrokimia merupakan perangkat yang mengubah energi kimia menjadi energi listrik atau sebaliknya. Sel elektrokimia digunakan dalam berbagai aplikasi, seperti produksi bahan kimia, penyimpanan energi, dan sensor.
Sel Elektrokimia
Sel elektrokimia adalah perangkat yang mengubah energi kimia menjadi energi listrik atau sebaliknya. Sel elektrokimia terdiri dari dua elektroda yang dicelupkan dalam larutan elektrolit. Elektroda adalah konduktor listrik yang memungkinkan aliran elektron, sedangkan elektrolit adalah larutan yang memungkinkan perpindahan ion.
Perbedaan Sel Volta dan Sel Elektrolisis
Sel elektrokimia dapat dibagi menjadi dua jenis: sel volta dan sel elektrolisis. Berikut tabel perbandingan keduanya:
| Fitur | Sel Volta | Sel Elektrolisis |
|---|---|---|
| Jenis Reaksi | Reaksi Redoks Spontan | Reaksi Redoks Non-Spontan |
| Arah Aliran Elektron | Dari Anoda ke Katoda Melalui Sirkuit Eksternal | Dari Katoda ke Anoda Melalui Sumber Arus Eksternal |
| Contoh | Baterai, Aki | Elektrolisis Air, Pengolahan Logam |
| Aplikasi | Sumber Energi Listrik | Produksi Zat Kimia, Pelapisan Logam |
Prinsip Kerja Sel Volta
Sel volta, juga dikenal sebagai sel galvanik, menghasilkan energi listrik dari reaksi redoks spontan. Berikut diagram sel volta sederhana yang menggambarkan prinsip kerjanya:
Dalam diagram ini, logam seng (Zn) bertindak sebagai anoda, tempat oksidasi terjadi. Seng melepaskan elektron dan menjadi ion seng (Zn2+). Elektron-elektron tersebut mengalir melalui sirkuit eksternal menuju katoda, yang terbuat dari logam tembaga (Cu). Pada katoda, ion tembaga (Cu2+) dalam larutan menerima elektron dan tereduksi menjadi logam tembaga (Cu). Reaksi yang terjadi pada sel volta ini dapat dituliskan sebagai berikut:
Anoda: Zn(s) → Zn2+(aq) + 2e–
Katoda: Cu2+(aq) + 2e– → Cu(s)
Reaksi Sel: Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Aliran elektron dari anoda ke katoda melalui sirkuit eksternal menghasilkan arus listrik. Aliran ion dalam larutan elektrolit melengkapi sirkuit, menjaga netralitas listrik.
Membuat Sel Volta Sederhana
Berikut adalah prosedur sederhana untuk membuat sel volta menggunakan bahan-bahan yang mudah didapat:
- Siapkan dua buah gelas kimia.
- Isi salah satu gelas kimia dengan larutan tembaga(II) sulfat (CuSO4) dan yang lainnya dengan larutan seng sulfat (ZnSO4).
- Masukkan lempeng tembaga (Cu) ke dalam larutan CuSO4 dan lempeng seng (Zn) ke dalam larutan ZnSO4.
- Hubungkan kedua lempeng logam dengan kabel penghantar.
- Hubungkan kedua larutan dengan jembatan garam. Jembatan garam adalah tabung berisi larutan elektrolit yang memungkinkan aliran ion antara kedua larutan tanpa menyebabkan pencampuran langsung.
- Amati perubahan yang terjadi. Anda akan melihat bahwa lempeng seng terkikis dan lempeng tembaga dilapisi logam tembaga. Selain itu, Anda dapat mengukur tegangan sel volta dengan menggunakan voltmeter.
Percobaan ini menunjukkan prinsip kerja sel volta, yaitu perubahan energi kimia menjadi energi listrik melalui reaksi redoks spontan.
Contoh soal elektrokimia biasanya membahas tentang reaksi redoks yang terjadi dalam sel elektrokimia. Misalnya, bagaimana menghitung potensial sel atau menentukan arus yang mengalir dalam suatu sel. Nah, untuk memahami konsep gaya yang bekerja pada benda, kamu bisa mempelajari contoh soal benda tegar yang membahas tentang momen inersia, torsi, dan kesetimbangan benda.
Contoh soal benda tegar bisa membantumu memahami bagaimana benda tegar bergerak dan berputar. Kembali ke contoh soal elektrokimia, kamu bisa menemukan soal yang menguji pemahamanmu tentang hukum Faraday, reaksi elektrolisis, dan aplikasi elektrokimia dalam kehidupan sehari-hari.
Potensial Sel: Contoh Soal Elektrokimia
Dalam elektrokimia, potensial sel merupakan salah satu konsep penting yang menggambarkan kecenderungan suatu reaksi redoks untuk berlangsung secara spontan. Potensial sel diukur dalam satuan volt (V) dan mencerminkan perbedaan potensial antara dua elektroda dalam sel elektrokimia.
Potensial Sel Standar
Potensial sel standar (E°sel) adalah potensial sel yang diukur pada kondisi standar, yaitu pada suhu 298 K (25 °C), tekanan 1 atm, dan konsentrasi larutan 1 M. Potensial sel standar dapat dihitung dengan menggunakan persamaan berikut:
E°sel = E°katoda – E°anoda
di mana:
- E°sel adalah potensial sel standar
- E°katoda adalah potensial reduksi standar katoda
- E°anoda adalah potensial reduksi standar anoda
Potensial reduksi standar (E°) merupakan ukuran kecenderungan suatu spesies kimia untuk direduksi. Nilai E° dapat ditemukan dalam tabel potensial reduksi standar, yang menunjukkan potensial reduksi standar berbagai spesies kimia.
Contoh Soal
Misalnya, kita ingin menghitung potensial sel standar untuk sel galvanik yang terdiri dari elektroda tembaga (Cu) dan elektroda seng (Zn). Reaksi redoks yang terjadi adalah:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Langkah-langkah untuk menghitung potensial sel standar:
- Tentukan setengah reaksi reduksi dan oksidasi. Dalam reaksi di atas, seng (Zn) teroksidasi dan tembaga (Cu) tereduksi.
- Tuliskan persamaan setengah reaksi reduksi dan oksidasi, serta nilai potensial reduksi standarnya.
- Zn2+(aq) + 2e– → Zn(s) E° = -0.76 V
- Cu2+(aq) + 2e– → Cu(s) E° = +0.34 V
- Hitung potensial sel standar dengan menggunakan persamaan E°sel = E°katoda – E°anoda. Dalam kasus ini, tembaga (Cu) adalah katoda dan seng (Zn) adalah anoda.
- E°sel = E°Cu – E°Zn = +0.34 V – (-0.76 V) = +1.10 V
Jadi, potensial sel standar untuk sel galvanik ini adalah +1.10 V. Nilai positif ini menunjukkan bahwa reaksi redoks ini spontan.
Tabel Potensial Standar Reduksi
Tabel potensial standar reduksi berisi daftar potensial reduksi standar berbagai spesies kimia. Tabel ini sangat berguna untuk memprediksi spontanitas reaksi redoks.
| Logam | Potensial Reduksi Standar (E°) |
|---|---|
| Li | -3.04 V |
| K | -2.93 V |
| Ba | -2.91 V |
| Ca | -2.87 V |
| Na | -2.71 V |
| Mg | -2.37 V |
| Al | -1.66 V |
| Mn | -1.18 V |
| Zn | -0.76 V |
| Fe | -0.44 V |
| Ni | -0.25 V |
| Sn | -0.14 V |
| Pb | -0.13 V |
| H | 0.00 V |
| Cu | +0.34 V |
| Hg | +0.85 V |
| Ag | +0.80 V |
| Au | +1.50 V |
Untuk memprediksi spontanitas reaksi redoks, kita dapat menggunakan tabel potensial standar reduksi. Jika nilai E°sel positif, maka reaksi redoks spontan. Sebaliknya, jika nilai E°sel negatif, maka reaksi redoks tidak spontan.
Sebagai contoh, perhatikan reaksi antara seng (Zn) dan tembaga (Cu) yang telah dibahas sebelumnya. Dalam tabel potensial standar reduksi, potensial reduksi standar seng (Zn) adalah -0.76 V dan potensial reduksi standar tembaga (Cu) adalah +0.34 V. Karena nilai E°sel positif (+1.10 V), maka reaksi redoks ini spontan.
Hukum Faraday
Hukum Faraday merupakan hukum fundamental dalam elektrokimia yang menjelaskan hubungan antara jumlah zat yang dihasilkan atau diubah pada elektroda dengan jumlah arus listrik yang mengalir. Hukum ini memiliki dua bagian, yaitu Hukum Faraday I dan Hukum Faraday II, yang keduanya penting dalam memahami proses elektrolisis.
Hukum Faraday I
Hukum Faraday I menyatakan bahwa massa zat yang dihasilkan atau diubah pada elektroda sebanding dengan jumlah muatan listrik yang mengalir melalui elektrolit. Artinya, semakin besar jumlah muatan listrik yang mengalir, semakin banyak zat yang dihasilkan atau diubah. Hukum ini dapat dirumuskan sebagai berikut:
m = (Q * Ar) / (z * F)
di mana:
- m adalah massa zat yang dihasilkan atau diubah (gram)
- Q adalah jumlah muatan listrik (Coulomb)
- Ar adalah massa atom relatif zat (gram/mol)
- z adalah jumlah elektron yang terlibat dalam reaksi elektrokimia (bilangan oksidasi)
- F adalah konstanta Faraday (96.485 Coulomb/mol)
Hukum Faraday II
Hukum Faraday II menyatakan bahwa massa zat yang dihasilkan atau diubah pada elektroda sebanding dengan ekivalen kimia zat tersebut. Ekivalen kimia adalah massa zat yang setara dengan 1 mol elektron. Dengan kata lain, massa zat yang dihasilkan atau diubah sebanding dengan jumlah mol elektron yang terlibat dalam reaksi elektrokimia. Hukum ini dapat dirumuskan sebagai berikut:
m = (I * t * Ar) / (z * F)
di mana:
- m adalah massa zat yang dihasilkan atau diubah (gram)
- I adalah arus listrik (Ampere)
- t adalah waktu elektrolisis (detik)
- Ar adalah massa atom relatif zat (gram/mol)
- z adalah jumlah elektron yang terlibat dalam reaksi elektrokimia (bilangan oksidasi)
- F adalah konstanta Faraday (96.485 Coulomb/mol)
Contoh Soal
Misalnya, kita ingin menghitung massa tembaga yang dihasilkan pada elektrolisis larutan CuSO4 dengan arus listrik 2 Ampere selama 30 menit. Reaksi elektrokimia yang terjadi adalah:
Cu2+ + 2e– → Cu
Langkah-langkah untuk menghitung massa tembaga yang dihasilkan:
- Hitung jumlah muatan listrik yang mengalir: Q = I * t = 2 Ampere * 1800 detik = 3600 Coulomb
- Hitung massa atom relatif tembaga (Cu): Ar = 63,55 g/mol
- Tentukan jumlah elektron yang terlibat dalam reaksi: z = 2
- Hitung massa tembaga yang dihasilkan: m = (Q * Ar) / (z * F) = (3600 Coulomb * 63,55 g/mol) / (2 * 96485 Coulomb/mol) = 1,18 gram
Aplikasi Hukum Faraday dalam Industri Elektrokimia
Hukum Faraday memiliki aplikasi yang luas dalam industri elektrokimia, antara lain:
- Elektroplating: Proses pelapisan logam dengan logam lain untuk meningkatkan ketahanan terhadap korosi, meningkatkan daya tahan, atau memberikan penampilan estetika. Misalnya, pelapisan nikel pada baja untuk meningkatkan ketahanan terhadap korosi.
- Elektrorefining: Proses pemurnian logam dengan menggunakan elektrolisis. Misalnya, pemurnian tembaga untuk menghasilkan tembaga dengan kemurnian tinggi.
- Elektrokimia: Proses produksi zat kimia dengan menggunakan arus listrik. Misalnya, produksi klorin dan natrium hidroksida dari larutan garam.
- Baterai: Proses penyimpanan energi kimia dalam bentuk energi listrik. Hukum Faraday digunakan untuk menghitung kapasitas baterai dan menentukan waktu pengisian dan pengosongan.
Aplikasi Elektrokimia
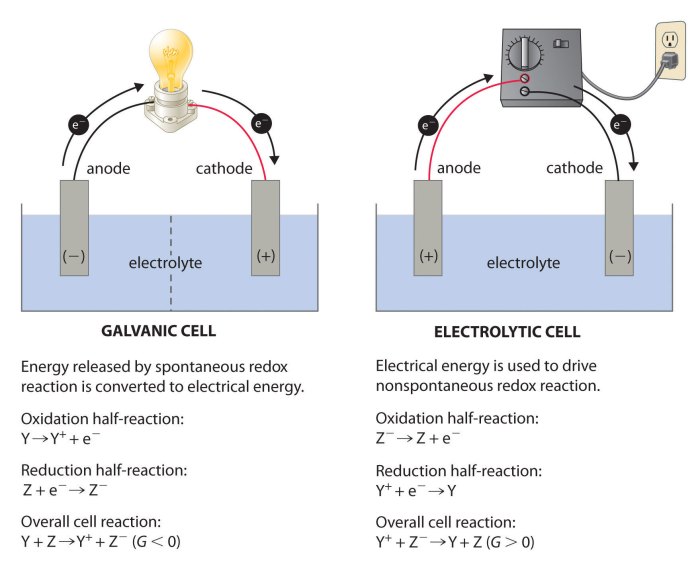
Elektrokimia, ilmu yang mempelajari hubungan antara reaksi kimia dan energi listrik, memiliki aplikasi luas dalam kehidupan sehari-hari. Dari baterai yang menggerakkan perangkat elektronik hingga proses industri yang menghasilkan bahan kimia penting, elektrokimia berperan penting dalam berbagai bidang.
Energi
Elektrokimia memainkan peran kunci dalam pengembangan teknologi energi, khususnya dalam baterai dan sel bahan bakar.
- Baterai merupakan perangkat elektrokimia yang menyimpan energi kimia dan mengubahnya menjadi energi listrik melalui reaksi redoks. Baterai digunakan secara luas dalam berbagai perangkat elektronik, kendaraan listrik, dan sistem penyimpanan energi.
- Sel bahan bakar merupakan perangkat elektrokimia yang mengubah energi kimia dari bahan bakar, seperti hidrogen, menjadi energi listrik melalui reaksi redoks. Sel bahan bakar menawarkan efisiensi tinggi dan emisi rendah, menjadikannya sumber energi yang menjanjikan untuk aplikasi seperti kendaraan dan pembangkit listrik.
Industri
Elektrokimia memiliki peran penting dalam berbagai proses industri, seperti pelapisan logam dan produksi klorin.
- Pelapisan logam adalah proses elektrokimia yang melibatkan penggunaan arus listrik untuk melapisi permukaan logam dengan logam lain. Proses ini meningkatkan ketahanan korosi, kekerasan, dan penampilan permukaan logam. Contohnya, pelapisan krom pada logam untuk meningkatkan ketahanan korosi dan kilap.
- Produksi klorin adalah proses elektrokimia yang menggunakan elektrolisis untuk menghasilkan klorin dari larutan garam. Klorin merupakan bahan kimia penting yang digunakan dalam berbagai industri, seperti produksi plastik, disinfektan, dan obat-obatan.
Contoh Soal Elektrokimia
Elektrokimia adalah cabang ilmu kimia yang mempelajari hubungan antara reaksi kimia dan arus listrik. Konsep ini diterapkan dalam berbagai bidang, mulai dari baterai dan sel bahan bakar hingga korosi dan elektrolisis. Dalam artikel ini, kita akan membahas beberapa contoh soal elektrokimia yang mencakup berbagai aspek penting dari topik ini.
Sel Volta
Sel volta adalah sel elektrokimia yang mengubah energi kimia menjadi energi listrik. Potensial sel standar (Eosel) adalah ukuran kecenderungan reaksi redoks untuk terjadi dalam kondisi standar. Untuk menghitung potensial sel standar, kita dapat menggunakan persamaan berikut:
Eosel = Eokatoda – Eoanoda
Dimana Eokatoda dan Eoanoda adalah potensial standar reduksi untuk katoda dan anoda, masing-masing.
- Contoh soal: Hitung potensial sel standar untuk sel volta yang terdiri dari elektroda tembaga (Cu) dalam larutan CuSO4 1 M dan elektroda seng (Zn) dalam larutan ZnSO4 1 M. Diketahui potensial standar reduksi untuk Cu2+/Cu adalah +0.34 V dan untuk Zn2+/Zn adalah -0.76 V.
Elektrolisis
Elektrolisis adalah proses penggunaan arus listrik untuk memaksa reaksi non-spontan terjadi. Massa zat yang dihasilkan selama elektrolisis dapat dihitung menggunakan hukum Faraday. Hukum Faraday menyatakan bahwa massa zat yang dihasilkan selama elektrolisis sebanding dengan jumlah muatan listrik yang dilewatkan melalui sel elektrolisis.
- Contoh soal: Berapa massa tembaga yang dihasilkan dari elektrolisis larutan CuSO4 selama 1 jam dengan arus listrik 2 A? Diketahui massa atom Cu adalah 63.5 g/mol dan 1 Faraday (F) = 96485 C/mol.
Elektrokimia dan Kesetimbangan
Konsep elektrokimia dapat dipadukan dengan konsep kesetimbangan kimia. Misalnya, kita dapat menggunakan potensial sel standar untuk menentukan konstanta kesetimbangan (K) untuk reaksi redoks.
- Contoh soal: Tentukan konstanta kesetimbangan (K) untuk reaksi redoks berikut pada 25 °C:
2 Fe3+(aq) + Sn2+(aq) 2 Fe2+(aq) + Sn4+(aq)
Diketahui potensial standar reduksi untuk Fe3+/Fe2+ adalah +0.77 V dan untuk Sn4+/Sn2+ adalah +0.15 V.
Elektrokimia dan Kinetika Reaksi
Konsep elektrokimia juga dapat dipadukan dengan kinetika reaksi. Misalnya, kita dapat menggunakan potensial sel standar untuk memprediksi laju reaksi redoks.
- Contoh soal: Perhatikan reaksi redoks berikut:
Zn(s) + Cu2+(aq) Zn2+(aq) + Cu(s)
Bagaimana pengaruh perubahan konsentrasi ion Cu2+ terhadap laju reaksi? Jelaskan jawaban Anda berdasarkan prinsip elektrokimia.
Diagram Sel
Diagram sel adalah representasi grafis dari sel elektrokimia, yang menggambarkan komponen-komponen sel dan arah aliran elektron. Diagram sel membantu kita memahami proses elektrokimia dan memprediksi potensial sel.
Cara Membuat Diagram Sel
Untuk membuat diagram sel, kita perlu mengikuti beberapa langkah:
- Tuliskan reaksi redoks yang terjadi di sel. Reaksi redoks terbagi menjadi dua setengah reaksi: reaksi oksidasi dan reaksi reduksi. Reaksi oksidasi terjadi pada anoda, sedangkan reaksi reduksi terjadi pada katoda.
- Tentukan anoda dan katoda. Anoda adalah elektroda tempat oksidasi terjadi, sedangkan katoda adalah elektroda tempat reduksi terjadi.
- Tuliskan simbol elektroda dan larutan yang terlibat dalam reaksi. Simbol elektroda biasanya ditulis dalam tanda kurung siku, sedangkan larutan ditulis dalam tanda kurung bulat.
- Tambahkan jembatan garam atau membran semipermeabel untuk menghubungkan kedua setengah sel. Jembatan garam atau membran semipermeabel memungkinkan ion mengalir antara kedua setengah sel, menjaga netralitas listrik sel.
- Tuliskan arah aliran elektron. Elektron mengalir dari anoda ke katoda melalui rangkaian eksternal.
- Tuliskan potensial sel (E°sel) di bagian bawah diagram sel. Potensial sel adalah perbedaan potensial antara anoda dan katoda.
Contoh Diagram Sel
Sebagai contoh, mari kita perhatikan reaksi antara logam seng dan larutan tembaga(II) sulfat. Reaksi ini menghasilkan seng(II) sulfat dan logam tembaga.
- Reaksi redoks:
- Oksidasi: Zn(s) → Zn2+(aq) + 2e–
- Reduksi: Cu2+(aq) + 2e– → Cu(s)
- Anoda: Zn(s) | Zn2+(aq)
- Katoda: Cu2+(aq) | Cu(s)
- Jembatan garam: ||
- Aliran elektron: dari Zn ke Cu
- Potensial sel: E°sel = E°katoda – E°anoda = +0.34 V – (-0.76 V) = +1.10 V
Diagram Sel dan Prediksi Arah Aliran Elektron, Contoh soal elektrokimia
Diagram sel dapat digunakan untuk memprediksi arah aliran elektron dan potensial sel.
- Arah aliran elektron selalu dari anoda ke katoda. Anoda adalah elektroda yang memiliki potensial reduksi lebih rendah, sedangkan katoda adalah elektroda yang memiliki potensial reduksi lebih tinggi.
- Potensial sel adalah perbedaan potensial antara anoda dan katoda. Potensial sel positif menunjukkan bahwa reaksi elektrokimia spontan dan dapat menghasilkan energi listrik. Potensial sel negatif menunjukkan bahwa reaksi elektrokimia tidak spontan dan membutuhkan energi listrik untuk berlangsung.
Contoh Prediksi Arah Aliran Elektron
Dalam contoh reaksi antara logam seng dan larutan tembaga(II) sulfat, potensial sel positif (+1.10 V). Ini menunjukkan bahwa reaksi spontan dan menghasilkan energi listrik. Elektron akan mengalir dari anoda (seng) ke katoda (tembaga).
Faktor yang Mempengaruhi Potensial Sel
Potensial sel, yang merupakan perbedaan potensial antara elektroda positif dan negatif dalam sel elektrokimia, merupakan faktor penting yang menentukan arah dan kelancaran reaksi redoks dalam sel. Faktor-faktor seperti konsentrasi, temperatur, dan tekanan dapat secara signifikan mempengaruhi potensial sel, sehingga memengaruhi efisiensi dan hasil reaksi elektrokimia.
Pengaruh Konsentrasi
Konsentrasi reaktan dan produk dalam sel elektrokimia memiliki pengaruh yang signifikan terhadap potensial sel. Hal ini dapat dijelaskan melalui persamaan Nernst, yang menghubungkan potensial sel dengan konsentrasi reaktan dan produk:
E = E° – (RT/nF) ln Q
Dimana:
- E adalah potensial sel
- E° adalah potensial sel standar
- R adalah konstanta gas ideal
- T adalah temperatur dalam Kelvin
- n adalah jumlah elektron yang ditransfer dalam reaksi
- F adalah konstanta Faraday
- Q adalah hasil bagi reaksi
Persamaan Nernst menunjukkan bahwa potensial sel akan berubah seiring dengan perubahan konsentrasi reaktan dan produk. Jika konsentrasi reaktan meningkat, potensial sel akan meningkat, dan sebaliknya. Sebaliknya, jika konsentrasi produk meningkat, potensial sel akan menurun.
Berikut adalah contoh soal yang menunjukkan pengaruh konsentrasi terhadap potensial sel:
Perhatikan sel volta yang terdiri dari elektroda tembaga (Cu) dan elektroda perak (Ag) dalam larutan CuSO4 dan AgNO3, masing-masing dengan konsentrasi 1 M. Potensial sel standar untuk sel ini adalah 0,46 V. Hitung potensial sel jika konsentrasi CuSO4 diubah menjadi 0,1 M, sementara konsentrasi AgNO3 tetap 1 M.
Penyelesaian:
Reaksi sel yang terjadi adalah:
Cu(s) + 2Ag+(aq) → Cu2+(aq) + 2Ag(s)
Hasil bagi reaksi (Q) adalah:
Q = [Cu2+]/[Ag+]2 = (0,1)/(1)2 = 0,1
Dengan menggunakan persamaan Nernst:
E = E° – (RT/nF) ln Q = 0,46 – (8,314 × 298)/(2 × 96485) ln 0,1 = 0,51 V
Hasil perhitungan menunjukkan bahwa potensial sel meningkat dari 0,46 V menjadi 0,51 V ketika konsentrasi CuSO4 dikurangi menjadi 0,1 M. Hal ini sesuai dengan persamaan Nernst, yang menunjukkan bahwa potensial sel akan meningkat ketika konsentrasi reaktan berkurang.
Pengaruh Temperatur
Temperatur juga memiliki pengaruh yang signifikan terhadap potensial sel. Hal ini dapat dilihat dari persamaan Nernst, dimana temperatur (T) muncul dalam persamaan tersebut. Secara umum, peningkatan temperatur akan meningkatkan potensial sel. Hal ini karena peningkatan temperatur akan meningkatkan energi kinetik partikel, yang akan meningkatkan laju reaksi redoks dan meningkatkan potensial sel.
Pengaruh Tekanan
Tekanan juga dapat mempengaruhi potensial sel, terutama untuk reaksi yang melibatkan gas. Peningkatan tekanan pada gas reaktan akan meningkatkan konsentrasi gas tersebut, yang akan meningkatkan potensial sel. Hal ini karena peningkatan konsentrasi reaktan akan mendorong reaksi ke arah pembentukan produk, yang akan meningkatkan potensial sel.
Kesimpulan Akhir
Dengan memahami contoh soal elektrokimia, kita dapat lebih memahami fenomena alam yang terjadi di sekitar kita, mulai dari korosi logam hingga proses kerja baterai. Elektrokimia merupakan bidang yang menarik dan penuh tantangan, dan melalui pemahaman yang lebih dalam, kita dapat membuka peluang untuk mengembangkan teknologi baru yang lebih efisien dan ramah lingkungan.





