Ikatan hidrogen, sebuah ikatan antarmolekul yang kuat, memainkan peran penting dalam berbagai fenomena alam dan proses kimia. Dari titik didih air yang tinggi hingga struktur DNA yang kompleks, ikatan hidrogen selalu hadir. Bagaimana dengan pemahamanmu tentang ikatan ini? Yuk, uji kemampuanmu dengan contoh soal ikatan hidrogen yang akan kita bahas di sini.
Contoh soal yang akan kita pelajari meliputi berbagai aspek, mulai dari definisi dan syarat terbentuknya ikatan hidrogen hingga penerapannya dalam kehidupan sehari-hari. Siap-siap untuk mengasah pemahamanmu dan menguji pengetahuanmu tentang ikatan yang kuat ini.
Pengertian Ikatan Hidrogen
Ikatan hidrogen merupakan jenis interaksi antarmolekul yang terjadi ketika atom hidrogen (H) terikat secara kovalen pada atom elektronegatif seperti oksigen (O), nitrogen (N), atau fluor (F) dan tertarik pada pasangan elektron bebas pada atom elektronegatif lain. Ikatan ini lebih lemah daripada ikatan kovalen atau ionik, tetapi cukup kuat untuk memengaruhi sifat-sifat banyak senyawa, seperti titik didih dan kelarutan.
Contoh Senyawa yang Memiliki Ikatan Hidrogen
Banyak senyawa memiliki ikatan hidrogen. Contoh yang umum di antaranya:
- Air (H2O): Molekul air memiliki dua atom hidrogen yang terikat pada atom oksigen. Atom hidrogen dalam satu molekul air tertarik pada atom oksigen pada molekul air lain, membentuk ikatan hidrogen.
- Amonia (NH3): Atom nitrogen dalam amonia memiliki pasangan elektron bebas dan menarik atom hidrogen dari molekul amonia lain.
- Metanol (CH3OH): Atom oksigen dalam metanol memiliki pasangan elektron bebas dan menarik atom hidrogen dari molekul metanol lain.
Perbedaan Ikatan Hidrogen dengan Ikatan Kovalen dan Ikatan Ion
Berikut perbedaan ikatan hidrogen dengan ikatan kovalen dan ikatan ion:
| Jenis Ikatan | Pengertian | Contoh |
|---|---|---|
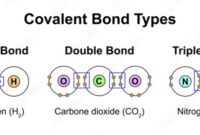
| Ikatan Kovalen | Ikatan yang terbentuk dari pemakaian bersama pasangan elektron antara dua atom. | H2, O2, H2O |
| Ikatan Ion | Ikatan yang terbentuk dari gaya tarik-menarik elektrostatik antara ion bermuatan berlawanan. | NaCl, MgO, KBr |
| Ikatan Hidrogen | Interaksi antarmolekul yang terjadi ketika atom hidrogen terikat secara kovalen pada atom elektronegatif dan tertarik pada pasangan elektron bebas pada atom elektronegatif lain. | H2O, NH3, HF |
Syarat Terbentuknya Ikatan Hidrogen
Ikatan hidrogen merupakan jenis interaksi antarmolekul yang relatif kuat dan memainkan peran penting dalam berbagai fenomena kimia dan biologi. Ikatan ini terbentuk antara atom hidrogen yang terikat secara kovalen pada atom elektronegatif seperti oksigen (O), nitrogen (N), atau fluor (F) dengan pasangan elektron bebas pada atom elektronegatif lain.
Syarat Terbentuknya Ikatan Hidrogen
Terbentuknya ikatan hidrogen membutuhkan beberapa syarat yang harus dipenuhi. Syarat-syarat tersebut meliputi:
- Adanya atom hidrogen yang terikat pada atom elektronegatif. Atom hidrogen ini memiliki muatan parsial positif karena elektron terikat lebih kuat pada atom elektronegatif.
- Adanya pasangan elektron bebas pada atom elektronegatif lain. Pasangan elektron bebas ini memiliki muatan parsial negatif.
- Adanya jarak yang relatif dekat antara atom hidrogen dan pasangan elektron bebas. Jarak ini harus cukup dekat agar interaksi antarmolekul dapat terjadi.
Peran Atom Hidrogen dan Atom Elektronegatif
Atom hidrogen dan atom elektronegatif berperan penting dalam pembentukan ikatan hidrogen. Atom hidrogen bertindak sebagai donor, menyumbangkan muatan positif parsialnya untuk membentuk ikatan dengan pasangan elektron bebas pada atom elektronegatif lain yang berperan sebagai akseptor.
Perbedaan elektronegativitas antara atom hidrogen dan atom elektronegatif menyebabkan polarisasi ikatan kovalen, sehingga atom hidrogen memiliki muatan positif parsial dan atom elektronegatif memiliki muatan negatif parsial. Interaksi elektrostatik antara muatan parsial positif pada atom hidrogen dan muatan parsial negatif pada pasangan elektron bebas atom elektronegatif inilah yang membentuk ikatan hidrogen.
Contoh Senyawa yang Memenuhi Syarat Terbentuknya Ikatan Hidrogen
Beberapa contoh senyawa yang memenuhi syarat terbentuknya ikatan hidrogen antara lain:
- Air (H2O): Molekul air memiliki dua atom hidrogen yang terikat pada atom oksigen. Oksigen lebih elektronegatif daripada hidrogen, sehingga terdapat muatan parsial positif pada atom hidrogen dan muatan parsial negatif pada atom oksigen. Pasangan elektron bebas pada atom oksigen dapat berinteraksi dengan atom hidrogen dari molekul air lain, membentuk ikatan hidrogen.
- Amonia (NH3): Molekul amonia memiliki tiga atom hidrogen yang terikat pada atom nitrogen. Nitrogen lebih elektronegatif daripada hidrogen, sehingga terdapat muatan parsial positif pada atom hidrogen dan muatan parsial negatif pada atom nitrogen. Pasangan elektron bebas pada atom nitrogen dapat berinteraksi dengan atom hidrogen dari molekul amonia lain, membentuk ikatan hidrogen.
- Metanol (CH3OH): Molekul metanol memiliki satu atom hidrogen yang terikat pada atom oksigen. Oksigen lebih elektronegatif daripada hidrogen, sehingga terdapat muatan parsial positif pada atom hidrogen dan muatan parsial negatif pada atom oksigen. Pasangan elektron bebas pada atom oksigen dapat berinteraksi dengan atom hidrogen dari molekul metanol lain, membentuk ikatan hidrogen.
Sifat Ikatan Hidrogen
Ikatan hidrogen merupakan jenis interaksi antarmolekul yang kuat, berperan penting dalam menentukan sifat fisik dan kimia suatu senyawa. Ikatan ini terjadi ketika atom hidrogen terikat pada atom elektronegatif seperti oksigen (O), nitrogen (N), atau fluor (F) dan berinteraksi dengan pasangan elektron bebas pada atom elektronegatif lain. Kekuatan ikatan hidrogen ini akan menentukan sifat fisik dan kimia senyawa yang memilikinya.
Kekuatan Ikatan dan Titik Didih
Kekuatan ikatan hidrogen dipengaruhi oleh beberapa faktor, seperti elektronegativitas atom dan ukuran atom. Semakin tinggi elektronegativitas atom, semakin kuat ikatan hidrogen yang terbentuk. Begitu pula dengan ukuran atom, semakin kecil ukuran atom, semakin kuat ikatan hidrogen yang terbentuk. Ikatan hidrogen ini memiliki kekuatan yang lebih kuat daripada gaya Van der Waals, namun lebih lemah daripada ikatan kovalen. Kekuatan ikatan hidrogen yang kuat ini akan memengaruhi titik didih suatu senyawa. Semakin kuat ikatan hidrogen yang terbentuk, semakin tinggi titik didihnya. Hal ini karena energi yang dibutuhkan untuk memutuskan ikatan hidrogen dan mengubah zat cair menjadi gas akan lebih besar.
Pengaruh Ikatan Hidrogen terhadap Sifat Fisik dan Kimia Suatu Senyawa
Ikatan hidrogen memiliki pengaruh yang signifikan terhadap sifat fisik dan kimia suatu senyawa. Beberapa contoh pengaruhnya adalah:
- Titik didih: Ikatan hidrogen menyebabkan titik didih senyawa menjadi lebih tinggi. Contohnya, air memiliki titik didih yang relatif tinggi dibandingkan dengan senyawa sejenis seperti hidrogen sulfida (H2S). Hal ini karena air memiliki ikatan hidrogen yang kuat antar molekulnya, sehingga membutuhkan energi yang lebih besar untuk memisahkan molekul air dan mengubahnya menjadi uap.
- Kelarutan: Ikatan hidrogen juga berperan dalam kelarutan suatu senyawa. Senyawa yang dapat membentuk ikatan hidrogen dengan air akan lebih mudah larut dalam air. Contohnya, gula (sukrosa) dapat larut dalam air karena gula dapat membentuk ikatan hidrogen dengan molekul air. Senyawa yang tidak dapat membentuk ikatan hidrogen dengan air akan lebih sulit larut dalam air, seperti minyak.
- Viskositas: Ikatan hidrogen juga dapat memengaruhi viskositas suatu cairan. Senyawa yang memiliki ikatan hidrogen yang kuat akan memiliki viskositas yang lebih tinggi. Contohnya, gliserol memiliki viskositas yang lebih tinggi dibandingkan dengan etanol karena gliserol memiliki lebih banyak gugus hidroksil yang dapat membentuk ikatan hidrogen.
Pengaruh Ikatan Hidrogen terhadap Sifat Fisik dan Kimia Air
Air merupakan contoh senyawa yang memiliki ikatan hidrogen yang kuat. Ikatan hidrogen ini memberikan sifat unik pada air, seperti:
- Titik didih tinggi: Air memiliki titik didih yang relatif tinggi (100 °C) dibandingkan dengan senyawa sejenis seperti hidrogen sulfida (H2S) yang memiliki titik didih -60 °C. Hal ini karena air memiliki ikatan hidrogen yang kuat antar molekulnya, sehingga membutuhkan energi yang lebih besar untuk memisahkan molekul air dan mengubahnya menjadi uap.
- Kapasitas panas tinggi: Air memiliki kapasitas panas yang tinggi, artinya air dapat menyerap banyak panas tanpa mengalami perubahan suhu yang signifikan. Hal ini karena ikatan hidrogen yang kuat dalam air dapat menyerap energi panas dan digunakan untuk memutuskan ikatan hidrogen. Sifat ini penting untuk menjaga suhu tubuh makhluk hidup tetap stabil.
- Densitas air: Air memiliki densitas yang lebih tinggi dalam keadaan cair dibandingkan dengan keadaan padat (es). Hal ini karena ikatan hidrogen dalam es membentuk struktur kisi yang lebih teratur dan memiliki ruang antar molekul yang lebih besar dibandingkan dengan air cair. Akibatnya, es memiliki densitas yang lebih rendah dan mengapung di air.
- Pelarut universal: Air dikenal sebagai pelarut universal karena kemampuannya untuk melarutkan berbagai macam zat. Hal ini karena sifat polar air yang memungkinkan air membentuk ikatan hidrogen dengan zat polar lainnya, seperti gula dan garam. Air juga dapat melarutkan beberapa zat nonpolar melalui interaksi Van der Waals.
Contoh Soal Ikatan Hidrogen
Ikatan hidrogen merupakan salah satu jenis interaksi antarmolekul yang penting dalam kimia. Ikatan ini terbentuk antara atom hidrogen yang terikat pada atom elektronegatif seperti oksigen, nitrogen, atau fluor, dengan pasangan elektron bebas pada atom elektronegatif lain. Ikatan hidrogen memainkan peran penting dalam berbagai fenomena kimia dan biologi, seperti titik didih air yang tinggi, struktur protein, dan replikasi DNA.
Untuk memahami lebih dalam tentang ikatan hidrogen, mari kita coba mengerjakan beberapa contoh soal. Contoh soal ini akan membantu kamu menguji pemahamanmu tentang konsep ikatan hidrogen dan aplikasinya dalam berbagai bidang.
Soal Pilihan Ganda
Berikut ini adalah lima contoh soal pilihan ganda tentang ikatan hidrogen:
- Manakah dari molekul berikut yang dapat membentuk ikatan hidrogen dengan air?
- a. CH4
- b. NH3
- c. CO2
- d. H2S
- Ikatan hidrogen terbentuk antara atom hidrogen dan atom elektronegatif lain. Manakah dari atom berikut yang paling elektronegatif?
- a. Oksigen (O)
- b. Nitrogen (N)
- c. Fluor (F)
- d. Karbon (C)
- Ikatan hidrogen bertanggung jawab atas sifat air yang unik. Manakah dari sifat air berikut yang disebabkan oleh ikatan hidrogen?
- a. Titik didih yang tinggi
- b. Tegangan permukaan yang tinggi
- c. Pelarut yang baik untuk banyak zat
- d. Semua jawaban di atas benar
- Manakah dari molekul berikut yang tidak dapat membentuk ikatan hidrogen dengan dirinya sendiri?
- a. Etanol (C2H5OH)
- b. Amonia (NH3)
- c. Metana (CH4)
- d. Asam asetat (CH3COOH)
- Ikatan hidrogen memainkan peran penting dalam struktur protein. Manakah dari struktur protein berikut yang dipertahankan oleh ikatan hidrogen?
- a. Struktur primer
- b. Struktur sekunder
- c. Struktur tersier
- d. Semua jawaban di atas benar
Soal Uraian
Berikut ini adalah tiga contoh soal uraian tentang ikatan hidrogen:
- Jelaskan bagaimana ikatan hidrogen terbentuk dan berikan contoh molekul yang dapat membentuk ikatan hidrogen.
- Jelaskan bagaimana ikatan hidrogen memengaruhi sifat fisik air, seperti titik didih dan tegangan permukaan.
- Jelaskan peran ikatan hidrogen dalam struktur protein dan bagaimana ikatan ini memengaruhi fungsi protein.
Tabel Contoh Soal Ikatan Hidrogen
| Soal | Kunci Jawaban | Pembahasan |
|---|---|---|
| Manakah dari molekul berikut yang dapat membentuk ikatan hidrogen dengan air? | b. NH3 | Amonia (NH3) dapat membentuk ikatan hidrogen dengan air karena atom nitrogen dalam amonia memiliki pasangan elektron bebas yang dapat berinteraksi dengan atom hidrogen dalam air. |
| Ikatan hidrogen terbentuk antara atom hidrogen dan atom elektronegatif lain. Manakah dari atom berikut yang paling elektronegatif? | c. Fluor (F) | Fluor (F) adalah atom yang paling elektronegatif dalam tabel periodik. Atom F memiliki kemampuan yang kuat untuk menarik elektron dari atom lain, sehingga menyebabkan ikatan hidrogen yang lebih kuat. |
| Ikatan hidrogen bertanggung jawab atas sifat air yang unik. Manakah dari sifat air berikut yang disebabkan oleh ikatan hidrogen? | d. Semua jawaban di atas benar | Ikatan hidrogen bertanggung jawab atas titik didih air yang tinggi, tegangan permukaan yang tinggi, dan kemampuan air sebagai pelarut yang baik untuk banyak zat. |
Perbedaan Ikatan Hidrogen dengan Ikatan Van Der Waals
Ikatan hidrogen dan ikatan Van Der Waals adalah dua jenis interaksi antarmolekul yang penting dalam menentukan sifat fisik dan kimia suatu zat. Kedua ikatan ini memiliki peran penting dalam menentukan titik didih, titik leleh, kelarutan, dan viskositas suatu zat. Meskipun keduanya termasuk dalam kategori ikatan antarmolekul, namun terdapat perbedaan signifikan antara keduanya, terutama dalam hal kekuatan ikatan dan jenis atom yang terlibat.
Perbedaan Ikatan Hidrogen dengan Ikatan Van Der Waals
Perbedaan utama antara ikatan hidrogen dan ikatan Van Der Waals terletak pada kekuatan ikatan dan jenis atom yang terlibat. Ikatan hidrogen adalah jenis interaksi antarmolekul yang lebih kuat dibandingkan dengan ikatan Van Der Waals. Ikatan hidrogen terjadi antara atom hidrogen yang terikat pada atom elektronegatif seperti oksigen (O), nitrogen (N), atau fluor (F) dengan pasangan elektron bebas pada atom elektronegatif lainnya. Sementara itu, ikatan Van Der Waals merupakan interaksi yang lebih lemah dan terjadi akibat fluktuasi sementara dalam distribusi elektron dalam molekul.
Kekuatan Relatif Kedua Jenis Ikatan
Kekuatan ikatan hidrogen lebih kuat dibandingkan dengan ikatan Van Der Waals. Hal ini disebabkan oleh sifat polar dari ikatan hidrogen yang melibatkan interaksi dipol-dipol yang kuat. Ikatan hidrogen memiliki energi ikatan yang lebih tinggi, berkisar antara 4-10 kkal/mol, sedangkan ikatan Van Der Waals memiliki energi ikatan yang lebih rendah, berkisar antara 0,5-5 kkal/mol. Kekuatan relatif kedua jenis ikatan ini dapat dilihat pada titik didih zat. Senyawa yang memiliki ikatan hidrogen memiliki titik didih yang lebih tinggi dibandingkan dengan senyawa yang memiliki ikatan Van Der Waals.
Contoh Senyawa yang Memiliki Ikatan Van Der Waals
Banyak senyawa yang memiliki ikatan Van Der Waals. Beberapa contohnya adalah:
- Metana (CH4)
- Etan (C2H6)
- Propana (C3H8)
- Butana (C4H10)
- Pentan (C5H12)
Senyawa-senyawa ini memiliki titik didih yang relatif rendah karena hanya memiliki ikatan Van Der Waals. Semakin panjang rantai karbon, semakin besar gaya Van Der Waals, sehingga titik didihnya akan semakin tinggi.
Pengaruh Ikatan Hidrogen terhadap Titik Didih
Ikatan hidrogen merupakan jenis interaksi antarmolekul yang kuat dan berperan penting dalam menentukan sifat-sifat fisik suatu senyawa, salah satunya adalah titik didih. Senyawa yang memiliki ikatan hidrogen cenderung memiliki titik didih yang lebih tinggi dibandingkan dengan senyawa yang tidak memiliki ikatan hidrogen dengan berat molekul yang sebanding.
Contoh soal ikatan hidrogen biasanya membahas interaksi antar molekul, seperti bagaimana air membentuk ikatan hidrogen. Nah, mirip dengan itu, contoh soal pendapatan nasional keseimbangan juga mengkaji hubungan antar komponen ekonomi, seperti bagaimana investasi, konsumsi, dan pengeluaran pemerintah saling memengaruhi. Untuk lebih jelasnya, kamu bisa cek contoh soal pendapatan nasional keseimbangan ini.
Sama seperti memahami ikatan hidrogen, memahami konsep pendapatan nasional keseimbangan penting untuk menganalisis kondisi ekonomi suatu negara.
Pengaruh Ikatan Hidrogen terhadap Titik Didih
Ikatan hidrogen terjadi antara atom hidrogen yang terikat pada atom elektronegatif seperti oksigen (O), nitrogen (N), atau fluor (F) dengan pasangan elektron bebas pada atom elektronegatif lainnya. Ikatan ini bersifat kuat karena melibatkan interaksi dipol-dipol yang kuat dan pembentukan ikatan hidrogen membutuhkan energi yang cukup besar untuk diputus.
Ketika suatu senyawa dipanaskan, energi kinetik molekul meningkat. Jika energi kinetik cukup tinggi, ikatan hidrogen yang lemah akan putus dan molekul akan dapat bergerak bebas, sehingga senyawa akan mendidih. Senyawa yang memiliki ikatan hidrogen membutuhkan energi yang lebih besar untuk memutus ikatan hidrogen tersebut, sehingga titik didihnya akan lebih tinggi.
Contoh Perbandingan Titik Didih
Perhatikan contoh perbandingan titik didih senyawa berikut:
- Air (H2O) memiliki titik didih 100 °C, sedangkan metana (CH4) memiliki titik didih -161 °C.
- Etanol (C2H5OH) memiliki titik didih 78 °C, sedangkan dietil eter (C2H5OC2H5) memiliki titik didih 35 °C.
Air dan etanol memiliki ikatan hidrogen, sedangkan metana dan dietil eter tidak memiliki ikatan hidrogen. Perbedaan titik didih yang signifikan antara kedua pasang senyawa tersebut menunjukkan bahwa ikatan hidrogen memiliki pengaruh yang besar terhadap titik didih.
Hubungan Kekuatan Ikatan Hidrogen dengan Titik Didih
Kekuatan ikatan hidrogen dipengaruhi oleh beberapa faktor, termasuk elektronegativitas atom yang terlibat dan jumlah pasangan elektron bebas pada atom elektronegatif. Semakin kuat ikatan hidrogen, semakin tinggi titik didihnya.
Berikut adalah grafik yang menunjukkan hubungan antara kekuatan ikatan hidrogen dengan titik didih:
[Gambar Grafik: Grafik dengan sumbu X menunjukkan kekuatan ikatan hidrogen dan sumbu Y menunjukkan titik didih. Grafik menunjukkan bahwa semakin kuat ikatan hidrogen, semakin tinggi titik didihnya.]
Grafik menunjukkan bahwa titik didih meningkat secara linear dengan meningkatnya kekuatan ikatan hidrogen. Hal ini menunjukkan bahwa ikatan hidrogen merupakan faktor utama yang menentukan titik didih suatu senyawa.
Peranan Ikatan Hidrogen dalam Pembentukan Struktur Molekul: Contoh Soal Ikatan Hidrogen
Ikatan hidrogen merupakan salah satu jenis ikatan antarmolekul yang berperan penting dalam pembentukan struktur molekul. Ikatan ini terbentuk ketika atom hidrogen terikat secara kovalen pada atom elektronegatif seperti oksigen, nitrogen, atau fluor, dan tertarik secara elektrostatis pada pasangan elektron bebas atom elektronegatif lain pada molekul tetangga. Ikatan hidrogen ini memiliki kekuatan yang lebih lemah dibandingkan dengan ikatan kovalen atau ikatan ion, namun kekuatannya cukup signifikan untuk memengaruhi sifat fisik dan kimia suatu zat.
Peranan Ikatan Hidrogen dalam Pembentukan Struktur Molekul
Ikatan hidrogen berperan penting dalam pembentukan struktur molekul dengan cara:
- Menghubungkan molekul-molekul: Ikatan hidrogen dapat menghubungkan molekul-molekul dengan membentuk jaringan tiga dimensi yang kuat. Hal ini penting dalam menentukan sifat fisik zat, seperti titik didih dan titik leleh. Sebagai contoh, air memiliki titik didih yang tinggi karena ikatan hidrogen yang kuat antarmolekul air.
- Menstabilkan struktur molekul: Ikatan hidrogen dapat membantu menstabilkan struktur molekul dengan membentuk konformasi yang lebih stabil. Contohnya, ikatan hidrogen berperan dalam pembentukan struktur protein dan asam nukleat.
- Memengaruhi reaktivitas molekul: Ikatan hidrogen dapat memengaruhi reaktivitas molekul dengan membentuk interaksi spesifik dengan molekul lain. Sebagai contoh, ikatan hidrogen berperan dalam reaksi enzimatik.
Contoh Struktur Molekul yang Dibuat oleh Ikatan Hidrogen, Contoh soal ikatan hidrogen
Beberapa contoh struktur molekul yang dibentuk oleh ikatan hidrogen adalah:
- Air (H2O): Molekul air memiliki dua atom hidrogen yang terikat pada satu atom oksigen. Atom oksigen memiliki dua pasang elektron bebas, yang dapat membentuk ikatan hidrogen dengan atom hidrogen dari molekul air lain. Ikatan hidrogen antarmolekul air ini bertanggung jawab atas sifat air yang unik, seperti titik didih yang tinggi, tegangan permukaan yang tinggi, dan kemampuannya untuk melarutkan banyak zat.
- Amonia (NH3): Molekul amonia memiliki satu atom nitrogen yang terikat pada tiga atom hidrogen. Atom nitrogen memiliki satu pasang elektron bebas, yang dapat membentuk ikatan hidrogen dengan atom hidrogen dari molekul amonia lain. Ikatan hidrogen antarmolekul amonia ini bertanggung jawab atas sifat amonia yang mudah menguap.
- DNA (Deoxyribonucleic Acid): DNA adalah molekul kompleks yang menyimpan informasi genetik. Struktur DNA terdiri dari dua rantai polinukleotida yang saling berpilin. Dua rantai ini dihubungkan oleh ikatan hidrogen antara basa nitrogen pada setiap rantai. Ikatan hidrogen ini membantu menjaga struktur DNA tetap stabil.
Model 3D Struktur Molekul yang Dibuat oleh Ikatan Hidrogen
Model 3D struktur molekul yang dibentuk oleh ikatan hidrogen dapat dibuat dengan menggunakan perangkat lunak pemodelan molekul. Model ini dapat membantu memvisualisasikan interaksi antarmolekul yang terjadi karena ikatan hidrogen. Dalam model ini, atom hidrogen yang terlibat dalam ikatan hidrogen akan ditampilkan dengan warna merah, dan atom elektronegatif yang terlibat dalam ikatan hidrogen akan ditampilkan dengan warna biru. Garis putus-putus dapat digunakan untuk menunjukkan ikatan hidrogen.
Sebagai contoh, model 3D air akan menunjukkan dua atom hidrogen yang terikat pada satu atom oksigen, dengan dua garis putus-putus yang menunjukkan ikatan hidrogen antara atom hidrogen dari satu molekul air dengan atom oksigen dari molekul air lain.
Aplikasi Ikatan Hidrogen dalam Bidang Industri

Ikatan hidrogen, sebuah interaksi antarmolekul yang kuat, memainkan peran penting dalam berbagai proses industri. Ikatan ini bertanggung jawab atas sifat unik beberapa bahan, memungkinkan pengembangan teknologi dan produk yang inovatif. Ikatan hidrogen dapat ditemukan dalam berbagai aplikasi, mulai dari pembuatan bahan kimia hingga pengembangan obat-obatan.
Aplikasi Ikatan Hidrogen dalam Bidang Industri
Ikatan hidrogen memiliki peran penting dalam berbagai industri. Berikut adalah beberapa contoh aplikasi ikatan hidrogen dalam bidang industri:
- Industri Kimia: Ikatan hidrogen berperan dalam sintesis dan produksi berbagai bahan kimia. Contohnya, dalam produksi polimer, ikatan hidrogen membantu dalam pembentukan rantai polimer yang panjang, memberikan kekuatan dan ketahanan pada bahan tersebut. Selain itu, ikatan hidrogen juga penting dalam proses pemisahan dan pemurnian bahan kimia.
- Industri Farmasi: Ikatan hidrogen berperan penting dalam pengembangan dan produksi obat-obatan. Ikatan hidrogen membantu dalam pembentukan struktur molekul obat, yang menentukan aktivitas biologisnya. Contohnya, ikatan hidrogen memainkan peran kunci dalam interaksi obat dengan target molekul dalam tubuh, seperti enzim atau reseptor.
- Industri Pangan: Ikatan hidrogen berperan dalam struktur dan sifat makanan. Contohnya, ikatan hidrogen membantu dalam pembentukan gel dan emulsi, yang memberikan tekstur dan konsistensi pada makanan. Ikatan hidrogen juga penting dalam proses pengolahan makanan, seperti pemanasan dan pendinginan.
- Industri Tekstil: Ikatan hidrogen berperan dalam pembuatan dan sifat kain. Contohnya, serat alami seperti kapas dan wol mengandung banyak ikatan hidrogen, yang memberikan kekuatan dan kelembutan pada kain. Ikatan hidrogen juga berperan dalam proses pewarnaan kain.
- Industri Kosmetik: Ikatan hidrogen berperan dalam pembuatan dan sifat produk kosmetik. Contohnya, ikatan hidrogen membantu dalam pembentukan emulsi dan gel, yang memberikan tekstur dan konsistensi pada produk kosmetik. Ikatan hidrogen juga penting dalam proses stabilisasi dan penyimpanan produk kosmetik.
Contoh Produk yang Dihasilkan dengan Memanfaatkan Ikatan Hidrogen
Berikut adalah beberapa contoh produk yang dihasilkan dengan memanfaatkan ikatan hidrogen:
- Polietilen: Polietilen adalah polimer yang digunakan dalam berbagai aplikasi, seperti kantong plastik, botol, dan film. Ikatan hidrogen membantu dalam pembentukan rantai polimer yang panjang, memberikan kekuatan dan ketahanan pada bahan tersebut.
- Nylon: Nylon adalah polimer yang digunakan dalam berbagai aplikasi, seperti pakaian, karpet, dan tali. Ikatan hidrogen membantu dalam pembentukan rantai polimer yang panjang, memberikan kekuatan dan ketahanan pada bahan tersebut.
- Aspirin: Aspirin adalah obat yang digunakan untuk meredakan nyeri dan demam. Ikatan hidrogen membantu dalam pembentukan struktur molekul aspirin, yang menentukan aktivitas biologisnya.
- Gelatin: Gelatin adalah protein yang digunakan dalam berbagai aplikasi, seperti makanan, kosmetik, dan farmasi. Ikatan hidrogen membantu dalam pembentukan gel, yang memberikan tekstur dan konsistensi pada produk tersebut.
- Sabun: Sabun adalah surfaktan yang digunakan untuk membersihkan. Ikatan hidrogen membantu dalam pembentukan misel, yang memungkinkan sabun untuk membersihkan kotoran dan minyak.
Daftar Aplikasi Ikatan Hidrogen dalam Bidang Industri
| No | Aplikasi | Industri | Contoh Produk |
|---|---|---|---|
| 1 | Sintesis polimer | Kimia | Polietilen, Nylon |
| 2 | Pemisahan dan pemurnian bahan kimia | Kimia | Etanol, Metanol |
| 3 | Pengembangan dan produksi obat-obatan | Farmasi | Aspirin, Paracetamol |
| 4 | Pembentukan gel dan emulsi | Pangan | Yogurt, Mayones |
| 5 | Pembuatan dan sifat kain | Tekstil | Kapas, Wol |
| 6 | Pembuatan dan sifat produk kosmetik | Kosmetik | Krim, Lotion |
Kesimpulan Akhir
Melalui contoh soal ikatan hidrogen, kita telah menjelajahi berbagai aspek penting dari ikatan ini, mulai dari pengertian hingga penerapannya dalam kehidupan sehari-hari. Ikatan hidrogen, dengan kekuatannya yang unik, memberikan kontribusi besar dalam membentuk sifat fisik dan kimia suatu senyawa. Semoga contoh soal ini membantu Anda memahami dan mengapresiasi pentingnya ikatan hidrogen dalam dunia kimia dan kehidupan.