Pernahkah kamu bertanya-tanya bagaimana besi bisa berkarat atau bagaimana baterai bisa menghasilkan listrik? Jawabannya terletak pada reaksi kimia yang menarik bernama oksidasi dan reduksi. Contoh Soal Oksidasi dan Reduksi Beserta Jawabannya akan membantumu memahami konsep-konsep dasar ini dengan lebih baik, dan menunjukkan bagaimana reaksi-reaksi ini berperan penting dalam kehidupan sehari-hari.
Melalui contoh soal dan pembahasan yang lengkap, kamu akan belajar cara menentukan bilangan oksidasi, mengidentifikasi jenis-jenis reaksi redoks, dan melihat bagaimana reaksi redoks diterapkan dalam berbagai bidang seperti pembakaran, korosi, dan pembuatan baterai. Siap untuk menjelajahi dunia oksidasi dan reduksi?
Pengertian Oksidasi dan Reduksi
Oksidasi dan reduksi merupakan dua proses kimia yang selalu terjadi secara berpasangan dalam suatu reaksi kimia. Kedua proses ini sangat penting dalam berbagai bidang, seperti pembakaran, fotosintesis, dan reaksi redoks dalam sel elektrokimia. Untuk memahami lebih lanjut tentang oksidasi dan reduksi, mari kita bahas definisi, contoh, dan ciri-cirinya.
Definisi Oksidasi dan Reduksi
Oksidasi dan reduksi merupakan dua proses yang saling terkait dan terjadi bersamaan dalam suatu reaksi kimia. Secara sederhana, oksidasi adalah proses pelepasan elektron, sedangkan reduksi adalah proses penerimaan elektron. Berikut penjelasan lebih detailnya:
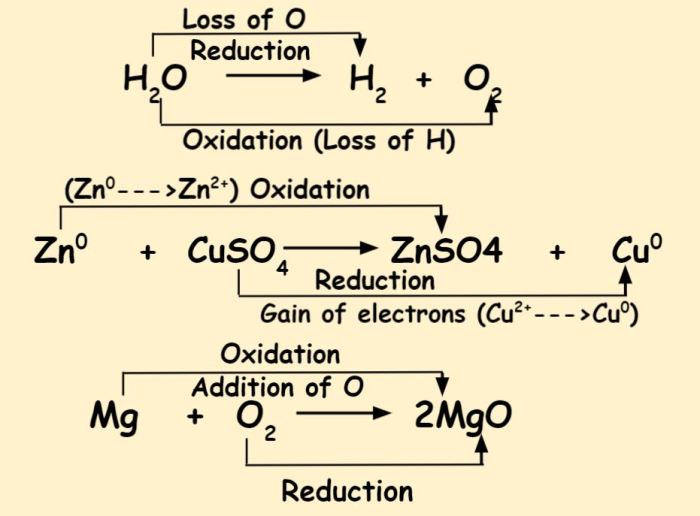
- Oksidasi: Oksidasi adalah proses kimia yang melibatkan pelepasan elektron oleh suatu atom, ion, atau molekul. Proses ini ditandai dengan peningkatan bilangan oksidasi atom yang terlibat. Atom yang mengalami oksidasi disebut sebagai reduktor atau zat pereduksi.
- Reduksi: Reduksi adalah proses kimia yang melibatkan penerimaan elektron oleh suatu atom, ion, atau molekul. Proses ini ditandai dengan penurunan bilangan oksidasi atom yang terlibat. Atom yang mengalami reduksi disebut sebagai oksidator atau zat pengoksidasi.
Contoh Reaksi Oksidasi dan Reduksi
Untuk memahami lebih lanjut tentang oksidasi dan reduksi, berikut beberapa contoh reaksi yang melibatkan kedua proses ini:
- Pembakaran: Reaksi pembakaran kayu merupakan contoh klasik reaksi oksidasi. Kayu (C) bereaksi dengan oksigen (O2) menghasilkan karbon dioksida (CO2) dan air (H2O). Dalam reaksi ini, karbon mengalami oksidasi karena melepaskan elektron dan bilangan oksidasinya meningkat dari 0 menjadi +4, sementara oksigen mengalami reduksi karena menerima elektron dan bilangan oksidasinya menurun dari 0 menjadi -2.
C + O2 → CO2
- Reaksi antara logam dengan asam: Reaksi antara logam seng (Zn) dengan asam klorida (HCl) menghasilkan gas hidrogen (H2) dan larutan seng klorida (ZnCl2). Dalam reaksi ini, seng mengalami oksidasi karena melepaskan elektron dan bilangan oksidasinya meningkat dari 0 menjadi +2, sementara hidrogen mengalami reduksi karena menerima elektron dan bilangan oksidasinya menurun dari +1 menjadi 0.
Zn + 2HCl → ZnCl2 + H2
Ciri-ciri Reaksi Oksidasi dan Reduksi
Untuk membedakan antara reaksi oksidasi dan reduksi, berikut tabel yang merangkum ciri-ciri masing-masing reaksi:
| Ciri | Oksidasi | Reduksi |
|---|---|---|
| Perubahan Bilangan Oksidasi | Meningkat | Menurun |
| Perubahan Jumlah Elektron | Pelepasan Elektron | Penerimaan Elektron |
| Zat yang Bereaksi | Reduktor | Oksidator |
| Perubahan Sifat | Zat yang teroksidasi menjadi lebih positif | Zat yang tereduksi menjadi lebih negatif |
Bilangan Oksidasi: Contoh Soal Oksidasi Dan Reduksi Beserta Jawabannya
Bilangan oksidasi merupakan konsep penting dalam kimia yang menunjukkan tingkat oksidasi suatu atom dalam senyawa. Konsep ini membantu kita memahami bagaimana elektron ditransfer atau dibagikan antara atom dalam suatu reaksi kimia.
Cara Menentukan Bilangan Oksidasi
Bilangan oksidasi suatu atom dalam senyawa dapat ditentukan dengan mengikuti beberapa aturan dasar:
- Bilangan oksidasi unsur bebas adalah 0.
- Bilangan oksidasi ion monoatomik sama dengan muatannya.
- Bilangan oksidasi hidrogen dalam senyawa biasanya +1, kecuali dalam hidrida logam (misalnya, NaH), di mana bilangan oksidasinya -1.
- Bilangan oksidasi oksigen dalam senyawa biasanya -2, kecuali dalam peroksida (misalnya, H2O2), di mana bilangan oksidasinya -1, dan dalam senyawa dengan fluor (misalnya, OF2), di mana bilangan oksidasinya +2.
- Jumlah bilangan oksidasi semua atom dalam suatu senyawa harus sama dengan nol.
- Jumlah bilangan oksidasi semua atom dalam suatu ion poliatomik harus sama dengan muatan ion tersebut.
Contoh Perhitungan Bilangan Oksidasi
Sebagai contoh, mari kita tentukan bilangan oksidasi sulfur dalam asam sulfat (H2SO4).
- Bilangan oksidasi hidrogen adalah +1, dan terdapat dua atom hidrogen, sehingga total bilangan oksidasinya adalah +2.
- Bilangan oksidasi oksigen adalah -2, dan terdapat empat atom oksigen, sehingga total bilangan oksidasinya adalah -8.
- Jumlah bilangan oksidasi semua atom dalam asam sulfat harus sama dengan nol. Oleh karena itu, bilangan oksidasi sulfur adalah +6.
Bilangan Oksidasi Umum
Berikut tabel yang menunjukkan bilangan oksidasi umum untuk beberapa unsur:
| Unsur | Bilangan Oksidasi Umum |
|---|---|
| Li, Na, K, Rb, Cs | +1 |
| Be, Mg, Ca, Sr, Ba | +2 |
| B | +3 |
| C | -4, +2, +4 |
| N | -3, -2, +1, +2, +3, +4, +5 |
| O | -2, -1 |
| F | -1 |
| Cl | -1, +1, +3, +5, +7 |
| Br | -1, +1, +3, +5, +7 |
| I | -1, +1, +3, +5, +7 |
| S | -2, +2, +4, +6 |
| P | -3, +3, +5 |
Penerapan Oksidasi dan Reduksi dalam Kehidupan Sehari-hari
Oksidasi dan reduksi, atau yang lebih dikenal dengan reaksi redoks, merupakan proses kimia yang melibatkan perpindahan elektron. Konsep ini tidak hanya penting dalam kimia, tetapi juga berperan penting dalam berbagai aspek kehidupan sehari-hari. Reaksi redoks terjadi di sekitar kita, mulai dari pembakaran bahan bakar hingga proses korosi logam.
Pembakaran Bahan Bakar
Proses pembakaran bahan bakar merupakan contoh klasik dari reaksi redoks. Ketika kita membakar kayu, gas alam, atau bahan bakar lainnya, bahan bakar tersebut mengalami oksidasi, yaitu kehilangan elektron.
- Oksigen dari udara berperan sebagai oksidator, menerima elektron dari bahan bakar.
- Reaksi ini menghasilkan energi dalam bentuk panas dan cahaya, yang kita manfaatkan untuk berbagai keperluan.
Korosi Logam
Korosi logam merupakan proses kerusakan logam akibat reaksi redoks.
- Logam seperti besi (Fe) akan teroksidasi saat terpapar air dan oksigen.
- Atom besi kehilangan elektron dan membentuk ion besi (Fe2+) yang kemudian bereaksi dengan oksigen membentuk karat (Fe2O3·xH2O).
- Korosi dapat dicegah dengan melapisi logam dengan cat, pelumas, atau dengan metode galvanisasi, yaitu melapisi logam dengan logam lain yang lebih tahan korosi.
Penerapan Reaksi Redoks dalam Industri
Reaksi redoks memiliki peran penting dalam berbagai proses industri, seperti pembuatan baterai dan sel elektrokimia.
- Baterai memanfaatkan reaksi redoks untuk menghasilkan energi listrik.
- Contohnya, baterai lithium-ion, yang banyak digunakan pada perangkat elektronik, memanfaatkan reaksi redoks antara lithium dan ion lithium.
- Sel elektrokimia, seperti sel bahan bakar, menggunakan reaksi redoks untuk menghasilkan energi listrik dari bahan bakar seperti hidrogen.
Kunci Jawaban Soal
Berikut ini adalah kunci jawaban untuk semua soal latihan yang telah dibuat. Setiap jawaban akan disertai dengan penjelasan langkah demi langkah untuk membantu kamu memahami konsep oksidasi dan reduksi dengan lebih baik.
Soal 1: Menentukan Bilangan Oksidasi
Soal ini bertujuan untuk menguji kemampuan kamu dalam menentukan bilangan oksidasi atom dalam suatu senyawa. Untuk menyelesaikannya, kamu perlu memahami aturan-aturan penentuan bilangan oksidasi yang telah dipelajari sebelumnya.
- Jawaban:
- Penjelasan:
Soal 2: Mengidentifikasi Reaksi Oksidasi dan Reduksi
Soal ini menguji kemampuan kamu dalam mengidentifikasi reaksi oksidasi dan reduksi berdasarkan perubahan bilangan oksidasi atom-atom yang terlibat. Untuk menjawab soal ini, kamu perlu memahami definisi oksidasi dan reduksi, serta mampu menentukan perubahan bilangan oksidasi.
- Jawaban:
- Penjelasan:
Soal 3: Menentukan Zat yang Bersifat Oksidator dan Reduktor
Soal ini menguji pemahaman kamu tentang peran zat oksidator dan reduktor dalam suatu reaksi redoks. Zat oksidator adalah zat yang menyebabkan oksidasi, sedangkan zat reduktor menyebabkan reduksi. Untuk menjawab soal ini, kamu perlu mengidentifikasi zat yang mengalami peningkatan bilangan oksidasi (oksidasi) dan zat yang mengalami penurunan bilangan oksidasi (reduksi).
- Jawaban:
- Penjelasan:
Soal 4: Menyeimbangkan Reaksi Redoks
Soal ini menguji kemampuan kamu dalam menyeimbangkan reaksi redoks dengan metode setengah reaksi. Metode ini melibatkan pemisahan reaksi redoks menjadi dua setengah reaksi, yaitu setengah reaksi oksidasi dan setengah reaksi reduksi. Kemudian, kedua setengah reaksi tersebut disetarakan secara terpisah, baik dalam hal jumlah atom maupun jumlah muatan. Setelah itu, kedua setengah reaksi digabungkan kembali untuk menghasilkan reaksi redoks yang setara.
- Jawaban:
- Penjelasan:
Soal 5: Penerapan Konsep Redoks dalam Kehidupan Sehari-hari
Soal ini menguji kemampuan kamu dalam menghubungkan konsep redoks dengan fenomena yang terjadi dalam kehidupan sehari-hari. Contohnya, reaksi pembakaran, korosi, dan baterai adalah beberapa contoh penerapan konsep redoks dalam kehidupan sehari-hari. Untuk menjawab soal ini, kamu perlu memahami prinsip dasar reaksi redoks dan mampu mengaitkannya dengan fenomena yang diamati.
- Jawaban:
- Penjelasan:
Contoh Soal Oksidasi dan Reduksi
Setelah memahami konsep oksidasi dan reduksi, mari kita latihan dengan beberapa contoh soal. Soal-soal ini akan menguji pemahamanmu tentang reaksi oksidasi-reduksi dalam berbagai konteks, seperti pembakaran, disproporsionasi, dan elektrokimia.
Contoh Soal Oksidasi dan Reduksi dalam Reaksi Pembakaran
Reaksi pembakaran adalah reaksi kimia yang melibatkan reaksi cepat antara suatu zat dengan oksidator, biasanya oksigen, untuk menghasilkan panas dan cahaya. Dalam reaksi pembakaran, zat yang terbakar mengalami oksidasi, sementara oksigen mengalami reduksi.
-
Contoh soal: Dalam pembakaran metana (CH4), metana terbakar dengan oksigen (O2) menghasilkan karbon dioksida (CO2) dan air (H2O). Tentukan zat yang mengalami oksidasi dan zat yang mengalami reduksi dalam reaksi ini.
-
Penyelesaian: Dalam reaksi ini, karbon dalam metana (CH4) mengalami oksidasi karena bilangan oksidasinya berubah dari -4 menjadi +4 dalam karbon dioksida (CO2). Sementara itu, oksigen dalam oksigen (O2) mengalami reduksi karena bilangan oksidasinya berubah dari 0 menjadi -2 dalam air (H2O).
Contoh Soal Oksidasi dan Reduksi dalam Reaksi Disproporsionasi
Reaksi disproporsionasi adalah reaksi redoks di mana suatu zat mengalami oksidasi dan reduksi secara bersamaan. Dalam reaksi ini, atom-atom dari suatu unsur dalam senyawa mengalami perubahan bilangan oksidasi, baik naik (oksidasi) maupun turun (reduksi).
Contoh soal oksidasi dan reduksi beserta jawabannya memang sering jadi PR buat para siswa, ya. Nah, kalau kamu lagi belajar tentang konsep kimia ini, coba deh cek contoh soal iklan di sini. Soalnya, memahami cara iklan bekerja juga melibatkan konsep serupa.
Misalnya, bagaimana iklan bisa “menarik” konsumen, atau “mengurangi” rasa ragu mereka. Keren kan, ternyata belajar kimia bisa dihubungkan dengan kehidupan sehari-hari!
-
Contoh soal: Reaksi disproporsionasi hidrogen peroksida (H2O2) menghasilkan air (H2O) dan oksigen (O2). Tentukan zat yang mengalami oksidasi dan zat yang mengalami reduksi dalam reaksi ini.
-
Penyelesaian: Dalam reaksi ini, hidrogen peroksida (H2O2) mengalami oksidasi dan reduksi secara bersamaan. Atom oksigen dalam H2O2 dengan bilangan oksidasi -1, sebagian mengalami oksidasi menjadi O2 dengan bilangan oksidasi 0, dan sebagian lagi mengalami reduksi menjadi H2O dengan bilangan oksidasi -2.
Contoh Soal Oksidasi dan Reduksi dalam Reaksi Elektrokimia
Reaksi elektrokimia adalah reaksi redoks yang melibatkan perpindahan elektron melalui antarmuka antara elektroda dan larutan elektrolit. Dalam reaksi elektrokimia, oksidasi terjadi di anoda, sedangkan reduksi terjadi di katoda.
-
Contoh soal: Dalam sel elektrokimia yang terdiri dari elektroda seng (Zn) dan elektroda tembaga (Cu) yang dicelupkan ke dalam larutan ZnSO4 dan CuSO4, terjadi reaksi redoks. Tentukan zat yang mengalami oksidasi dan zat yang mengalami reduksi.
-
Penyelesaian: Dalam sel elektrokimia ini, seng (Zn) mengalami oksidasi karena melepaskan elektron dan berubah menjadi ion Zn2+. Elektron yang dilepaskan mengalir melalui rangkaian eksternal menuju katoda dan kemudian diterima oleh ion Cu2+ dalam larutan CuSO4. Ion Cu2+ mengalami reduksi dan berubah menjadi tembaga (Cu) yang menempel pada elektroda tembaga.
Penyelesaian Soal Oksidasi dan Reduksi
Setelah memahami konsep dasar oksidasi dan reduksi, langkah selanjutnya adalah mengaplikasikannya dalam penyelesaian soal. Dalam menyelesaikan soal oksidasi dan reduksi, langkah-langkah sistematis sangat penting untuk menghindari kesalahan dan mendapatkan jawaban yang akurat.
Langkah-langkah Penyelesaian Soal Oksidasi dan Reduksi
Secara umum, penyelesaian soal oksidasi dan reduksi dapat dilakukan dengan langkah-langkah berikut:
- Identifikasi Reaktan dan Produk: Langkah pertama adalah mengidentifikasi zat-zat yang terlibat dalam reaksi, yaitu reaktan dan produk. Tuliskan persamaan reaksi kimia yang diberikan dalam soal.
- Tentukan Bilangan Oksidasi: Tentukan bilangan oksidasi setiap atom dalam reaktan dan produk. Ingat, bilangan oksidasi merupakan muatan yang dimiliki atom jika semua ikatannya bersifat ionik.
- Identifikasi Atom yang Mengalami Oksidasi dan Reduksi: Setelah mengetahui bilangan oksidasi, identifikasi atom mana yang mengalami perubahan bilangan oksidasi. Atom yang mengalami peningkatan bilangan oksidasi mengalami oksidasi, sedangkan atom yang mengalami penurunan bilangan oksidasi mengalami reduksi.
- Tuliskan Setengah Reaksi: Pisahkan reaksi keseluruhan menjadi dua setengah reaksi, yaitu setengah reaksi oksidasi dan setengah reaksi reduksi.
- Seimbangkan Setengah Reaksi: Seimbangkan setiap setengah reaksi dengan menambahkan koefisien dan ion H+ atau OH– (tergantung kondisi asam atau basa) dan molekul H2O jika diperlukan.
- Seimbangkan Jumlah Elektron: Jumlah elektron yang dilepas dalam setengah reaksi oksidasi harus sama dengan jumlah elektron yang diterima dalam setengah reaksi reduksi. Kalikan setiap setengah reaksi dengan faktor yang sesuai untuk menyamakan jumlah elektron.
- Gabungkan Setengah Reaksi: Gabungkan kedua setengah reaksi yang telah diseimbangkan.
- Sederhanakan Persamaan: Sederhanakan persamaan reaksi dengan menghilangkan spesies yang sama di kedua sisi persamaan.
Contoh Soal 1
Berikut adalah contoh soal yang akan kita selesaikan bersama:
Tentukan zat yang mengalami oksidasi dan reduksi pada reaksi berikut:
2 FeCl2(aq) + Cl2(g) → 2 FeCl3(aq)
Mari kita selesaikan soal ini dengan mengikuti langkah-langkah yang telah dijelaskan sebelumnya:
- Identifikasi Reaktan dan Produk: Reaktan dalam reaksi ini adalah FeCl2 dan Cl2, sedangkan produknya adalah FeCl3.
- Tentukan Bilangan Oksidasi: Bilangan oksidasi setiap atom dalam reaktan dan produk adalah sebagai berikut:
- Fe dalam FeCl2: +2
- Cl dalam FeCl2: -1
- Cl dalam Cl2: 0
- Fe dalam FeCl3: +3
- Cl dalam FeCl3: -1
- Identifikasi Atom yang Mengalami Oksidasi dan Reduksi: Kita dapat melihat bahwa bilangan oksidasi Fe berubah dari +2 menjadi +3, sehingga Fe mengalami oksidasi. Bilangan oksidasi Cl berubah dari 0 menjadi -1, sehingga Cl mengalami reduksi.
Contoh Soal 2
Berikut adalah contoh soal kedua:
Tuliskan setengah reaksi oksidasi dan reduksi untuk reaksi berikut:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Langkah-langkah penyelesaiannya adalah sebagai berikut:
- Identifikasi Reaktan dan Produk: Reaktan dalam reaksi ini adalah Zn dan Cu2+, sedangkan produknya adalah Zn2+ dan Cu.
- Tentukan Bilangan Oksidasi: Bilangan oksidasi setiap atom dalam reaktan dan produk adalah sebagai berikut:
- Zn(s): 0
- Cu2+(aq): +2
- Zn2+(aq): +2
- Cu(s): 0
- Identifikasi Atom yang Mengalami Oksidasi dan Reduksi: Bilangan oksidasi Zn berubah dari 0 menjadi +2, sehingga Zn mengalami oksidasi. Bilangan oksidasi Cu berubah dari +2 menjadi 0, sehingga Cu mengalami reduksi.
- Tuliskan Setengah Reaksi:
- Setengah reaksi oksidasi: Zn(s) → Zn2+(aq) + 2e–
- Setengah reaksi reduksi: Cu2+(aq) + 2e– → Cu(s)
Pembahasan Soal
Oke, sekarang mari kita bahas soal-soal oksidasi dan reduksi yang telah kita pelajari. Kita akan menganalisis konsep-konsep yang diuji dalam setiap soal, mengidentifikasi kesalahan umum yang sering dilakukan, dan memberikan tips serta strategi untuk menyelesaikan soal-soal ini dengan lebih efektif.
Konsep Oksidasi dan Reduksi
Sebelum kita membahas soal, penting untuk memahami konsep dasar oksidasi dan reduksi. Oksidasi adalah proses kehilangan elektron, yang ditandai dengan peningkatan bilangan oksidasi. Sebaliknya, reduksi adalah proses penambahan elektron, yang ditandai dengan penurunan bilangan oksidasi.
Salah satu cara mudah untuk mengingat konsep ini adalah dengan menggunakan singkatan OIL RIG. OIL berarti “Oxidation Is Loss” (Oksidasi adalah Kehilangan), sedangkan RIG berarti “Reduction Is Gain” (Reduksi adalah Penambahan).
Kesalahan Umum dalam Menyelesaikan Soal Oksidasi dan Reduksi, Contoh soal oksidasi dan reduksi beserta jawabannya
Ada beberapa kesalahan umum yang sering dilakukan siswa dalam menyelesaikan soal oksidasi dan reduksi. Berikut adalah beberapa di antaranya:
- Kesalahan dalam menentukan bilangan oksidasi.
- Kesalahan dalam mengidentifikasi zat yang mengalami oksidasi dan reduksi.
- Kesalahan dalam menuliskan persamaan reaksi redoks yang seimbang.
Tips dan Strategi untuk Menyelesaikan Soal Oksidasi dan Reduksi
Berikut adalah beberapa tips dan strategi yang dapat membantu Anda menyelesaikan soal oksidasi dan reduksi dengan lebih efektif:
- Pahami konsep dasar oksidasi dan reduksi dengan baik. Gunakan OIL RIG sebagai mnemonic untuk mengingat konsep ini.
- Pelajari aturan-aturan untuk menentukan bilangan oksidasi.
- Latihlah diri Anda dengan mengerjakan berbagai macam soal.
- Jangan takut untuk meminta bantuan jika Anda mengalami kesulitan.
Contoh Soal dan Pembahasan
Mari kita lihat contoh soal dan pembahasannya untuk lebih memahami konsep-konsep ini.
Soal 1: Tentukan bilangan oksidasi atom Mn dalam senyawa KMnO4.
Berikut adalah langkah-langkah untuk menentukan bilangan oksidasi atom Mn dalam senyawa KMnO4:
- Bilangan oksidasi K adalah +1.
- Bilangan oksidasi O adalah -2.
- Jumlah total bilangan oksidasi dalam senyawa KMnO4 adalah 0.
- Misalkan bilangan oksidasi Mn adalah x.
- Maka, persamaan bilangan oksidasi adalah: +1 + x + 4(-2) = 0
- Selesaikan persamaan tersebut, kita dapatkan x = +7.
Jadi, bilangan oksidasi atom Mn dalam senyawa KMnO4 adalah +7.
Soal 2: Identifikasi zat yang mengalami oksidasi dan reduksi dalam reaksi berikut:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Berikut adalah langkah-langkah untuk mengidentifikasi zat yang mengalami oksidasi dan reduksi:
- Tentukan bilangan oksidasi setiap atom dalam reaktan dan produk.
- Zat yang mengalami peningkatan bilangan oksidasi mengalami oksidasi.
- Zat yang mengalami penurunan bilangan oksidasi mengalami reduksi.
Dalam reaksi ini, bilangan oksidasi Zn berubah dari 0 menjadi +2, sehingga Zn mengalami oksidasi. Bilangan oksidasi Cu berubah dari +2 menjadi 0, sehingga Cu mengalami reduksi.
Soal 3: Seimbangkan persamaan reaksi redoks berikut:
MnO4–(aq) + Fe2+(aq) → Mn2+(aq) + Fe3+(aq)
Berikut adalah langkah-langkah untuk menyeimbangkan persamaan reaksi redoks:
- Tentukan setengah reaksi oksidasi dan reduksi.
- Seimbangkan atom selain H dan O dalam setiap setengah reaksi.
- Seimbangkan atom O dengan menambahkan molekul H2O.
- Seimbangkan atom H dengan menambahkan ion H+.
- Seimbangkan muatan dengan menambahkan elektron (e–).
- Kalikan kedua setengah reaksi dengan faktor yang sesuai agar jumlah elektron yang terlibat sama.
- Gabungkan kedua setengah reaksi dan sederhanakan.
Berikut adalah langkah-langkah untuk menyeimbangkan persamaan reaksi redoks di atas:
- Setengah reaksi oksidasi: Fe2+(aq) → Fe3+(aq) + e–
- Setengah reaksi reduksi: MnO4–(aq) + 8H+(aq) + 5e– → Mn2+(aq) + 4H2O(l)
- Kalikan setengah reaksi oksidasi dengan 5 dan gabungkan dengan setengah reaksi reduksi:
- Persamaan reaksi redoks yang seimbang: MnO4–(aq) + 5Fe2+(aq) + 8H+(aq) → Mn2+(aq) + 5Fe3+(aq) + 4H2O(l)
Latihan Soal Tambahan
Untuk menguji pemahaman Anda tentang konsep oksidasi dan reduksi, berikut beberapa soal latihan tambahan. Soal-soal ini dirancang untuk mengasah kemampuan Anda dalam mengidentifikasi reaksi oksidasi dan reduksi, menentukan bilangan oksidasi, dan memahami peran zat-zat dalam reaksi redoks.
Soal Latihan
Berikut adalah beberapa soal latihan tambahan untuk menguji pemahaman Anda tentang konsep oksidasi dan reduksi:
- Tentukan bilangan oksidasi atom Mn dalam senyawa KMnO4.
- Reaksi berikut merupakan reaksi redoks. Tentukan zat yang mengalami oksidasi dan zat yang mengalami reduksi:
2FeCl2 + Cl2 → 2FeCl3
- Jelaskan mengapa reaksi berikut merupakan reaksi redoks:
Zn + CuSO4 → ZnSO4 + Cu
- Tentukan bilangan oksidasi atom S dalam senyawa H2SO4.
- Reaksi berikut merupakan reaksi redoks. Tentukan zat yang mengalami oksidasi dan zat yang mengalami reduksi:
2H2S + SO2 → 3S + 2H2O
- Jelaskan mengapa reaksi berikut merupakan reaksi redoks:
2Na + Cl2 → 2NaCl
- Tentukan bilangan oksidasi atom Cr dalam senyawa K2Cr2O7.
- Reaksi berikut merupakan reaksi redoks. Tentukan zat yang mengalami oksidasi dan zat yang mengalami reduksi:
2KMnO4 + 5H2O2 + 3H2SO4 → K2SO4 + 2MnSO4 + 8H2O + 5O2
- Jelaskan mengapa reaksi berikut merupakan reaksi redoks:
CuO + H2 → Cu + H2O
- Tentukan bilangan oksidasi atom N dalam senyawa HNO3.
Kunci Jawaban
Berikut adalah kunci jawaban untuk soal-soal latihan di atas:
- Bilangan oksidasi atom Mn dalam KMnO4 adalah +7.
- Dalam reaksi 2FeCl2 + Cl2 → 2FeCl3, FeCl2 mengalami oksidasi karena bilangan oksidasi Fe berubah dari +2 menjadi +3. Cl2 mengalami reduksi karena bilangan oksidasi Cl berubah dari 0 menjadi -1.
- Reaksi Zn + CuSO4 → ZnSO4 + Cu merupakan reaksi redoks karena terjadi perpindahan elektron dari Zn ke Cu. Zn mengalami oksidasi karena bilangan oksidasinya berubah dari 0 menjadi +2. Cu mengalami reduksi karena bilangan oksidasinya berubah dari +2 menjadi 0.
- Bilangan oksidasi atom S dalam H2SO4 adalah +6.
- Dalam reaksi 2H2S + SO2 → 3S + 2H2O, H2S mengalami oksidasi karena bilangan oksidasi S berubah dari -2 menjadi 0. SO2 mengalami reduksi karena bilangan oksidasi S berubah dari +4 menjadi 0.
- Reaksi 2Na + Cl2 → 2NaCl merupakan reaksi redoks karena terjadi perpindahan elektron dari Na ke Cl. Na mengalami oksidasi karena bilangan oksidasinya berubah dari 0 menjadi +1. Cl mengalami reduksi karena bilangan oksidasinya berubah dari 0 menjadi -1.
- Bilangan oksidasi atom Cr dalam K2Cr2O7 adalah +6.
- Dalam reaksi 2KMnO4 + 5H2O2 + 3H2SO4 → K2SO4 + 2MnSO4 + 8H2O + 5O2, H2O2 mengalami oksidasi karena bilangan oksidasi O berubah dari -1 menjadi 0. KMnO4 mengalami reduksi karena bilangan oksidasi Mn berubah dari +7 menjadi +2.
- Reaksi CuO + H2 → Cu + H2O merupakan reaksi redoks karena terjadi perpindahan elektron dari H2 ke CuO. H2 mengalami oksidasi karena bilangan oksidasi H berubah dari 0 menjadi +1. CuO mengalami reduksi karena bilangan oksidasi Cu berubah dari +2 menjadi 0.
- Bilangan oksidasi atom N dalam HNO3 adalah +5.
Ringkasan Terakhir
Dengan memahami konsep oksidasi dan reduksi, kamu tidak hanya akan memahami reaksi kimia yang terjadi di sekitarmu, tetapi juga membuka pintu untuk menjelajahi bidang-bidang ilmu pengetahuan yang lebih luas. Contoh soal yang telah kita bahas menunjukkan bagaimana reaksi redoks menjadi kunci dalam berbagai proses penting, mulai dari pembakaran bahan bakar hingga pembuatan energi terbarukan. Jadi, teruslah belajar dan berlatih untuk menguasai konsep-konsep kimia yang menarik ini!