Contoh soal pereaksi pembatas – Pernahkah kamu bertanya-tanya mengapa dalam suatu reaksi kimia, salah satu reaktan habis duluan, sementara yang lain masih tersisa? Ini adalah fenomena yang menarik dan penting dalam kimia, yang dijelaskan oleh konsep pereaksi pembatas. Pereaksi pembatas adalah reaktan yang habis lebih dulu dalam reaksi kimia, menentukan jumlah produk yang dapat dihasilkan. Konsep ini sangat penting dalam berbagai bidang, mulai dari industri kimia hingga proses memasak di rumah.
Dalam artikel ini, kita akan membahas konsep pereaksi pembatas secara mendalam. Kita akan mempelajari bagaimana menentukan pereaksi pembatas, pengaruhnya terhadap hasil reaksi, dan aplikasi praktisnya dalam kehidupan sehari-hari. Siapkan dirimu untuk menyelami dunia kimia yang menarik dan memahami konsep penting yang mengatur banyak reaksi kimia di sekitar kita.
Pengertian Pereaksi Pembatas
Dalam dunia kimia, reaksi kimia merupakan proses perubahan zat yang melibatkan penataan ulang atom-atom dan molekul. Reaksi kimia melibatkan pereaksi (zat yang bereaksi) dan produk (zat yang dihasilkan). Namun, tidak semua pereaksi akan habis bereaksi secara bersamaan. Terkadang, salah satu pereaksi akan habis lebih dulu, sementara pereaksi lainnya masih tersisa. Pereaksi yang habis lebih dulu ini dikenal sebagai pereaksi pembatas.
Definisi Pereaksi Pembatas
Pereaksi pembatas adalah pereaksi yang jumlahnya menentukan berapa banyak produk yang dapat dihasilkan dalam suatu reaksi kimia. Dengan kata lain, pereaksi pembatas adalah pereaksi yang pertama kali habis terpakai dalam reaksi, sehingga menghentikan reaksi dan membatasi jumlah produk yang dihasilkan.
Ilustrasi Sederhana
Bayangkan kamu sedang membuat kue. Kamu memiliki 2 cangkir tepung, 1 cangkir gula, dan 4 butir telur. Resep kue tersebut membutuhkan 1 cangkir tepung, 1/2 cangkir gula, dan 2 butir telur. Dalam kasus ini, tepung adalah pereaksi pembatas. Karena kamu hanya memiliki 2 cangkir tepung, kamu hanya dapat membuat 2 kue, meskipun kamu memiliki gula dan telur yang cukup untuk membuat lebih banyak kue.
Perbandingan Pereaksi Pembatas dengan Pereaksi Berlebih
| Aspek | Pereaksi Pembatas | Pereaksi Berlebih |
|---|---|---|
| Definisi | Pereaksi yang habis lebih dulu dalam reaksi | Pereaksi yang masih tersisa setelah reaksi selesai |
| Pengaruh pada Jumlah Produk | Menentukan jumlah maksimum produk yang dapat dihasilkan | Tidak mempengaruhi jumlah produk yang dihasilkan |
| Contoh | Tepung dalam resep kue (contoh di atas) | Gula dan telur dalam resep kue (contoh di atas) |
Pengaruh Pereaksi Pembatas pada Hasil Reaksi
Pereaksi pembatas dalam reaksi kimia merupakan bahan yang habis duluan saat reaksi berlangsung. Jumlah pereaksi pembatas akan menentukan berapa banyak produk yang dapat dihasilkan dalam reaksi kimia.
Hubungan Pereaksi Pembatas dan Jumlah Produk
Pereaksi pembatas berperan penting dalam menentukan hasil reaksi. Jika salah satu pereaksi habis, reaksi akan berhenti, meskipun pereaksi lainnya masih tersedia.
Contoh Reaksi Kimia
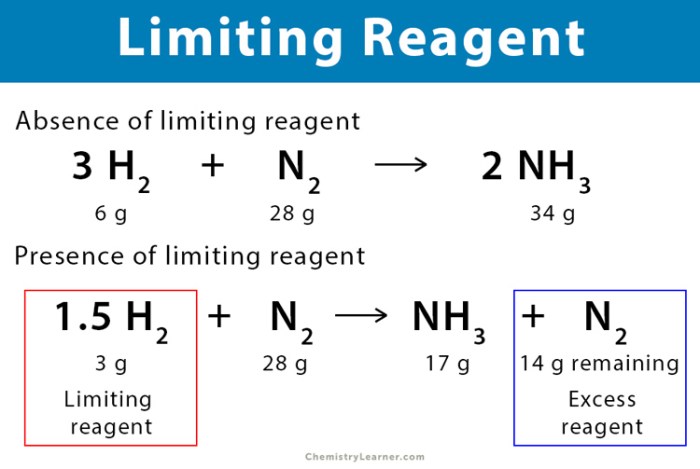
Sebagai contoh, perhatikan reaksi antara hidrogen (H2) dan oksigen (O2) untuk menghasilkan air (H2O):
2H2 + O2 → 2H2O
Dalam reaksi ini, jika kita memiliki 2 mol hidrogen dan 1 mol oksigen, maka hidrogen akan menjadi pereaksi pembatas. Ini karena 2 mol hidrogen membutuhkan 1 mol oksigen untuk bereaksi sepenuhnya. Setelah semua hidrogen habis, reaksi akan berhenti, meskipun masih ada oksigen yang tersisa.
Diagram Hubungan Pereaksi Pembatas dan Jumlah Produk
Diagram berikut menggambarkan hubungan antara jumlah pereaksi pembatas dan jumlah produk yang dihasilkan:
| Jumlah Pereaksi Pembatas | Jumlah Produk |
|---|---|
| 1 mol | 2 mol |
| 2 mol | 4 mol |
| 3 mol | 6 mol |
Dari diagram ini, terlihat bahwa jumlah produk yang dihasilkan berbanding lurus dengan jumlah pereaksi pembatas. Semakin banyak pereaksi pembatas yang digunakan, semakin banyak produk yang dihasilkan.
Kesimpulan
Pereaksi pembatas memainkan peran penting dalam menentukan hasil reaksi kimia. Jumlah pereaksi pembatas akan menentukan jumlah produk yang dihasilkan dalam reaksi. Untuk memaksimalkan hasil reaksi, penting untuk memastikan bahwa pereaksi pembatas digunakan dalam jumlah yang tepat.
Penerapan Konsep Pereaksi Pembatas
Konsep pereaksi pembatas merupakan konsep penting dalam kimia yang membantu kita memahami bagaimana reaksi kimia berlangsung dan menentukan hasil akhir reaksi. Dalam kehidupan nyata, konsep ini diterapkan di berbagai bidang, mulai dari industri kimia hingga makanan dan farmasi. Penerapan konsep pereaksi pembatas memungkinkan kita untuk mengoptimalkan proses produksi dan meminimalkan pemborosan bahan baku.
Aplikasi Konsep Pereaksi Pembatas dalam Berbagai Bidang
Pereaksi pembatas memiliki aplikasi yang luas dalam berbagai bidang, seperti:
- Industri Kimia: Dalam industri kimia, konsep pereaksi pembatas digunakan untuk menentukan jumlah optimal bahan baku yang dibutuhkan untuk menghasilkan produk tertentu. Hal ini penting untuk memaksimalkan efisiensi produksi dan meminimalkan pemborosan. Sebagai contoh, dalam pembuatan pupuk, nitrogen dan fosfor merupakan pereaksi utama. Dengan mengetahui pereaksi pembatas, produsen dapat menentukan jumlah optimal nitrogen dan fosfor yang dibutuhkan untuk menghasilkan pupuk dengan kadar nutrisi yang optimal.
- Industri Farmasi: Dalam industri farmasi, konsep pereaksi pembatas digunakan untuk memastikan dosis obat yang tepat dan konsisten. Pereaksi pembatas dapat digunakan untuk menentukan jumlah optimal bahan baku yang dibutuhkan untuk menghasilkan dosis obat yang tepat. Sebagai contoh, dalam pembuatan tablet, pereaksi pembatas dapat digunakan untuk menentukan jumlah optimal bahan pengisi yang dibutuhkan untuk memastikan dosis obat yang tepat dalam setiap tablet.
- Industri Makanan: Dalam industri makanan, konsep pereaksi pembatas digunakan untuk menentukan jumlah optimal bahan baku yang dibutuhkan untuk menghasilkan produk makanan tertentu. Hal ini penting untuk memastikan kualitas dan rasa produk yang konsisten. Sebagai contoh, dalam pembuatan roti, tepung dan ragi merupakan pereaksi utama. Dengan mengetahui pereaksi pembatas, produsen dapat menentukan jumlah optimal tepung dan ragi yang dibutuhkan untuk menghasilkan roti dengan tekstur dan rasa yang diinginkan.
Peran Pereaksi Pembatas dalam Perencanaan dan Optimasi Proses Produksi, Contoh soal pereaksi pembatas
Pereaksi pembatas memainkan peran penting dalam perencanaan dan optimasi proses produksi dengan membantu kita untuk:
- Menentukan jumlah optimal bahan baku yang dibutuhkan: Dengan mengetahui pereaksi pembatas, kita dapat menentukan jumlah optimal bahan baku yang dibutuhkan untuk menghasilkan produk tertentu. Hal ini penting untuk memaksimalkan efisiensi produksi dan meminimalkan pemborosan.
- Memprediksi hasil reaksi: Pereaksi pembatas dapat digunakan untuk memprediksi hasil reaksi, yaitu jumlah produk yang akan dihasilkan dari reaksi tertentu. Hal ini penting untuk memastikan bahwa kita dapat menghasilkan jumlah produk yang diinginkan.
- Mengoptimalkan proses produksi: Dengan memahami konsep pereaksi pembatas, kita dapat mengoptimalkan proses produksi dengan meminimalkan pemborosan bahan baku dan memaksimalkan hasil produk. Hal ini dapat dicapai dengan menyesuaikan jumlah bahan baku yang digunakan dan kondisi reaksi.
Contoh Kasus Penerapan Pereaksi Pembatas
Berikut adalah beberapa contoh kasus di mana pereaksi pembatas memainkan peran penting dalam menentukan hasil reaksi:
- Sintesis Amonia: Dalam sintesis amonia (NH3) dari nitrogen (N2) dan hidrogen (H2), nitrogen merupakan pereaksi pembatas. Hal ini karena jumlah nitrogen yang tersedia lebih sedikit daripada jumlah hidrogen yang dibutuhkan untuk bereaksi sempurna. Akibatnya, jumlah amonia yang dihasilkan akan dibatasi oleh jumlah nitrogen yang tersedia.
- Pembuatan Asam Sulfat: Dalam pembuatan asam sulfat (H2SO4) dari sulfur dioksida (SO2) dan oksigen (O2), sulfur dioksida merupakan pereaksi pembatas. Hal ini karena jumlah sulfur dioksida yang tersedia lebih sedikit daripada jumlah oksigen yang dibutuhkan untuk bereaksi sempurna. Akibatnya, jumlah asam sulfat yang dihasilkan akan dibatasi oleh jumlah sulfur dioksida yang tersedia.
- Pembuatan Plastik: Dalam pembuatan plastik, monomer merupakan pereaksi pembatas. Hal ini karena jumlah monomer yang tersedia lebih sedikit daripada jumlah katalis yang dibutuhkan untuk bereaksi sempurna. Akibatnya, jumlah plastik yang dihasilkan akan dibatasi oleh jumlah monomer yang tersedia.
Soal Latihan Pereaksi Pembatas
Pereaksi pembatas merupakan salah satu konsep penting dalam kimia yang perlu dipahami dengan baik. Konsep ini membantu kita menentukan pereaksi yang habis lebih dulu dalam reaksi kimia dan menghitung jumlah produk yang dapat dihasilkan. Dalam soal-soal berikut, kita akan mempraktikkan konsep pereaksi pembatas dengan berbagai tingkat kesulitan.
Soal Latihan 1: Tingkat Kesulitan Rendah
Berikut adalah soal latihan pertama tentang pereaksi pembatas dengan tingkat kesulitan rendah:
Jika 10 gram kalsium karbonat (CaCO3) direaksikan dengan 10 gram asam klorida (HCl) sesuai reaksi berikut:
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)
Tentukan pereaksi pembatas dan hitung massa kalsium klorida (CaCl2) yang dihasilkan!
- Hitung mol setiap pereaksi:
- Mol CaCO3 = (10 gram) / (100,09 gram/mol) = 0,1 mol
- Mol HCl = (10 gram) / (36,46 gram/mol) = 0,27 mol
- Tentukan pereaksi pembatas:
- Perbandingan mol CaCO3 dan HCl dalam reaksi adalah 1:2. Artinya, 1 mol CaCO3 membutuhkan 2 mol HCl untuk bereaksi.
- Pada soal ini, terdapat 0,1 mol CaCO3 yang hanya membutuhkan 0,2 mol HCl (0,1 mol x 2). Namun, tersedia 0,27 mol HCl. Ini berarti HCl lebih banyak dari yang dibutuhkan.
- Oleh karena itu, CaCO3 merupakan pereaksi pembatas, karena akan habis lebih dulu dalam reaksi.
- Hitung massa CaCl2 yang dihasilkan:
- Berdasarkan perbandingan mol dalam reaksi, 1 mol CaCO3 menghasilkan 1 mol CaCl2.
- Karena tersedia 0,1 mol CaCO3, maka akan dihasilkan 0,1 mol CaCl2.
- Massa CaCl2 = (0,1 mol) x (110,98 gram/mol) = 11,098 gram.
Kunci Jawaban: Pereaksi pembatas adalah CaCO3, dan massa CaCl2 yang dihasilkan adalah 11,098 gram.
Soal Latihan 2: Tingkat Kesulitan Sedang
Berikut adalah soal latihan kedua tentang pereaksi pembatas dengan tingkat kesulitan sedang:
20 gram magnesium (Mg) direaksikan dengan 25 gram oksigen (O2) sesuai reaksi berikut:
2Mg(s) + O2(g) → 2MgO(s)
Tentukan pereaksi pembatas dan hitung massa magnesium oksida (MgO) yang dihasilkan!
- Hitung mol setiap pereaksi:
- Mol Mg = (20 gram) / (24,31 gram/mol) = 0,82 mol
- Mol O2 = (25 gram) / (32 gram/mol) = 0,78 mol
- Tentukan pereaksi pembatas:
- Perbandingan mol Mg dan O2 dalam reaksi adalah 2:1. Artinya, 2 mol Mg membutuhkan 1 mol O2 untuk bereaksi.
- Pada soal ini, terdapat 0,82 mol Mg yang membutuhkan 0,41 mol O2 (0,82 mol / 2). Namun, tersedia 0,78 mol O2.
- Ini berarti O2 lebih banyak dari yang dibutuhkan. Oleh karena itu, Mg merupakan pereaksi pembatas, karena akan habis lebih dulu dalam reaksi.
- Hitung massa MgO yang dihasilkan:
- Berdasarkan perbandingan mol dalam reaksi, 2 mol Mg menghasilkan 2 mol MgO.
- Karena tersedia 0,82 mol Mg, maka akan dihasilkan 0,82 mol MgO.
- Massa MgO = (0,82 mol) x (40,30 gram/mol) = 33,04 gram.
Kunci Jawaban: Pereaksi pembatas adalah Mg, dan massa MgO yang dihasilkan adalah 33,04 gram.
Soal Latihan 3: Tingkat Kesulitan Tinggi
Berikut adalah soal latihan ketiga tentang pereaksi pembatas dengan tingkat kesulitan tinggi:
100 gram amonium nitrat (NH4NO3) direaksikan dengan 100 gram natrium hidroksida (NaOH) sesuai reaksi berikut:
NH4NO3(aq) + NaOH(aq) → NaNO3(aq) + H2O(l) + NH3(g)
Tentukan pereaksi pembatas dan hitung volume gas amonia (NH3) yang dihasilkan pada STP!
- Hitung mol setiap pereaksi:
- Mol NH4NO3 = (100 gram) / (80,04 gram/mol) = 1,25 mol
- Mol NaOH = (100 gram) / (40 gram/mol) = 2,5 mol
- Tentukan pereaksi pembatas:
- Perbandingan mol NH4NO3 dan NaOH dalam reaksi adalah 1:1. Artinya, 1 mol NH4NO3 membutuhkan 1 mol NaOH untuk bereaksi.
- Pada soal ini, terdapat 1,25 mol NH4NO3 yang membutuhkan 1,25 mol NaOH untuk bereaksi. Namun, tersedia 2,5 mol NaOH.
- Ini berarti NaOH lebih banyak dari yang dibutuhkan. Oleh karena itu, NH4NO3 merupakan pereaksi pembatas, karena akan habis lebih dulu dalam reaksi.
- Hitung volume NH3 yang dihasilkan:
- Berdasarkan perbandingan mol dalam reaksi, 1 mol NH4NO3 menghasilkan 1 mol NH3.
- Karena tersedia 1,25 mol NH4NO3, maka akan dihasilkan 1,25 mol NH3.
- Pada STP, 1 mol gas memiliki volume 22,4 liter. Oleh karena itu, volume NH3 yang dihasilkan = (1,25 mol) x (22,4 liter/mol) = 28 liter.
Kunci Jawaban: Pereaksi pembatas adalah NH4NO3, dan volume NH3 yang dihasilkan pada STP adalah 28 liter.
Perbedaan Pereaksi Pembatas dan Pereaksi Berlebih
Dalam reaksi kimia, pereaksi pembatas dan pereaksi berlebih berperan penting dalam menentukan hasil reaksi. Pereaksi pembatas adalah pereaksi yang habis terlebih dahulu selama reaksi, sehingga menentukan jumlah produk yang dapat terbentuk. Sementara pereaksi berlebih adalah pereaksi yang tersisa setelah reaksi selesai.
Perbedaan Pereaksi Pembatas dan Pereaksi Berlebih
Berikut tabel yang membandingkan karakteristik pereaksi pembatas dan pereaksi berlebih:
| Karakteristik | Pereaksi Pembatas | Pereaksi Berlebih |
|---|---|---|
| Peran dalam Reaksi | Menentukan jumlah produk yang terbentuk | Tersisa setelah reaksi selesai |
| Jumlah | Habis seluruhnya selama reaksi | Masih ada sisa setelah reaksi |
| Pengaruh terhadap Hasil Reaksi | Menentukan hasil reaksi | Tidak mempengaruhi hasil reaksi |
Fungsi dan Peran dalam Reaksi Kimia
Pereaksi pembatas memiliki fungsi utama untuk menentukan jumlah produk yang dapat terbentuk dalam reaksi kimia. Pereaksi pembatas habis seluruhnya selama reaksi, sehingga tidak ada lagi pereaksi yang tersedia untuk bereaksi lebih lanjut. Hal ini mengakibatkan reaksi berhenti dan produk maksimum yang dapat dihasilkan ditentukan oleh jumlah pereaksi pembatas.
Pereaksi berlebih, di sisi lain, tidak habis seluruhnya selama reaksi. Pereaksi ini masih ada sisa setelah reaksi selesai. Pereaksi berlebih tidak mempengaruhi hasil reaksi, tetapi dapat digunakan untuk memastikan bahwa pereaksi pembatas habis seluruhnya, sehingga reaksi berjalan hingga selesai. Pereaksi berlebih juga dapat digunakan untuk meningkatkan laju reaksi atau untuk menghindari reaksi samping yang tidak diinginkan.
Contoh Reaksi Kimia
Contoh reaksi kimia yang menunjukkan penggunaan pereaksi pembatas dan pereaksi berlebih adalah reaksi antara asam klorida (HCl) dan natrium hidroksida (NaOH) untuk menghasilkan garam natrium klorida (NaCl) dan air (H2O):
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Misalkan kita memiliki 1 mol HCl dan 2 mol NaOH. Dalam reaksi ini, HCl adalah pereaksi pembatas karena habis terlebih dahulu, sedangkan NaOH adalah pereaksi berlebih. Hal ini karena perbandingan stoikiometri antara HCl dan NaOH adalah 1:1, artinya 1 mol HCl bereaksi dengan 1 mol NaOH. Oleh karena itu, hanya 1 mol NaOH yang bereaksi, sedangkan 1 mol NaOH lainnya tersisa sebagai pereaksi berlebih.
Hasil reaksi ini adalah 1 mol NaCl dan 1 mol H2O. Jumlah produk yang dihasilkan ditentukan oleh jumlah pereaksi pembatas, yaitu HCl. Pereaksi berlebih, NaOH, tidak mempengaruhi jumlah produk yang dihasilkan.
Contoh soal pereaksi pembatas seringkali ditemui dalam kimia, dan seringkali kita perlu menggunakan konsep “jika” atau “mungkin” untuk menentukan jawabannya. Nah, untuk lebih memahami penggunaan kata-kata seperti “jika” dan “mungkin” dalam konteks kimia, kamu bisa belajar tentang contoh soal modals di sini.
Dengan memahami modals, kamu bisa lebih mudah menganalisis contoh soal pereaksi pembatas dan menentukan pereaksi mana yang akan habis terlebih dahulu dalam suatu reaksi kimia.
Hubungan Pereaksi Pembatas dengan Stoikiometri
Stoikiometri merupakan ilmu yang mempelajari tentang kuantitas zat yang terlibat dalam reaksi kimia. Dalam konteks pereaksi pembatas, stoikiometri berperan penting dalam menentukan pereaksi mana yang akan habis terlebih dahulu dalam suatu reaksi dan menentukan jumlah produk yang dihasilkan.
Peran Stoikiometri dalam Menentukan Pereaksi Pembatas
Stoikiometri membantu kita memahami hubungan kuantitatif antara reaktan dan produk dalam suatu reaksi kimia. Dengan menggunakan perbandingan koefisien reaksi, kita dapat menghitung jumlah mol reaktan yang diperlukan untuk bereaksi sempurna dengan reaktan lainnya. Pereaksi pembatas adalah reaktan yang habis terlebih dahulu dalam suatu reaksi, sehingga menentukan jumlah produk yang dihasilkan.
Contoh Perhitungan Stoikiometri untuk Menentukan Pereaksi Pembatas
Misalnya, kita ingin mengetahui pereaksi pembatas dalam reaksi antara 10 gram natrium (Na) dan 15 gram klorin (Cl2) untuk menghasilkan natrium klorida (NaCl).
Reaksi kimia: 2Na + Cl2 → 2NaCl
Langkah-langkah perhitungan:
1. Hitung mol setiap reaktan:
– Mol Na = (10 gram Na) / (22.99 gram/mol Na) = 0.435 mol Na
– Mol Cl2 = (15 gram Cl2) / (70.90 gram/mol Cl2) = 0.212 mol Cl2
2. Tentukan pereaksi pembatas dengan membandingkan mol reaktan dengan koefisien reaksi:
– Dari persamaan reaksi, 2 mol Na bereaksi dengan 1 mol Cl2.
– Rasio mol Na terhadap Cl2 adalah 0.435 mol Na / 0.212 mol Cl2 = 2.05.
– Rasio ini lebih besar dari 2, yang berarti Na tersedia dalam jumlah lebih banyak daripada yang dibutuhkan untuk bereaksi sempurna dengan Cl2.
– Oleh karena itu, Cl2 adalah pereaksi pembatas.
3. Hitung jumlah produk yang dihasilkan berdasarkan pereaksi pembatas:
– Karena Cl2 adalah pereaksi pembatas, maka jumlah NaCl yang dihasilkan ditentukan oleh jumlah Cl2 yang tersedia.
– Dari persamaan reaksi, 1 mol Cl2 menghasilkan 2 mol NaCl.
– Jadi, jumlah NaCl yang dihasilkan adalah 2 * 0.212 mol = 0.424 mol NaCl.
Konsep Mol dan Perbandingan Koefisien Reaksi dalam Perhitungan Stoikiometri
Konsep mol dan perbandingan koefisien reaksi merupakan kunci dalam perhitungan stoikiometri. Mol adalah satuan jumlah zat yang menyatakan jumlah partikel dalam suatu zat. Satu mol zat mengandung 6.022 x 1023 partikel (bilangan Avogadro).
Perbandingan koefisien reaksi menunjukkan rasio stoikiometri antara reaktan dan produk dalam suatu reaksi. Koefisien reaksi menunjukkan jumlah relatif mol setiap zat yang terlibat dalam reaksi.
Contohnya, dalam reaksi 2Na + Cl2 → 2NaCl, koefisien reaksi menunjukkan bahwa 2 mol Na bereaksi dengan 1 mol Cl2 untuk menghasilkan 2 mol NaCl.
Perbandingan koefisien reaksi memungkinkan kita untuk menghitung jumlah mol reaktan atau produk yang terlibat dalam reaksi, dan dengan demikian menentukan pereaksi pembatas dan jumlah produk yang dihasilkan.
Pentingnya Memahami Pereaksi Pembatas
Dalam dunia kimia, pereaksi pembatas memegang peranan penting dalam menentukan hasil reaksi. Pereaksi pembatas adalah pereaksi yang habis lebih dulu dalam reaksi kimia, sehingga membatasi jumlah produk yang dapat terbentuk. Memahami konsep ini sangat krusial, karena akan membantu kita untuk memprediksi hasil reaksi dan merancang eksperimen dengan lebih efisien.
Mengapa Memahami Pereaksi Pembatas Penting?
Memahami konsep pereaksi pembatas sangat penting dalam kimia karena:
- Menentukan Jumlah Produk: Pereaksi pembatas menentukan jumlah maksimum produk yang dapat dihasilkan dalam reaksi kimia. Jika salah satu pereaksi habis, reaksi akan berhenti, meskipun pereaksi lainnya masih tersedia.
- Efisiensi Reaksi: Mengetahui pereaksi pembatas memungkinkan kita untuk menggunakan pereaksi dengan lebih efisien. Dengan menghitung pereaksi pembatas, kita dapat menghindari pemborosan pereaksi yang tidak akan bereaksi sepenuhnya.
- Memprediksi Hasil Reaksi: Pereaksi pembatas memungkinkan kita untuk memprediksi hasil reaksi dengan lebih akurat. Dengan mengetahui pereaksi pembatas, kita dapat menghitung jumlah produk yang akan dihasilkan dan sisa pereaksi yang tidak bereaksi.
Peran Pereaksi Pembatas dalam Merancang Eksperimen
Pengetahuan tentang pereaksi pembatas sangat membantu dalam merancang eksperimen kimia. Misalnya, dalam sintesis senyawa organik, kita dapat menggunakan pereaksi pembatas untuk memastikan bahwa reaksi berjalan sesuai rencana dan menghasilkan produk yang diinginkan.
- Mengontrol Jumlah Produk: Dengan menggunakan pereaksi pembatas, kita dapat mengontrol jumlah produk yang dihasilkan dalam reaksi kimia. Ini sangat penting dalam sintesis kimia, di mana kita ingin mendapatkan produk dengan kemurnian tinggi dan hasil yang optimal.
- Meminimalkan Pembentukan Produk Samping: Reaksi kimia sering menghasilkan produk samping selain produk utama. Dengan menggunakan pereaksi pembatas, kita dapat meminimalkan pembentukan produk samping dan meningkatkan hasil produk utama.
- Menghindari Pemborosan Pereaksi: Pereaksi pembatas membantu kita untuk menggunakan pereaksi dengan lebih efisien dan menghindari pemborosan. Dengan mengetahui pereaksi pembatas, kita dapat menghitung jumlah pereaksi yang tepat untuk reaksi dan menghindari penggunaan pereaksi yang berlebihan.
Contoh Kasus Ketidakpahaman Pereaksi Pembatas
Bayangkan sebuah pabrik kimia yang memproduksi pupuk. Pupuk ini dibuat dengan mencampurkan nitrogen dan fosfor. Jika pabrik tersebut tidak memahami konsep pereaksi pembatas, mereka mungkin akan menggunakan nitrogen dan fosfor dalam jumlah yang sama.
Misalnya, jika pabrik menggunakan 100 kg nitrogen dan 100 kg fosfor, dan reaksi kimia membutuhkan 1 mol nitrogen untuk bereaksi dengan 2 mol fosfor, maka nitrogen akan menjadi pereaksi pembatas. Ini berarti bahwa hanya 50 kg fosfor yang akan bereaksi dengan nitrogen, dan 50 kg fosfor lainnya akan terbuang sia-sia. Hal ini akan menyebabkan kerugian ekonomi yang signifikan bagi pabrik.
Selain itu, penggunaan pereaksi yang berlebihan dapat menyebabkan masalah lingkungan. Dalam contoh di atas, 50 kg fosfor yang tidak bereaksi dapat mencemari lingkungan dan menyebabkan kerusakan ekosistem.
Soal Pereaksi Pembatas Tingkat Lanjut: Contoh Soal Pereaksi Pembatas
Soal pereaksi pembatas tingkat lanjut melibatkan reaksi kimia yang lebih kompleks, biasanya dengan lebih dari dua reaktan, dan memerlukan pemahaman mendalam tentang stoikiometri. Dalam soal ini, kamu perlu menentukan pereaksi pembatas dengan mempertimbangkan perbandingan mol dan koefisien reaksi, serta menghitung hasil reaksi berdasarkan pereaksi pembatas.
Contoh Soal 1: Reaksi Esterifikasi
Esterifikasi adalah reaksi antara asam karboksilat dan alkohol untuk membentuk ester dan air. Reaksi ini umumnya dikatalisis oleh asam kuat. Berikut adalah contoh soal pereaksi pembatas tingkat lanjut yang melibatkan reaksi esterifikasi:
Asam asetat (CH3COOH) direaksikan dengan etanol (C2H5OH) dalam suasana asam untuk menghasilkan etil asetat (CH3COOC2H5) dan air (H2O). Reaksi ini dijalankan dengan menggunakan 20,0 g asam asetat dan 15,0 g etanol. Tentukan pereaksi pembatas dan hitung massa etil asetat yang dihasilkan.
Langkah Penyelesaian
- Tulis persamaan reaksi setara:
- Hitung mol masing-masing reaktan:
- Mol asam asetat = 20,0 g / 60,05 g/mol = 0,333 mol
- Mol etanol = 15,0 g / 46,07 g/mol = 0,326 mol
- Tentukan pereaksi pembatas:
- Dari persamaan reaksi, 1 mol asam asetat bereaksi dengan 1 mol etanol. Jadi, jika 0,333 mol asam asetat bereaksi, dibutuhkan 0,333 mol etanol.
- Karena kita hanya memiliki 0,326 mol etanol, maka etanol adalah pereaksi pembatas.
- Hitung massa etil asetat yang dihasilkan:
- Dari persamaan reaksi, 1 mol etanol menghasilkan 1 mol etil asetat.
- Massa etil asetat = 0,326 mol x 88,11 g/mol = 28,7 g
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
Kunci Jawaban
Pereaksi pembatas dalam reaksi ini adalah etanol. Massa etil asetat yang dihasilkan adalah 28,7 g.
Contoh Soal 2: Reaksi Pembakaran
Reaksi pembakaran adalah reaksi kimia yang melibatkan reaksi cepat antara suatu zat dengan oksidator, biasanya oksigen, untuk menghasilkan panas dan cahaya. Contoh soal berikut menunjukkan perhitungan pereaksi pembatas dalam reaksi pembakaran:
Metana (CH4) dibakar dengan oksigen (O2) untuk menghasilkan karbon dioksida (CO2) dan air (H2O). Reaksi ini dijalankan dengan menggunakan 10,0 g metana dan 50,0 g oksigen. Tentukan pereaksi pembatas dan hitung massa karbon dioksida yang dihasilkan.
Langkah Penyelesaian
- Tulis persamaan reaksi setara:
- Hitung mol masing-masing reaktan:
- Mol metana = 10,0 g / 16,04 g/mol = 0,624 mol
- Mol oksigen = 50,0 g / 32,00 g/mol = 1,56 mol
- Tentukan pereaksi pembatas:
- Dari persamaan reaksi, 1 mol metana bereaksi dengan 2 mol oksigen. Jadi, jika 0,624 mol metana bereaksi, dibutuhkan 1,25 mol oksigen.
- Karena kita memiliki 1,56 mol oksigen, maka metana adalah pereaksi pembatas.
- Hitung massa karbon dioksida yang dihasilkan:
- Dari persamaan reaksi, 1 mol metana menghasilkan 1 mol karbon dioksida.
- Massa karbon dioksida = 0,624 mol x 44,01 g/mol = 27,5 g
CH4 + 2O2 → CO2 + 2H2O
Kunci Jawaban
Pereaksi pembatas dalam reaksi ini adalah metana. Massa karbon dioksida yang dihasilkan adalah 27,5 g.
Simpulan Akhir
Memahami konsep pereaksi pembatas merupakan kunci untuk memahami reaksi kimia secara lebih mendalam. Dengan menguasai konsep ini, kita dapat memprediksi hasil reaksi, merancang eksperimen yang efisien, dan bahkan mengoptimalkan proses produksi dalam berbagai bidang. Pereaksi pembatas bukanlah sekadar teori abstrak, tetapi konsep yang nyata dan sangat bermanfaat dalam dunia kimia dan kehidupan sehari-hari.